酸胁迫对鼠伤寒沙门氏菌抗酸性、细胞膜 及膜蛋白的影响
2021-08-31李琳琼张丽君高瑀珑
李琳琼,洪 静,张丽君,高瑀珑*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心, 江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
沙门氏菌属是食品中常见的致病菌,在自然界分布广泛,由其引起的食品中毒事件数量在食品中毒事件中常居首位[1]。食源沙门氏菌的爆发将对食品工业造成巨大的经济损失,严重威胁消费者的安全。在食品的生产、加工以及储藏过程中,沙门氏菌常常会遭受酸、碱、温度、渗透压以及消毒剂等一系列不适环境的胁迫作用,诱发其产生胁迫应激反应来提高存活率[2]。食品工业中常采用各种灭菌方法来保证食品的微生物安全,其中利用有机酸来杀菌,因其温和性、有效性及实用性等优点,能够满足当前消费者对食品天然、新鲜、微加工及少添加剂等消费需求,且由于其工业化应用的易操作性和有效的灭菌效果,备受消费者青睐,在食品工厂中已被广泛应用[3]。
微生物的耐酸性不仅受到遗传因素的影响,还受到环境因素的影响[4]。微生物对不良环境因素产生抗性或适应性反应的机制,一直是微生物研究热点,然而,微生物对不适生存环境产生抗性或适应性反应机制目前尚未研究清楚[5-6],深入系统地研究食源性致病菌在食品加工环境中的酸胁迫响应机制,以期为有机酸杀菌技术在食品工业中的广泛应用奠定理论基础。Fernández等[7]研究发现,粪肠球菌在经有机酸调节的培养基中培养后,再置于70 ℃的高温下处理,与对照菌株相比其D值明显增加,说明酸适应性菌株对高温环境产生了抗性。Koutsoumanis等[8]将单增李斯特菌置于亚致死的弱酸中处理一段时间,发现其对强酸致死的抵抗作用提高。Yang Yishan等[9]认为,微生物对不良环境产生的抗性与细胞膜流动性之间具有一定的相关性,而微生物细胞膜脂质的变化显著影响细胞膜的流动性。细菌细胞膜是由磷脂双分子层与蛋白质构成的富有弹性的半透性薄膜。流动的脂质双分子层是生物膜结构的基本特征,适宜的流动性是保证细胞进行正常生理功能的重要条件[10]。 Liu Zhiwei等[11]研究表明,细胞膜的磷脂组成及其结构一般会影响微生物细胞膜的流动性。Chen Mingju等[12]研究发现,微生物处于高温、低温、酸和胆盐等压力环境下其蛋白的表达会发生相应的变化,起到稳定膜结构、维持细胞功能的作用。大多数微生物在不适生长的环境中会产生应激反应[13]。目前国内外关于沙门氏菌抗酸性及其机制的研究不多见。李琳琼等[14]研究发现柠檬酸、乳酸、醋酸和苹果酸4 种有机酸胁迫均可诱导鼠伤寒沙门氏菌CGMCC 1.1190抗酸性增加,其中柠檬酸诱导能力最强。本研究以柠檬酸作为胁迫因素对鼠伤寒沙门氏菌CGMCC 1.1190进行多次胁迫处理,研究其抗酸性变化及其机制,然而迄今对微生物进行多次酸环境条件胁迫研究其抗性及其适应性反应的机制尚不清楚[15]。 本实验以食品生产加工中常见的鼠伤寒沙门氏菌为研究对象,研究酸胁迫作用下其抗酸性的变化及其与形态、细胞膜通透性、流动性以及膜蛋白表达的关系,旨在综合分析酸胁迫诱导鼠伤寒沙门氏菌产生抗酸性的变化及其机制,对优化食品加工条件、加强食品安全预测及控制体系建立具有重要意义。
1 材料与方法
1.1 菌株、材料与试剂
鼠伤寒沙门氏菌(Salmonella typhimurium)CGMCC 1.1190(简称CGMCC 1.1190),购于中国普通微生物菌种保藏管理中心。
柠檬酸、氯化钠、氢氧化钠、氯化镁、盐酸、氯仿、三羟甲基氨基甲烷(Tris)、戊二醛、乙醇、冰乙酸、 甲醇,均为分析纯;胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基、胰蛋白胨大豆琼脂(trypticase soy agar,TSA)培养基 吴江康宁生命科学有限公司;LIVE/DEAD BacLightTM细菌活性试剂盒、400 目尼龙筛网、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、96 孔微量酶标板、彩虹180广谱蛋白Marker、TritionΧ-114、质量分数30%聚丙烯酰胺制胶液、5×蛋白质上样缓冲液、过硫酸铵、考马斯亮蓝R250 南京丁贝生物科技有限公司。
1.2 仪器与设备
LDZΧ-50FBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;GNP-9160型隔水式恒温培养箱、SF-CF-2A型超净工作台 上海三发科学仪器有限公司;PHS-3G型pH计 上海仪电科学仪器股份有限公司;GL-21M高速冷冻离心机 上海市离心机械研究所有限公司; EVO-LS10型扫描电子显微镜、A1正置荧光显微镜 德国ZEISS公司;K850型临界点干燥仪 英国QUORUM公司;108AUTO镀金仪 英国CRESSINGTON公司;FACSVerse型流式细胞仪 美国BD公司;DSC-8000差示扫描量热仪 美国珀金埃尔默股份有限公司;ZF-258凝胶成像系统 上海金鹏分析仪器有限公司;JY-SCZ2+电泳仪 北京君意东方电泳设备有限公司;HZQ-F160型恒温振荡培养箱 太仓市实验设备厂;ME55型塞多斯精密电子天平 北京塞多斯天平有限公司;SK-1型快速混匀器 金坛市杰瑞尔电器有限公司。
1.3 方法
1.3.1 菌种活化与预处理
实验菌株CGMCC 1.1190经活化后,接入pH 7.2的TSB培养基,于37 ℃、140 r/min摇床振荡培养18 h后以1%(体积分数,后同)的接种量转接至150 mL新鲜的TSB培养基中,37 ℃摇床振荡培养18 h至稳定期,菌体浓度约为1.0×108CFU/mL。
1.3.2 酸胁迫处理鼠伤寒沙门氏菌CGMCC 1.1190
pH 3.0、2.7、2.5、2.0的TSB培养基的配制:以0.05 mol/L柠檬酸调节TSB培养基的pH值分别为3.0、2.7、2.5和2.0,灭菌备用。
CGMCC 1.1190的酸胁迫处理及其培养:分别取10 mL 1.3.1节活化后的CGMCC 1.1190培养液,离心(4 ℃、5 000 r/min,10 min),弃上清液,重悬于等体积的pH值为3.0、2.7和2.5的TSB培养基中进行酸胁迫处理,37 ℃处理30 min,分别按接种量1.5%、1.8%、2.0%将各个酸度胁迫处理后的CGMCC 1.1190菌种分别接种于100 mL TSB培养基中,37 ℃振荡培养18 h,再分别取10 mL培养液,离心(4 ℃、5 000 r/min,10 min),弃去上清液,重悬于等体积的pH值为3.0、2.7和2.5的TSB培养基中进行酸胁迫处理,37 ℃下处理30 min;以此类推,重复上述摇床振荡培养和酸胁迫处理共12 次后备用。
CGMCC 1.1190抗酸菌株的获得:取上述pH值为3.0、2.7和2.5的TSB培养基中反复胁迫培养处理12 次的CGMCC 1.1190培养液100 mL,离心(4 ℃、5 000 r/min,10 min),弃去上清液,用质量分数0.85%生理盐水洗涤1 次,重悬于等体积的生理盐水,调整菌悬液浓度为107CFU/mL,并将其分装在于10 mL的无菌离心管备用。
1.3.3 鼠伤寒沙门氏菌CGMCC 1.1190抗酸性参数D值的测定
D值表示在一定的致死条件下杀死某种细菌数量的90%所需要的时间。D值越大,表明细菌对致死条件的抗性越强[16]。
分别测定1.3.2节中每次、每种pH值条件下酸处理5、10、15、20、25、30 min时的CGMCC 1.1190存活量,在TSA平板上按文献方法进行菌落计数[17],共6 个时间点,以酸处理的时间为横坐标,菌体存活量为纵坐标,对此 6 个时间点进行线性回归分析,所得线性回归方程的斜率的负倒数即为D值,分别测得CGMCC 1.1190在pH值为3.0、2.7和2.5 TSB培养基中的D3.0、D2.7、D2.5,以线形回归方程的决定系数R2来评价D值拟合优度。不同pH值作用下,按照下式计算D值。

式中:D值表示在一定pH值作用下使CGMCC 1.1190的数量降低1 个对数单位所需的时间/min;t为酸处理时间/min;N0、Nt分别表示初始和酸处理t时间之后存活的CGMCC 1.1190菌的数量。
1.3.4 鼠伤寒沙门氏菌CGMCC 1.1190个体形态的观察
对1.3.1节的原始对照菌株和1.3.2节得到的抗酸性CGMCC 1.1190菌株在TSA平板上培养48 h后,直接观察CGMCC 1.1190的菌落形态;以无菌接种环挑取单菌落,用结晶紫和碘液进行简单染色,在光学显微镜下观察CGMCC 1.1190个体形态。
采用扫描电子显微镜对CGMCC 1.1190个体形态的观察参照李小媚等[18]的方法,并做适当修改。将1.3.1节活化的CGMCC 1.1190原始对照菌株与1.3.2节获得的3 株抗酸性菌株按体积分数1%分别接种于装有100 mL TSB培养基的三角瓶中,37 ℃、140 r/min摇床振荡培养18 h,离心(4 ℃、5 000 r/min,15 min),弃去上清液,以生理盐水洗涤2 次;加入质量分数2.5%戊二醛浸没菌体,振荡3~5 min,使菌体与固定液充分接触,室温固定5 h,离心(4 ℃、5 000 r/min,15 min),弃去上清液,加入缓冲液A(10 mmol/L磷酸盐缓冲溶液, pH值7.2~7.4),振荡5 min,离心(4 ℃、5 000 r/min,15 min),弃去上清液,重复2 次;将离心管中的4 株菌株依次用体积分数30%、50%、70%、80%、90%、95%的乙醇溶液离心(25 ℃、5 000 r/min,15 min),弃去上清液,并重悬于无水乙醇中,静置10 min;分别取10 μL上述样品放置于盖玻片上,采用临界点干燥仪进行干燥,将其固定在载物台上,置于镀金仪中真空喷金90 s,用扫描电子显微镜拍照。扫描电子显微镜使用的电压为10 kV,在放大10 000 倍视野下进行观察。
1.3.5 鼠伤寒沙门氏菌CGMCC 1.1190 菌体细胞膜 通透性的测定
细菌细胞膜通透性测定原理参见文献[19]。SYTO9是一种绿色荧光核酸染料,可以穿过细胞壁和细胞膜与DNA结合;碘化丙啶(propidium iodide,PI)是一种红色荧光核酸染料,只能穿过不完整的细胞壁、细胞膜,两种染料共同使用可以指示细菌细胞膜通透性的变化。当同时用SYTO9和PI进行染色(SYTO9/PI双染)的时候,PI染料会削弱SYTO9的荧光强度,在死亡细胞中,PI染料可以取代SYTO9染料与核酸结合。当采用流式细胞仪对细菌悬液中经SYTO9/PI双染的CGMCC 1.1190细胞进行扫描,会将不同的荧光信号转换成相应的数据信号,经计算处理形成双参数的二维细胞流式散点图。因此,将SYTO9/PI双染法和流式细胞仪结合可用来判定菌体的活性状态,得到细菌中活死细胞的比例,并指示细胞膜通透性的变化。
参照Wang Guangyu等[20]的方法测定CGMCC 1.1190菌体细胞膜通透性,并进行适当修改。具体方法如下:将1.3.1节活化的CGMCC 1.1190原始对照菌株与1.3.2节获得的3 株抗酸性菌株按体积分数1%分别接种于盛有10 mL新鲜灭菌TSB的试管中(20 mm×200 mm),37 ℃、140 r/min摇床振荡培养18 h至稳定期,离心(4 ℃、5 000 r/min,10 min),弃去上清液,重悬于pH 2.0的TSB培养基中酸处理10 min,分别取1 mL的CGMCC 1.1190菌悬液,离心(4 ℃、5 000 r/min,10 min),弃去上清液,用蒸馏水洗涤1 次,重悬于1 mL蒸馏水中,将500 μL的SYTO9与500 μL PI 染液混匀后加到上述4 种菌悬液中进行染色。取1 mL未经pH 2.0酸处理的原始对照菌株的CGMCC 1.1190菌悬液,离心(4 ℃、5 000 r/min,10 min),弃去上清液,重悬于1 mL的体积分数75%乙醇反复振荡处理1 h,离心(4 ℃、 5 000 r/min,10 min),弃去上清液,用蒸馏水洗涤1 次,重悬于1 mL蒸馏水,加入1 mL PI染液进行染色。
将上述经荧光染料染色的5 种菌悬液,在室温暗处孵育30 min,离心(4 ℃、5 000 r/min,10 min),弃去上清液,重悬于2 mL蒸馏水,调整菌悬液的浓度为106~107CFU/mL,由400 目尼龙筛网过滤后,置于 流式细胞仪的进样针处,吸取单细胞进入流动室进行检测分析。流式细胞仪的激发光波长488 nm,发射光波长610 nm,以细胞流速为300粒子/s,计数10 000 个细胞。以未经过染色的原始对照CGMCC 1.1190菌体细胞作为阴性对照组;以体积分数75%乙醇溶液对原始对照组CGMCC 1.1190菌体细胞处理1 h后,再经PI染色作为阳性对照组。
1.3.6 鼠伤寒沙门氏菌CGMCC 1.1190细胞膜磷脂相变温度的测定
细菌细胞膜磷脂相变温度Tc的测定原理参见文献[21]。采用差示扫描量热仪测定细菌细胞膜磷脂的相变温度Tc,Tc指组成磷脂的酰基链由固态晶体向液体无定型态转变时的临界温度,当外界温度超过Tc时,酰基链活动性增强,细胞膜流动性增大。
CGMCC 1.1190菌体细胞膜磷脂相变温度的测定参照Casadei等[22]的方法,并作适当修改。具体方法如下:分别配制无菌缓冲液A和无菌缓冲液B(10 mmol/L MgCl2与pH 7.5 250 mmol/L Tris)。将1.3.1节活化的CGMCC 1.1190原始对照菌株与1.3.2节获得的3 株抗酸性菌株按体积分数1%分别接种于TSB培养基中,37 ℃、140 r/min摇床振荡培养至稳定期,分别各取1 000 mL的4 株菌株培养液,离心(4 ℃、3 000 r/min,15 min)、弃去上清液,用缓冲液B洗涤1 次,重悬于14 mL的缓冲液B中,加入20 mL氯仿和40 mL甲醇;37 ℃摇床振荡30 min;再加入20 mL氯仿和20 mL缓冲液B,37 ℃摇床振荡2 h。室温静置20 min,收集下层氯仿层,自然挥发12 h后,取10 mg样品置于DSC-8000差示扫描量热仪中,在-20 ℃条件下预冷35 min,以10 ℃/min梯度的程序升温,测定CGMCC 1.1190在-10~60 ℃温度范围内的细胞膜磷脂相变温度。
1.3.7 鼠伤寒沙门氏菌CGMCC 1.1190菌体膜蛋白的测定
CGMCC 1.1190菌体膜蛋白的提取:CGMCC 1.1190菌体膜蛋白的提取参照夏金兰等[23]的方法,作适当修改。方法如下:配制无菌缓冲液C(pH 7.4 50 mmol/L Tris-HCl),将1.3.1节活化的CGMCC 1.1190原始对照菌株与1.3.2节获得的3 株抗酸性菌株按体积分数1%接种量接种于装有10 mL新鲜灭菌的TSB试管(20 mm×200 mm)中,37 ℃、140 r/min摇床振荡培养18 h,离心(4 ℃、5 000 r/min,10 min)、收集菌体,用缓冲液C洗涤2 次,重悬于缓冲液C中;用超声波处理5 min(超声功率为300 W,15 s/次,间隔10 s),离心(4 ℃、5 000 r/min,10 min),取上清液再次离心(4 ℃、15 000 r/min,20 min);加入8% TritionΧ-114浸没沉淀,溶解30 min,离心(4 ℃、15 000 r/min,20 min),加入100 μL去离子水浸没沉淀,溶解10 min,-20 ℃低温保存备用。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分析CGMCC 1.1190菌体膜蛋白:采用BCA蛋白浓度测定试剂盒测定上述CGMCC 1.1190原始对照菌株与3 株抗酸菌株膜蛋白质量浓度,加入缓冲液A,将此4 株菌株膜蛋白溶液稀释至5 μg/μL,将各菌株膜蛋白溶液与蛋白上样缓冲液按照1∶1混匀,共100 μL,沸水浴10 min,各取10 μL分别加入电泳凝胶板的加样孔中。使用5%浓缩胶和12%分离胶。浓缩胶的部分电压设置80 V,电泳30 min,分离胶的部分电压设置120 V,电泳90 min。采用考马斯亮蓝R250对凝胶染色2 h后,加入脱色液,脱色8 h,至各个电泳谱带清晰可见后,采用凝胶成像系统对其进行扫描成像,并采用Image Lab 4.0.1软件对所得SDS-PAGE图谱进行分析。
1.4 数据统计分析
实验数据通过SPSS 22.0软件处理,采用Duncan多重比较进行显著性差异分析,P<0.05表示差异显著。实验结果以平均值±标准差表示。
2 结果与分析
2.1 酸胁迫处理对鼠伤寒沙门氏菌CGMCC 1.1190 D值的影响
CGMCC 1.1190在柠檬酸调节pH值为3.0、2.7和2.5的TSB培养基中胁迫处理12 次后,D值的变化见表1。所有处理组D值的拟合度均较高(R2>0.94);CGMCC 1.1190在经柠檬酸调节pH值至3.0、2.7和2.5的TSB培养基反复酸胁迫后,随处理次数的增加,D值增大,表明其对酸的抗性增加。在pH 2.5胁迫条件下,CGMCC 1.1190第1次酸处理后的D值为(5.15±0.31)min, 第12次热处理后,D值增加到(196.08±0.45)min (P<0.05),是第1次酸胁迫处理后的38.1 倍;在pH 2.7胁迫条件下,第12次酸胁迫后D值是第1次酸胁迫时D值的11.5 倍;在pH 3.0胁迫条件下,第12次酸胁迫后D值是第1次热胁迫处理后的3.3 倍。在pH 2.5胁迫条件下,CGMCC 1.1190经反复胁迫作用后抗酸性增加得最快。研究结果说明,CGMCC 1.1190经酸胁迫后抗酸性增加,经pH值为3.0、2.7、2.5反复酸胁迫处理12 次并转接培养,D值随酸胁迫次数的增加不断增大,且胁迫pH值越低,D值越大,抗酸性越强。

表1 CGMCC 1.1190经不同pH值的酸胁迫处理后D值的变化Table 1 Changes in D values of Salmonella typhimurium CGMCC 1.1190 under acid stress with different pHs
环境胁迫是指外界环境条件接近或超过生物体忍耐极限的胁迫作用[24]。酸对微生物的胁迫作用一直是微生物学研究的热点,而微生物的抗酸性受种类、生长时期和环境因素的影响[25-26]。Cebrián等[27]通过对金黄色葡萄球菌进行5、30、120 min的亚致死浓度的酸处理后,再置于强酸下,发现其对酸的抗性增强,这与本研究的结论一致。
2.2 酸胁迫处理对鼠伤寒沙门氏菌CGMCC 1.1190菌落形态的影响
CGMCC 1.1190在pH值为3.0、2.7和2.5的TSB培养基中胁迫处理12 次后,其菌落形态的变化如图1所示。在相同的稀释倍数下,未经酸胁迫处理的对照菌株CGMCC 1.1190培养48 h后,在TSA培养基上菌落较大、平坦、边缘整齐、质地均匀、呈乳白色,菌落正反面、边缘与中央部位的颜色一致(图1A);经过pH 3.0柠檬酸胁迫后,菌落形态与对照菌株差异明显,部分菌落的直径变小、,菌落隆起、表面湿润、光滑、有光泽、菌落边缘透明(图1B);经pH 2.7、pH 2.5酸胁迫后,对照菌株相比,多数菌落直径变得更小,菌落边缘透明、与中央部位的颜色不一致(图1C、D)。
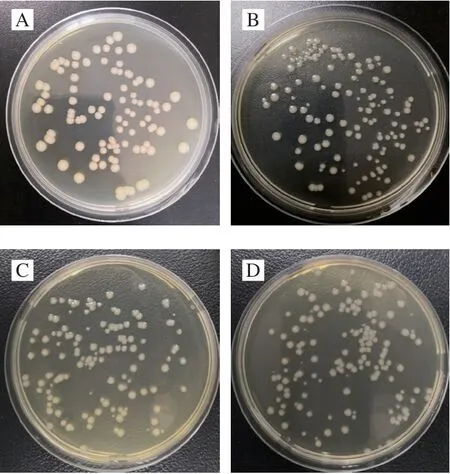
图1 鼠伤寒沙门氏菌CGMCC 1.1190经酸胁迫前后的菌落形态Fig.1 Colony morphology of original strain and acid-resistant strains
2.3 酸胁迫处理对鼠伤寒沙门氏菌CGMCC 1.1190个体形态的影响
CGMCC 1.1190在pH值为3.0、2.7和2.5的TSB培养基胁迫处理12 次后,其在光学显微镜下个体形态的变化见图2。未经酸胁迫处理的对照菌株CGMCC 1.1190在显微镜下呈短杆状或球状(图2A);经pH 3.0酸胁迫后的部分个体的形态明显变长(图2B);而经pH 2.7和pH 2.5酸胁迫后,大部分个体变为更明显的长杆状,且酸胁迫的pH值越低,个体形态变化越明显(图2C、D)。
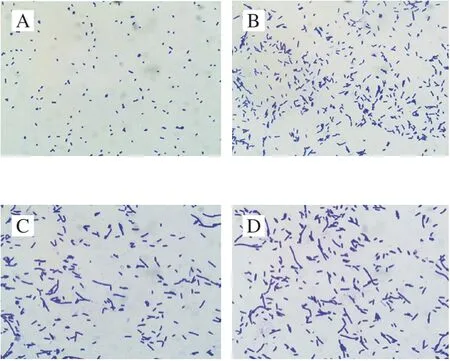
图2 鼠伤寒沙门氏菌CGMCC 1.1190在光学显微镜下的个体形态(×1 000)Fig.2 Cellular morphology of S.typhimurium CGMCC 1.1190 under optical microscope (× 1 000)
CGMCC 1.1190在pH值为3.0、2.7和2.5的TSB培养基中酸胁迫12 次后,其在扫描电子显微镜下个体形态的变化见图3。与对照菌株CGMCC 1.1190相比,经酸胁迫并转接培养的菌株在扫描电子显微镜下个体形态变化明显,对照菌株的个体形态呈典型的单短杆状,外形饱满,表面光滑,长度比较均匀一致(图3A);经pH 3.0酸胁迫后,菌株长度差异变化明显,部分菌株变为长杆状(图3B);经pH 2.7酸胁迫后的菌株个体变得更细长, 且在其表面产生了较多的黏液状、胶质状的物质,菌株聚集度增加(图3C);经pH 2.5酸胁迫处理后细长的杆状菌株,其表面粗糙,覆盖胶质状物质,多数菌联结在一起(图3D)。

图3 鼠伤寒沙门氏菌CGMCC 1.1190在扫描电子显微镜下的个体形态 (×10 000)Fig.3 Cellular morphology of S.typhimurium CGMCC 1.1190 under scanning electron microscope (× 10 000)
上述研究结果表明,CGMCC 1.1190酸胁迫株的菌落形态和个体形态与原始对照菌株相比差异显著,这种形态的变化可能是其在酸胁迫环境下生存的一种自我保护方式。高璐等[28]以副溶血性弧菌为研究对象,对其在低盐度、低pH值和高温等条件下进行适应性传代培养,通过扫描电子显微镜观察其形态的变化,研究发现,低渗透压可诱导其由短杆状变成光滑的球体,低pH值影响了其表面的粗糙度。李忠新等[29]采用K-B法对细菌进行药物敏感性实验,筛选出耐β-内酰胺类抗菌药物的菌株,抗药菌株与标准菌株相比其个体形态变长。与对照菌株相比,本研究发现3 株抗酸性CGMCC 1.1190菌株的个体形态变长,菌落变小;随着胁迫pH值的降低,抗酸性菌株表面粗糙度增加,表面覆盖胶质状物质,表明酸胁迫环境对CGMCC 1.1190的个体形态产生较大影响,伴随菌体形态的变化,同时生成一些保护性的分泌物,这有助于其在不适的酸性环境下增强生存能力。
2.4 酸胁迫对鼠伤寒沙门氏菌CGMCC 1.1190菌体细胞膜通透性的影响
CGMCC 1.1190在经pH值为3.0、2.7和2.5的TSB培养基中反复胁迫的3 株抗酸性菌株重悬在pH值为2.0的TSB培养基中酸处理,经流式细胞仪分析的细胞流式散点图如图4所示。由图4C~F中的Q3区可知,该区的细菌细胞数占比均为0,表明在pH 2.0的强酸处理下对照菌株和3 株抗酸性菌株中所有细胞细胞膜的通透性都发生变化。对照菌株和3 株抗酸性菌株置于pH值为2.0的强酸环境中处理10 min后,通过散点图的4C~F的Q2区可知,在此区域内细菌细胞膜的通透性虽然发生一定程度的改变,经过适应期后仍能恢复活性而存活下来,存活细胞数的所占比例分别是62.6%、75.5%、87.4%和97.0%,说明随着酸胁迫pH值的降低,能够恢复活性的细菌细胞数在明显增加。由图4C~F中的Q1区可知,将对照菌株和酸胁迫的3 株抗酸性菌株置于pH值为2.0的强酸环境中处理10 min后,对照菌株的死菌比例为33.8%;3 株抗酸性菌株死菌比例分别为23.2%、9.9%和2.9%,均明显低于对照菌株的死菌比例,且随酸胁迫pH值降低,死菌比例明显降低,表明其抗酸性增强,抗H+的通透性增大。因PI只能穿过不完整的细胞壁和细胞膜,即PI染色区域的死菌比例越高,细菌细胞膜通透性越大。
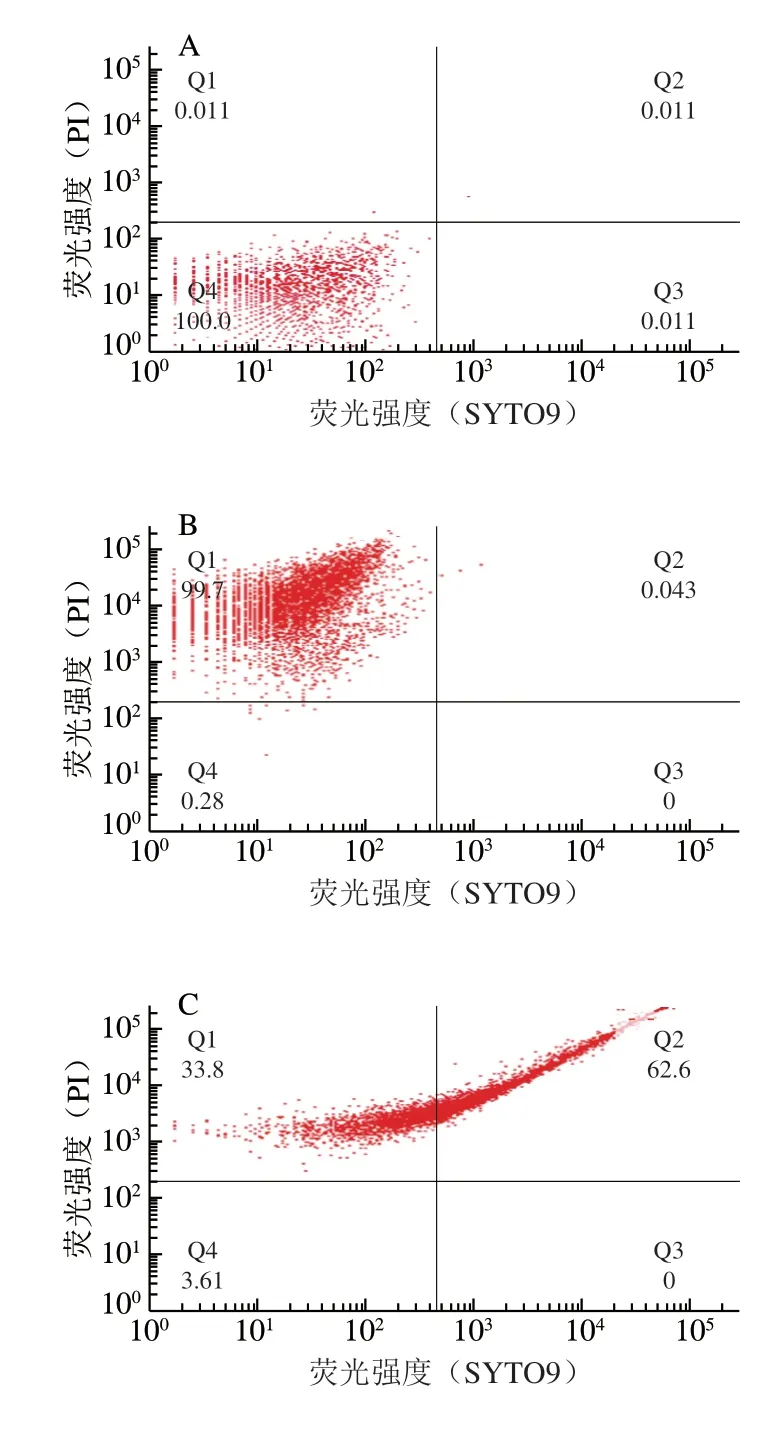

图4 CGMCC 1.1190原始对照菌株及其分别经不同pH值酸胁迫处理并转接培养12 次的抗酸性菌株的SYTO9/PI染色细胞流式散点图Fig.4 Flow cytometric dot plots of unstained and SYTO9/PI stained cells of CGMCC 1.1190 and acid-resistant strains
在相同强酸致死环境下,经过酸胁迫的3 株抗酸性菌株细胞膜的通透性显著低于对照野生菌株细胞膜的通透性。因此推测,与对照野生菌株相比,经过酸胁迫的3 株抗酸性菌株通过降低细胞膜通透性的方式限制了大量H+进入菌体内,减少了H+在菌体内积累对细胞的毒害作用,从而降低了菌株细胞死亡比例。如图4所示,随着酸胁迫pH值降低,CGMCC 1.1190抗酸性菌株细胞偏离Q1区,死菌比例降低,进入Q2区的抗酸性菌株细胞比例增加。本研究通过酸胁迫方式获得的3 株抗酸性的菌株可能通过降低其细胞膜对H+、PI等的通透性,适应强酸致死环境条件;通过提高其对更强的酸环境的耐受度,维持细胞正常的生理功能。
微生物在遭受不适应生长的外界环境条件时,其细胞生理代谢活动会发生改变。流式细胞技术是从细胞水平对将荧光染色的细胞个体进行快速、多参数细胞定量分析技术,针对生物个体的细胞膜通透性、生理代谢活动、凋亡周期等细胞特性,分选特定状态的细胞群体[30]。 微生物在面临不适生长的外界环境时其细胞膜通透性会发生改变,Nonv等[31]研究了抗生素处理的金黄色葡萄球菌和黄褐球菌细胞膜的通透性,发现细胞膜通透性的增大是药物处理细菌致死的机理之一。微生物细胞膜通透性的降低是细菌在胁迫条件下激活的一种生理保护性变化[32]。本研究发现,在一定的pH值范围内,CGMCC 1.1190抗酸性菌株的酸胁迫pH值越低,抗酸性越强,细胞膜通透性越低;酸胁迫后产生抗酸性菌株可能是通过降低细胞膜对H+的通透性,减少H+进入细胞质,达到保护菌体的作用。
2.5 酸胁迫对鼠伤寒沙门氏菌 CGMCC 1.1190细胞膜磷脂相变温度的影响
差示扫描量热法可用于对微生物细胞膜磷脂相变的研究,测定其细胞膜磷脂的物理状态变化时吸收或放出的热量。CGMCC 1.1190在经pH值为3.0、2.7和2.5的TSB培养基中反复酸胁迫12 次并转接培养,获得3 株抗酸性菌株的细胞膜脂类提取物的差示扫描量热图谱见图5。图5A~D中皆出现了一个峰,此峰值表示CGMCC 1.1190细胞膜磷脂的相变温度(Tc),即磷脂的熔点(Tm);未经酸胁迫处理的对照菌株CGMCC 1.1190菌株的Tm为18.99 ℃,随着CGMCC 1.1190抗酸性菌株的酸胁迫pH值从3.0降低至2.5,其磷脂的Tm从26.69 ℃增加到31.72 ℃,酸胁迫pH值越低,其磷脂的Tm越高。一定范围内,细胞膜磷脂的Tm越高,其流动性越弱。与对照菌株相比,CGMCC 1.1190抗酸性菌株的细胞膜流动性降低,这种适应酸性环境的应激反应,阻碍环境中过多的H+进入菌体内,保证了细胞内部正常的酸碱平衡,有利于其在酸胁迫环境中生存。

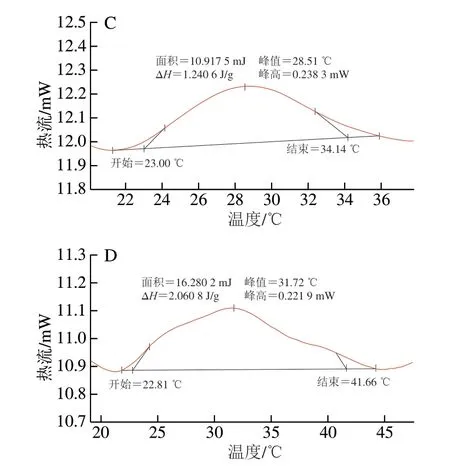
图5 CGMCC 1.1190菌株细胞膜脂类提取物的差示扫描量热图谱Fig.5 Differential scanning calorimetry graphs for membrane lipids extracted from whole cells of CGMCC 1.1190 and acid-resistant strains
微生物为适应外界生长环境条件的变化其细胞膜脂质会发生变化,磷脂的变化会影响细胞膜的结构和功能,对其细胞膜流动性的影响中起非常重要作用[33]。有研究表明,微生物细胞膜流动性的降低有利于诱导其对热、盐或消毒剂等不适生存环境条件的抗性[34-35]。Álvarez-Ordóñez等[36]研究发现,低温胁迫可诱导微生物膜脂质组成的变化,通过改变其细胞膜磷脂中不饱和脂肪酸与饱和脂肪酸的比例来保证细胞膜正常的流动性,维持正常的生理功能。本研究发现,与野生菌株相比,3 株抗酸性CGMCC 1.1190菌株的磷脂相变温度Tc皆升高,细胞膜流动性降低;胁迫pH值越低,Tc也越高,膜流动性越低,有利于菌株在强酸环境下调整细胞膜的流动状态而保持其正常生理功能。微生物膜脂质双分子层除了起到保护性屏障作用外,也是其与外界物质、信息交流的过程中不可缺少的。因此,细胞膜在细菌的胁迫诱导抗性方面起到重要的作用,通过控制其流动性来协调各种生命活动的正常进行,从而增强其生存能力。
2.6 酸胁迫对鼠伤寒沙门氏菌CGMCC 1.1190膜蛋白 表达的影响
膜蛋白是革兰氏阴性菌细胞膜结构的重要组成成分,以β桶状结构镶嵌于细胞膜,对维持细胞内部结构的稳定、各种物质信息的交流以及致病性方面均起到非常重要的作用。本研究所分离的CGMCC 1.1190对照菌株及3 株抗酸性菌株的膜蛋白,经过SDS-PAGE分析得到图6。这4 株CGMCC 1.1190菌株膜蛋白的分子质量主要分布在25~180 kDa,但3 株抗酸性菌株与对照菌株在组成及其分子质量分布上存在着较大差异。与对照菌株相比,随着酸胁迫pH值的降低,对于3 株抗酸性菌株的膜蛋白,分子质量在35~180 kDa的部分条带颜色逐渐变深,说明此分子质量范围的膜蛋白表达量明显提高;与对照菌株相比,抗酸性菌株在135 kDa 和180 kDa处增加了特异条带,说明CGMCC 1.1190在酸胁迫下产生了某些抗酸性蛋白,这些蛋白可能是酸胁迫下与应激反应有关的酸激蛋白。上述研究结果表明,pH 3.0、pH 2.7、pH 2.5酸胁迫可诱导CGMCC 1.1190一些膜蛋白表达量的增加或产生酸应激蛋白。由此推测,这些相关蛋白表达可及时修复不适应酸环境对其造成的分子损伤,导致酸胁迫菌株的DNA复制、转录和蛋白质合成得以正常进行,最终使CGMCC 1.1190抗酸性菌株能够在强酸环境中生存下来。

图6 CGMCC 1.1190原对照菌株及其分别经不同pH值酸胁迫并转接培养的3 株菌株膜蛋白的SDS-PAGE图谱Fig.6 SDS-PAGE patterns of outer membrane proteins in CGMCC 1.1190 and acid-resistant strains
酸性环境可以激活细菌的双组分调控系统,产生一系列有利于细胞活性并参与调控的酸激蛋白,从而保护菌体并修复其损伤,维持细菌在胁迫条件下的存活。Shenoy等[37]对小肠结肠炎耶尔森氏菌在45 ℃下处理1 h后,该菌合成了特殊的膜蛋白,从而增强了对高温的抵抗 能力。本研究发现,3 株抗酸性CGMCC 1.1190菌株一些膜蛋白表达量和组成也发生了变化,可能是酸胁迫下CGMCC 1.1190合成了与抗酸性相关的蛋白质;这些膜蛋白是通过改变哪些代谢路径来提高微生物对强酸环境产生的抗性,相关工作正在进行。
3 结 论
CGMCC 1.1190经pH 3.0、pH 2.7、pH 2.5反复酸胁迫处理12 次并转接培养后产生了抗酸性,与对照菌株相比,抗酸性菌株的个体形态、细胞膜通透性、流动性和膜蛋白表达均发生了变化。在一定的pH值范围内,随着酸胁迫pH值的降低,抗酸性菌株的个体形态变长,细胞膜的H+通透性降低,Tm升高,流动性降低,分子质量在35~180 kDa的部分膜蛋白表达量提高、表达种类增加,菌株抗酸性增强。综上所述,CGMCC 1.1190在遭遇酸胁迫环境时会产生抗酸性,并通过改变自身个体形态、调整细胞膜通透性、流动性及膜蛋白表达量来适应酸胁迫环境,增强生存能力。
