玉米纤维胶-乳清分离蛋白Maillard共聚物对姜黄素乳液稳定性和消化特性的影响
2021-08-31朱巧梅于晓雯陈海涛殷丽君
朱巧梅,于晓雯,陈海涛,殷丽君,*
(1.天津科技大学食品科学与工程学院,天津 300457;2.北京工商大学 北京市食品风味化学重点实验室,北京 100048;3.中国农业大学食品科学与营养工程学院,北京 100083)
姜黄素又称二阿魏酰基甲烷,是从姜科姜黄属植物姜黄、郁金、莪术等的根茎中提取的一种天然多酚化合物。动物实验以及多种临床研究表明姜黄素具有多种生理活性,如抗炎、抗病毒、抗菌、抗氧化以及抗癌活性[1]。 姜黄素的药理安全性以及生物活性使其在治疗多种疾病方面具有巨大的应用潜力。然而,姜黄素的水溶性差(11 ng/mL)、生物利用率低、化学稳定性差,在紫外线及加热条件下易分解[2],这些局限性极大阻碍其在食品中的加工应用。为了克服这些应用障碍,研究者采取了多种研究方法,如构建纳米颗粒、脂质体、胶束以及微纳米乳液等[3]。其中,乳液递送体系是目前最常用的一种方法。
乳液是指一种液体以液滴的形式分散于与其互不相溶的另外一种液体中,主要包括水包油(O/W)与油包水(W/O)两种类型。乳液是一种热力学不稳定体系,在加工贮存过程中易产生相分离、絮凝、聚结等失稳现象[4-5]。目前,在实际的乳液基食品加工中通常采用的是合成类乳化剂,如蔗糖脂肪酸酯、Tween、甘油单硬脂酸酯等。然而,2015年发表在Nature上的一篇文章报道,合成类乳化剂Tween-80会潜在增加结肠炎、代谢综合征以及其他慢性疾病的风险[6]。基于目前合成类乳化剂仍存在着乳化稳定性、安全性欠佳等问题,寻求天然高分子乳化剂代替合成类乳化剂将是食品产业的一个重要趋势。蛋白质是常用的一种天然乳化剂,然而蛋白类乳化剂制备的乳液对温度、pH值、盐离子等敏感,环境因子的改变会导致乳液的失稳。近年来,通过共价交联(酶促交联、Maillard反应等)、静电复合等方式将乳化稳定性较强的蛋白质与多糖结合构建新型乳化剂成为国内外研究者关注的热点[7-9]。
玉米纤维胶(corn fiber gum,CFG)是从玉米加工副产物麸皮中提取出的阿拉伯木聚糖(半纤维素B)。在CFG提取过程中,不可避免地会含有少量蛋白质、脂质等成分。蛋白质可增强多糖在油-水界面的吸附,有利于降低界面张力,强化界面膜黏弹性。多糖分子链 伸向水相中产生静电排斥和位阻作用,从而有效阻止油滴的聚集和絮凝,从而使得多糖具有良好的乳化性及稳定性[10]。大量研究报道了CFG的乳化活性,Yadav等的研究表明CFG的乳化活性接近阿拉伯胶,有望成为阿拉伯胶的替代物[11-13];Bai Long等重点比较了阿拉伯胶、甜菜果胶以及CFG 3 种植物源多糖制备乳液的稳定性。结果表明,阿拉伯胶、甜菜果胶乳化稳定性,特别是界面稳定性要优于CFG。相比之下,CFG稳定的乳液更易发生絮凝、聚结等失稳现象[14]。为了改善CFG的乳化稳定性,Liu Yan等采用辣根过氧化物酶构建CFG-牛血清白蛋白(bovine serum albumin,BSA)的共价复合物,结果表明,CFG-BSA共价复合物能够强化界面膜强度,有效改善了乳液的理化及冻融稳定性[15]。
乳清分离蛋白(whey protein isolate,WPI)具有优异的乳化性和凝胶性[16]。此外,WPI的营养价值丰富、消化吸收率高,是食品工业中一种重要的功能性食品配料。本实验拟采用Maillard共价交联方式对CFG、WPI进行改性,将改性后的共聚物作为新型乳化剂构建包埋姜黄素的乳液体系,以期提高姜黄素的溶解度、生物利用率。此外,有助于改善单一CFG、乳清分离蛋白的理化稳定性,从而进一步拓宽CFG在食品行业中的应用,实现玉米麸皮副产物的高值化加工利用。
1 材料与方法
1.1 材料与试剂
玉米麸皮 中粮生化能源有限公司;WPI (纯度≥95%) 美国戴维斯柯食品国际公司;姜黄素(纯度≥95%) 河北泽华生物科技有限公司;中链甘油三酯(纯度≥99%) 瑞士龙沙集团;高温淀粉酶 北京阿拉丁试剂公司;BCA蛋白定量试剂盒 上海炎熙生物科技有限公司。
1.2 仪器与设备
高速剪切机 德国IKA公司;NS11001L高压均质机 意大利Niro Saoavi公司;Microtrac S3500激光粒度分析仪 美国麦奇克仪器有限公司;LUMiSizer稳定性分析仪 德国LUM仪器公司;傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国珀金埃尔默公司;AR2000流变仪 美国TA公司;GL高速冷冻离心机 上海安亭科学仪器厂;LGJ冷冻干燥机 北京四环科学仪器厂。
1.3 方法
1.3.1 CFG的制备
参考Deng Changning等的方法[17],将玉米麸皮研磨成粉,过40 目筛,用7 倍质量的正己烷浸泡玉米麸皮粉末,磁力搅拦2 h后除去上清液。将沉淀物置于50 ℃烘箱中热风干燥8 h。用10 倍体积的蒸馏水浸泡脱脂玉米麸皮粉末,在100 ℃下煮沸30 min使存在于麸皮粉末中的淀粉完全糊化。待温度降至80 ℃后,加入高温淀粉酶反应30 min,用碘液验证麸皮中的淀粉是否完全去除。然后过滤除去上清液,用蒸馏水反复冲洗3~4 次,然后将沉淀物置于50 ℃烘箱中干燥,得到除油除淀粉的玉米麸皮粉。按照称取除油除淀粉的玉米麸皮粉与0.625 mol/L氢氧化钠溶液按1∶10(m/V)搅拦均匀后避光放置25℃恒温振荡器上100 r/min振荡4 h,再4000 r/min离心20 min取上清液。用浓盐酸调上清液pH值至4.2后,5000 r/min离心30 min取上清液。于上清液中边搅拦边缓慢加入2 倍体积的无水乙醇,静置待CFG析出及沉淀。30 min后除去上清液,收集白色絮状沉淀物进行冻干,冻干24 h后得到CFG,研磨待用。
1.3.2 CFG-WPI Maillard共聚物的制备
应用干热法制备CFG-WPI Maillard共聚物。将2 g WPI、6 g CFG溶于100 mL去离子水中,磁力搅拦4 h使样品充分溶解,调节溶液pH值至7.0。之后将样品放置于-80 ℃冰箱24 h后进行冻干,收集冻干粉末,放置于预热到60 ℃的干燥器中并利用饱和溴化钾溶液控制体系内相对湿度为79%。每隔一段时间(0~120 h)取样并将样品命名为M-0、M-12、M-24、M-36、M-48、M-72、M-96、M-120(数字表示放置的时间/h),将样品放于 -20 ℃冰箱中保存,待后续对共聚物进行结构分析。
1.3.3 姜黄素乳液的制备
以含有质量分数0.5%姜黄素的甘油三酯作为油相,以质量分数2%的乳化剂(CFG、WPI、CFG-WPI混合物(质量比3∶1)以及CFG-WPI Maillard共聚物)的水溶液为水相;将油相与水相以1∶9的质量比混合,首先经过高速剪切机的初步均质,以11 000 r/min的剪切速率剪切2 min;然后采用60 MPa高压均质机将粗乳液进行均质。最终获得姜黄素质量分数为0.05%、油相质量分数为10%、乳化剂质量分数为1.8%的姜黄素乳液。
1.3.4 CFG、WPI、CFG-WPI Maillard共聚物的结构分析
1.3.4.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
称取适量样品溶于去离子水中,利用BCA蛋白定量试剂盒测定样品中蛋白质量浓度后,加入去离子水对样品进行稀释使得各个样品最终蛋白质质量浓度均为1 mg/mL, 按照体积比3∶1的比例将样品溶液与上样缓冲液(体积分数25%甘油、60 mmol/L Tris-HCl(pH 6.8)、2 g/100 mL十二烷基硫酸钠(sodium dodecyl sulphate,SDS)、14.4 mmol/L 2-巯基乙醇、体积分数0.1%溴酚蓝和50 mmol/L乙二胺四乙酸)混合后进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)。电泳所采用的分离胶质量分数为10%,浓缩胶质量分数为3.5%,上样量为20 μL。用考马斯亮蓝R-250染色15 min,之后脱色3~4 次,拍照获得蛋白条带。
1.3.4.2 FTIR分析
将光谱级溴化钾放于105 ℃烘箱中烘干4 h,使其脱去结晶水。称取20 mg样品及200 mg溴化钾粉末放于玛瑙研钵中,在日光灯照射下研磨使其完全混合均匀后压制成片,放于FTIR仪中进行检测分析。具体参数设置为:分辨率4 cm-1,扫描32 次,测定波数400~4 000 cm-1。
1.3.5 姜黄素乳液性质的测定
1.3.5.1 粒径测定
采用Microtrac S3500激光粒度分析仪测定单一WPI、CFG及不同反应时间下形成的CFG-WPI共聚物(M-0、M-12、M-24、M-36、M-48、M-72、M-96、M-120)制备的姜黄素乳液粒径,取少量乳液样品加入样品池中,通过搅拦使乳液均匀分散,通过仪器直接读取乳液的平均粒径(D4,3),并以此作为乳液粒径。设定样品折射率为1.42,分散介质折射率为1.33。
离子强度的影响:配制不同浓度(120~240 mmol/L) 的CaCl2溶液,以1∶1的体积比将乳液与不同浓度的CaCl2溶液混合,静置24 h后测定乳液的粒径。
pH值的影响:分别采用0.1 mol/L NaOH以及HCl溶液将乳液的pH值调至3~7,放置于-4 ℃冰箱中贮存24 h后,采用Microtrac S3500激光粒度分析仪测定乳液的粒径。
1.3.5.2 稳定性分析
采用LUMiSizer稳定性分析仪分析不同条件下制备的姜黄素乳液的稳定性。取400 μL姜黄素乳液移入直径2 mm的样品皿底部,设定温度为25 ℃,离心速率为4 000 r/min,每30 s扫描一次,共扫描255 次,光因子设为1.00,通过仪器自带软件分析得到的LUMiSizer稳定性图获得样品的透光量百分比,即澄清指数,进而分析乳液的长期稳定性。
1.3.5.3 黏度测定
参考Zhu Qiaomei等[18]的方法,使用流变仪对乳液的黏度进行测定。采用稳态剪切模式,设定剪切速率为1~100 s-1,选用直径为40 mm的铝制平板夹具并设置其间距为1 mm,通过Peltier系统控制平板上的温度恒 定为25 ℃。
1.3.5.4 姜黄素含量的测定
乳液中姜黄素含量测定参照Χu Guangrui等[19]的方法,并做适当修改。取2 mL新制姜黄素乳液加入2 mL体积比为1∶1的氯仿-乙醇混合溶液,振荡混合均匀后静置,移取含有姜黄素的有机相层于10 mL试管中,重复萃取一次后合并萃取液,在425 nm波长处测定萃取液吸光度,根据姜黄素-正己烷标准曲线,确定乳液中未包埋的姜黄素质量浓度,并按公式(1)计算包埋率。

1.3.5.5 体外模拟胃肠消化实验
体外模拟胃部消化:参考Fan Yuting等[20]的方法,取7.5 mL姜黄素乳液与10 mL模拟胃液(simulated gastric fluid,SGF)(含3.2 mg/mL胃蛋白酶、0.15 mol/L氯化钠)混合均匀后,将体系pH值调至2.0,置于37 ℃恒温振荡水浴槽中130 r/min下振荡模拟体外胃部消化1 h。
体外模拟小肠消化:体外模拟胃部消化后,将体系pH值调至7.5,加入15 mL模拟肠液(simulated intestinal fluid,SIF)(包括2.0 mg/mL 8 U/mg胰脂肪酶、 20 mg/mL胆盐、10 mmol/L CaCl2)。在37 ℃恒温振荡水浴槽中130 r/min振荡模拟体外小肠消化2 h。在消化过程中,使用pH-stat自动滴定装置对反应体系的pH值进行监测,通过滴定0.25 mol/L氢氧化钠溶液维持体系pH值恒定(7.5)。记录所用氢氧化钠溶液体积,在时间t内游离脂肪酸(free fatty acid,FFA)的释放率通过公式(2)进行计算。
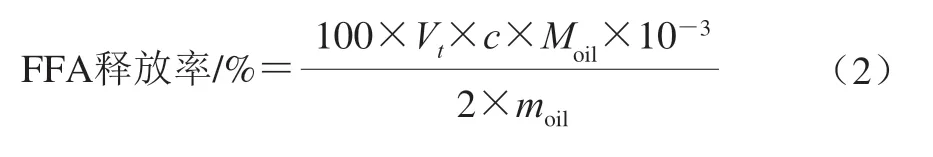
式中:Vt为t时间内消耗的NaOH体积/mL;c为NaOH溶液的浓度(0.25 mol/L);Moil为甘油三酯的摩尔质量/(g/mol);moil为7.5 mL姜黄素乳液中的甘油三酯质量/g。
1.3.5.6 姜黄素生物有效性测定
取体外模拟小肠消化液,11 000 r/min离心50 min后,溶液分为3 层,上层为未被酶解的油相,中间为胶束溶液,底层为沉淀物层。取中间胶束层溶液,使用0.22 μm有机微孔滤膜过滤除去微晶聚合物,应用高效液相色谱法测定胶束中姜黄素的含量。色谱条件为:SHISEIDO C18反相色谱柱(4.6 mm×250 mm),流动相分别为体积分数2%乙酸(A)、色谱级乙腈(B)。上样量为20 μL,梯度洗脱程序:0~15 min,B相由35%线性上升至70%;15~20 min,B相由70%线性下降至35%;20~25 min,B相为35%。流速设置为1 mL/min。紫外检测波长设置为425 nm。用公式(3)计算姜黄素的生物有效性。

式中:c胶束和c初始分别表示姜黄素在胶束以及初始乳液中的浓度/(mol/L)。
1.4 数据处理与分析
所有实验重复3 次,结果以平均值±标准差表示。采用SPSS Statistics 20.0软件进行实验数据分析,并采用Duncan多重比较检验法进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 CFG-WPI Maillard共聚物热反应时间对姜黄素乳液粒径及稳定性的影响
由图1A可知,CFG制备的姜黄素乳液粒径为0.95 μm,而WPI制备的姜黄素乳液粒径为0.88 μm,经过Maillard反应后,由各阶段Maillard产物制备姜黄素乳液的粒径在0.663~0.711 μm范围内。结果表明,与单一WPI、CFG相比,CFG-WPI Maillard共聚物具有更好的乳化效果。随着热处理时间的延长,各阶段所得到的
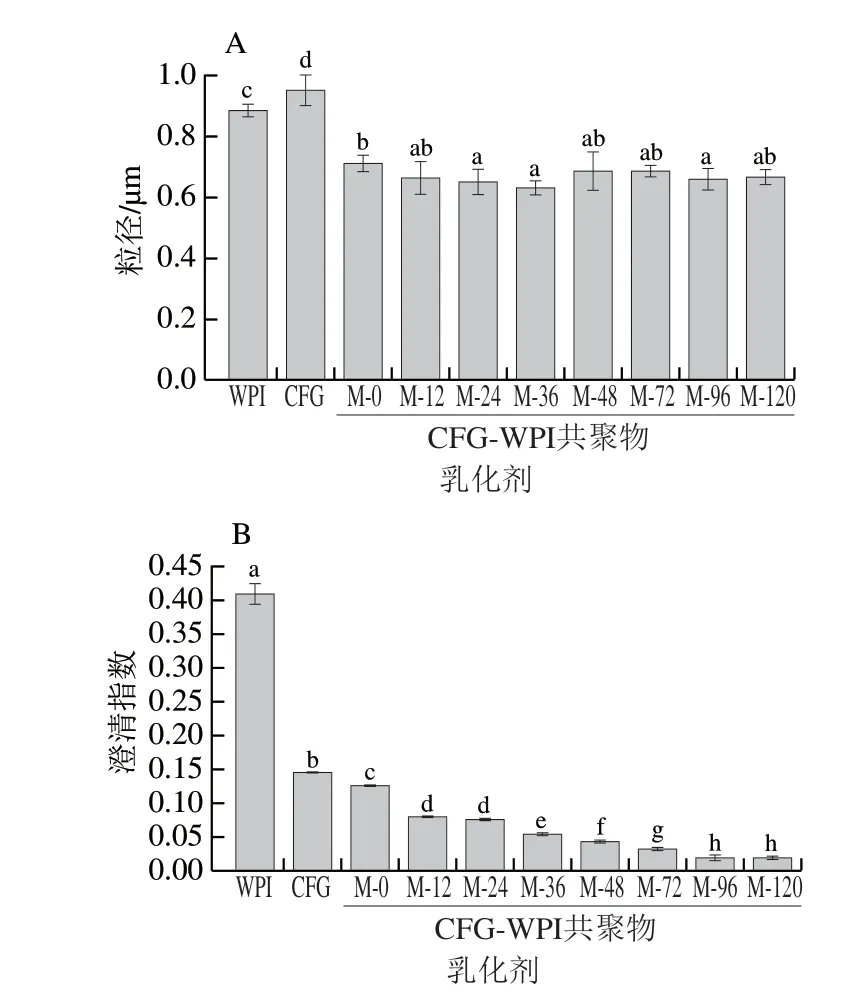
图1 单一WPI、CFG以及不同热处理时间下CFG-WPI Maillard 共聚物对姜黄素乳液粒径(A)以及澄清指数(B)的影响Fig.1 Effects of pure WPI, CFG and CFG-WPI conjugates obtained at different thermal treatment times on the particle size (A) and clarification index (B) of emulsions
共聚物对姜黄素乳液粒径并没有显著影响。为了进一步评估不同阶段的CFG-WPI Maillard共聚物对乳液长期稳定性的影响,采用LUMiSizer稳定性分析仪对乳液进行分析,结果如图1B所示。澄清指数与乳液的稳定性呈负相关,澄清指数越高表明体系越不稳定,单一WPI、CFG所制备姜黄素乳液的澄清指数分别为0.41、0.14,而CFG-WPI Maillard共聚物所制备姜黄素乳液的澄清指数与单一WPI、CFG所制备姜黄素乳液的澄清指数显著下降,且随着热反应时间的延长,澄清指数进一步逐渐下降,说明乳液的稳定性有所提高。原因可能在于,随着热反应的不断进行,CFG与WPI的接枝度也在增加,因此改善了乳液的稳定性[21]。而由于M-96与M-120制备的姜黄素乳液澄清指数无显著差异,考虑到制备时间成本等因素,后续选用M-96作为代表性CFG-WPI Maillard共聚物进行实验。
2.2 CFG-WPI Maillard共聚物结构解析结果
2.2.1 SDS-PAGE分析结果
采用SDS-PAGE实验验证了CFG-WPI共聚物的形成,结果如图2所示。一般来说,分子质量较高的物质在SDS-PAGE条带中迁移速率比较慢,因而在电泳条带的顶端会产生较强的蛋白信号。A谱带的分子质量约为67 kDa,为BSA谱带。在Maillard反应的起始阶段,未在电泳条带顶端观察到明显的高分子质量谱带,而当Maillard反应时间为12 h时,在浓缩胶与分离胶的边界处,出现了高分子量蛋白谱带,证明了Maillard反应产物的产生。当Maillard反应时间达到96 h时,电泳顶端颜色 逐渐变深,而BSA谱带的颜色逐渐变浅,并未完全消失,说明Maillard反应仍在不断持续进行,所生成的高分子质量物质的量在增加。由图2B可知,随着反应的进行, CFG-WPI Maillard共聚物的褐变程度也在不断增加,可能是Maillard反应是个不断连续的反应过程,一部分共聚物继续反应并进入反应末期,从而生成褐色物质。

图2 WPI、CFG以及不同热反应时间下CFG-WPI Maillard共聚物的SDS-PAGE图(A)和表观图片(B)Fig.2 Sodium dodecyl sulphate-polyacrylamide gel electrophoresis analysis (A) and visual appearance (B) of WPI, CFG and CFG-WPI Maillard conjugates
2.2.2 FTIR分析结果
如图3所示,与CFG、WPI相比,经过96 h的Maillard反应后,CFG-WPI Maillard聚合物在1 406、1 543 cm-1处出现了新的吸收峰,可能是多糖的羰基与蛋白的氨基进行共价交联,交联后会引起糖环内O—H键的变形振动并导致C—N键的伸缩振动[15]。此外,CFG-WPI Maillard聚合物在1 032 cm-1处出现明显较CFG更强的吸收峰,而WPI在此处无吸收峰,其原因可能是多糖链上含有多个羟基,当多糖与蛋白发生共价交联后,增加了蛋白中羟基及碳氧双键的数量,导致了此峰强度的增加。在562 cm-1处为N—H的弯曲振动峰,与单独的WPI相比, CFG-WPI Maillard聚合物在562 cm-1处的吸收峰较弱,可能的原因是Maillard反应消耗一定量的氨基从而导致其数量减少。通过对比单独CFG、WPI与CFG-WPI Maillard共聚物的FTIR光谱,可以进一步证明CFG、WPI之间形成了分子间聚合物。

图3 WPI、CFG以及CFG-WPI Maillard共聚物的FTIR图Fig.3 Fourier transform infrared spectrum of WPI, CFG and CFG-WPI Maillard conjugates
2.3 不同乳化剂对姜黄素乳液粒径和黏度的影响
图4A为CFG、WPI、CFG-WPI混合物以及Maillard反应96 h制备的CFG-WPI共聚物(M-96)所稳定乳液的粒径图。4 种姜黄素乳液的粒径集中于0.6~1.0 μm之间。与单一WPI、CFG制备的姜黄素乳液粒径相比,CFG与WPI混合物以及Maillard共聚物制备的姜黄素乳液粒径较低,尤其是Maillard共聚物制备的粒径最低(684 nm),表明CFG-WPI Maillard共聚物制备的姜黄素乳液稳定性较高。CFG-WPI Maillard共聚物制备的姜黄素乳液乳化稳定性增强的原因可能在于糖基化可增强蛋白质的空间位阻和静电斥力,从而更有效地抑制了油滴的絮凝的聚结。如图4B所示,4 种姜黄素乳液的黏度随着剪切速率的增大而明显下降,表现出剪切稀化的流体特征。 与WPI制备的姜黄素乳液相比,CFG制备的姜黄素乳液的 黏度较高,主要与CFG较大的分子质量有关。 CFG-WPI Maillard共聚物制备的姜黄素乳液黏度最大,这在一定程度上能够阻止姜黄素乳液滴之间的聚结过程[22]。总体而言,较小的乳滴尺寸和较高的黏度均有助于减缓液滴的沉降,更有效改善姜黄素乳液的稳定性。
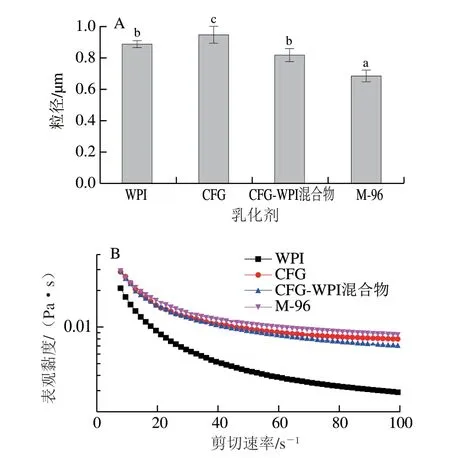
图4 WPI、CFG、WPI-CFG混合物以及CFG-WPI Maillard共聚物 制备的姜黄素乳液粒径(A)及表观黏度(B)Fig.4 Average particle size (A) and apparent viscosity (B) of emulsions prepared with pure WPI, CFG, CFG-WPI physical mixture and CFG-WPI Maillard conjugates
2.4 pH值、离子强度对姜黄素乳液粒径的影响
外界环境因子如pH值、离子强度是影响姜黄素乳液稳定性的重要因素。如图5A所示,单一WPI稳定的姜黄素乳液在远离等电点(pI 4.0~5.0)的条件下粒径无明显差异,此时姜黄素乳液液滴之间的静电斥力大于相互吸引的范德华力;在等电点附近(pH 4、5),姜黄素乳液的粒径分别增加到5.33、21.32 μm,这是由于稳定蛋白质姜黄素乳液的静电排斥力减弱,姜黄素乳液产生了絮凝、聚结等失稳现象。WPI和CFG混合物稳定的姜黄素乳液也存在类似的变化趋势,因此这在很大程度上限制了WPI在酸性饮料中的应用。在pH值为3~7的范围内,CFG-WPI Maillard共聚物稳定的姜黄素乳液均具有良好的pH值稳定性,姜黄素乳液粒径基本保持不变。Maillard反应可以使蛋白的氨基与多糖的羰基糖基化,蛋白的二级结构发生改变,分子的空间位阻增加[23],使得蛋白构象更加稳定,从而克服蛋白质分子在等电点附近的絮凝聚沉。
由图5B可知,Ca2+浓度对不同乳化剂制备的姜黄素乳液的粒径产生显著的影响,当Ca2+浓度从0升高至120 mmol/L时,WPI以及CFG-WPI混合物所稳定的 姜黄素乳液的粒径分别由0.89、0.82 μm增大至4.40、2.78 μm。这些现象可以归因为Ca2+对液滴之间静电排斥的屏蔽效应导致蛋白质的净电荷下降,从而增加了姜黄素乳液发生絮凝、聚结的倾向[24]。而CFG以及CFGWPI Maillard共聚物稳定的姜黄素乳液在不同CaCl2浓度条件下粒径均保持不变。CFG能够提供空间位阻保护作用[25-27], 使得CFG-WPI Maillard共聚物在姜黄素乳液表面形成更强的空间排斥效应,减少外界离子对姜黄素乳液的影响。
图5 不同pH值(A)、CaCl2浓度(B)对WPI、CFG、WPI-CFG 混合物以及CFG-WPI共聚物稳定姜黄素乳液粒径的影响Fig.5 Effects of pH (A) and CaCl2 concentration (B) on the average particle size of emulsions stabilized by WPI, CFG, WPI-CFG physical mixture and WPI-CFG conjugates
2.5 不同乳化剂对姜黄素乳液中姜黄素包埋率的影响
姜黄素是近年来备受关注的生物活性物质,然而其水溶解性较差,仅为11 ng/mL。由图6A可知,4 种姜黄素乳液中的姜黄素包埋率为92%~98%,折合为水中的溶解度相当于460~490 ng/mL,因此纳米姜黄素乳液是一种良好的姜黄素递送体系。与CFG、WPI以及CFG和WPI的混合物相比,CFG-WPI Maillard共聚物稳定姜黄素乳液的姜黄素包埋率较高。从图6B可以看出, WPI-CFG Maillard共聚物制备出的姜黄素乳液颜色较浅,更加均匀,对姜黄素的包埋能力更强。
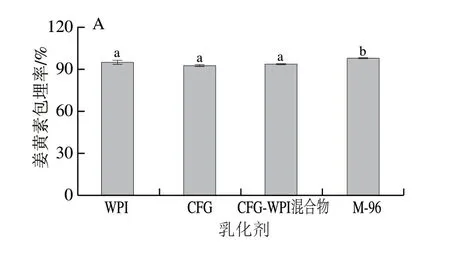
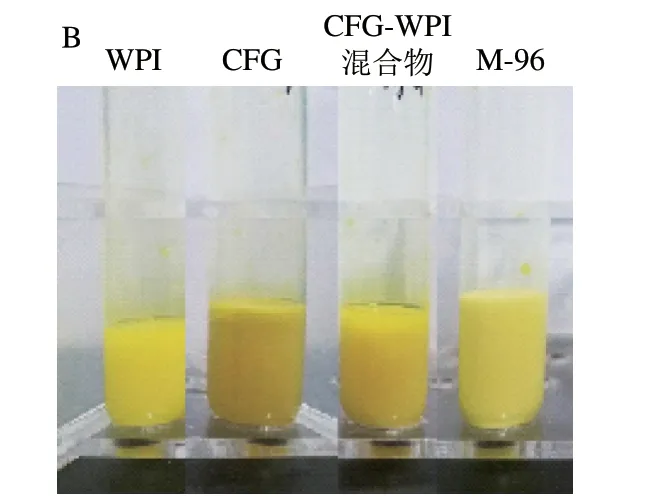
图6 WPI、CFG、WPI-CFG混合物以及CFG-WPI共聚物稳定 姜黄素乳液及其姜黄素包埋率Fig.6 Encapsulation efficiency of curcumin in emulsions stabilized by WPI, CFG, CFG-WPI physical mixture and CFG-WPI conjugates
2.6 不同乳化剂及粒径对姜黄素乳液脂肪水解速率的影响
采用pH-stat法测定了不同姜黄素乳液脂肪水解速率的变化情况。如图7A所示,对于4 种姜黄素乳液,在小肠消化的前60 min内FFA释放量快速增加,随后缓慢增加,结果表明脂肪酶分子快速吸附在姜黄素乳液表面,将甘油三酯转化成游离脂肪酸。在消化的中后期,WPI稳定的姜黄素乳液水解速率较CFG、CFG与WPI共混物以及CFG-WPI Maillard共聚物稳定的3 种姜黄素乳液的脂质水解速率更快,说明CFG的存在能够降低脂质水解速率。Χu Duoxia等报道在水相中共聚物的黏度较高时能在一定程度上抑制脂肪酶迁移到油脂表层[28]。CFG、 CFG-WPI混合物以及CFG-WPI Maillard共聚物所稳定的姜黄素乳液黏度相差不大(图4B),因此这几种乳化剂所形成的姜黄素乳液脂质水解速率没有明显差异。
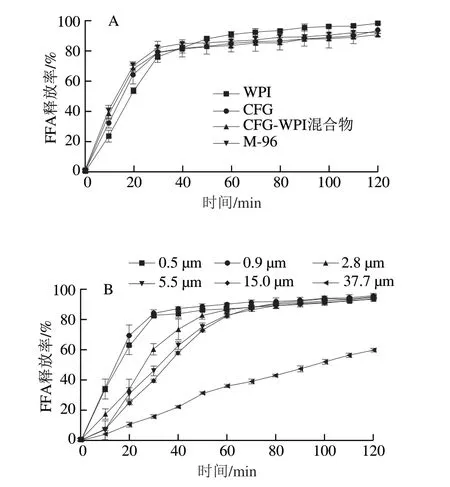
图7 不同姜黄素乳液经过消化后游离脂肪酸的释放情况Fig.7 Effects of emulsifiers and particle size of emulsion droplets stabilized by CFG-WPI conjugates on the release of free fatty acids from digested emulsions
为了进一步探究姜黄素乳液粒径对脂质水解的影响,通过调控均质压力制备了不同粒径下的CFG-WPI共聚物稳定的姜黄素乳液液滴(0.5~37.3μm)。粒径对姜黄素乳液脂质水解速率的影响如图7B所示。粒径对姜黄素乳液的脂肪水解速率有着较大的影响,随着姜黄素乳液粒径的降低,脂肪水解速率不断升高。其原因可能是随着粒径的降低,液滴的比表面积增大,即油-水界面上脂肪酶进行吸附的位点增多,有利于胰脂肪酶的吸附,从而促进水解反应的进行[29]。当粒径减少至0.9 μm时,其水解速率与0.5 μm时并无区别,说明脂肪酸水解反应达到饱和状态。
2.7 不同乳化剂及姜黄素乳液粒径对姜黄素生物有效性的影响
经过胃肠消化后,通过测定消化前后初始姜黄素乳液和胶束中姜黄素的含量,得到不同姜黄素乳液中姜黄素的生物有效性,不同乳化剂类型及姜黄素乳液粒径对姜黄素生物有效性的影响结果如图8所示。其中,单一WPI稳定的姜黄素乳液中姜黄素的生物有效性为57%,而CFG稳定的姜黄素乳液中姜黄素的生物有效性最高,达到64%,CFG-WPI Maillard共聚复合物、 CFG-WPI混合物稳定的姜黄素乳液生物有效性分别为58%、61%。说明CFG的加入提高了WPI稳定的姜黄素乳液中姜黄素的生物有效性,主要原因在于CFG可以起到屏障保护作用,阻碍胃蛋白酶对姜黄素乳液的消化[30],使得更多的姜黄素转移到肠道中。液滴粒径会影响姜黄素的生物有效性,当姜黄素乳液的粒径为37.7 μm时,姜黄素的生物有效性仅为12.9%,当粒径进一步降低至15.0~0.5 μm区间时,姜黄素乳液中姜黄素的生物有效性为58.0%~63.0%。一方面,较大粒径的姜黄素乳液不稳定,导致姜黄素的释放量较高;另一方面,甘油三酯经水解后产生FFA,FFA可与胆盐协同包埋姜黄素产生胶束、囊泡、脂质体等结构,促进姜黄素的吸收。同时,当粒径较大时,释放出的FFA较少,不利于形成包埋姜黄素的胶束结构,因此导致较低的生物有效性。姜黄素乳液粒径较小时,有助于抑制油滴的聚集,从而增加了包埋物姜黄素的生物有效性。
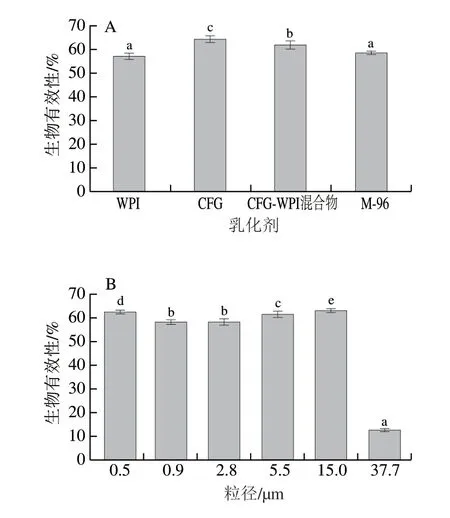
图8 不同姜黄素乳液中姜黄素的生物有效性Fig.8 Bioavailability of curcumin-loaded O/W emulsions
3 结 论
本研究通过Maillard反应制备了CFG-WPI Maillard共聚复合物,通过SDS-PAGE和FTIR验证了共价复合物的形成。与单一CFG、WPI稳定的姜黄素乳液相比, CFG-WPI Maillard共聚物降低了姜黄素乳液的粒径,提高了体系的黏度,而且改善了姜黄素乳液对外界环境因子pH值、Ca2+浓度的敏感性。姜黄素乳液稳定性改善的主要原因在于CFG-WPI Maillard共聚物具有更大的空间位阻和静电斥力,从而有效地抑制了油滴的絮凝聚结。此外,CFG-WPI Maillard共聚物显著提高了姜黄素的包埋率。消化实验结果表明,CFG在一定程度上能够抑制脂质的水解,且姜黄素乳液粒径是影响脂质水解速率的重要因素。与单一WPI稳定的姜黄素乳液相比,CFG的添加在一定程度上能提高姜黄素的生物有效性。对于CFG-WPI Maillard共聚物稳定的姜黄素乳液而言,较小的乳液粒径有助于改善姜黄素的生物有效性。
