基于罗非鱼肌肉微结构分形维数表征的冻融 过程品质变化分析
2021-08-31付仁豪汪春玲林向东冯爱国
付仁豪,汪春玲,陈 政,林向东,冯爱国*
(海南大学食品科学与工程学院,海南 海口 570228)
2018年我国罗非鱼产量约为162.45万 t,占世界总产量的41%左右[1]。罗非鱼蛋白含量高且营养丰富,但是,像其他水产品一样,新鲜罗非鱼由于微生物活性高而极易腐烂[2]。因此,保鲜技术在罗非鱼的贸易中起着至关重要的作用。
冷冻贮藏是保持鱼类新鲜度最常用的方法,可减缓变质速率并延长保质期。但冻结过程不可避免地会对鱼肉品质产生负面影响,冷链运输或贮存过程中反复冻融时有发生[3],反复冻融引起的温度波动导致食品质量发生不良变化,包括水分流失和质构特性改变等[4]。因此,了解罗非鱼片冻融过程中的品质变化是至关重要的。冻融条件下关于水产品生化指标变化的研究很多,但有关对肌肉组织微结构影响方面的报道较为少见。鱼类在冻藏过程中,冰结晶和组织脱水会使肌肉组织产生蜂窝状微结构,这是影响冷冻食品最终品质的关键因素。与其他多孔结构类似,这种微结构本质上是不规则的,很难用普通的方法来表征[5]。曼德尔布罗特提出的分形维数是几何学中的一个参数,其表示的是空间结构在一定尺度上的空间填充能力。近年来,汪星星[6]分析了冻融条件下添加不同食品胶对面筋蛋白分形维数和微结构的影响。陈建文[7]根据牛肉的大理石纹图像建立了分形维数模型以确定其品质等级。由此可见,食品的品质与微结构和分形维数的变化存在一定的关联。
本实验基于肌肉微结构分形维数和品质指标来评价反复冻融下罗非鱼片的品质变化。采用分形维数来表征鱼片组织被冰晶破坏后的多孔结构,并分析其与总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、色差、总峰面积、电导率、质构等品质指标的相关性,旨在为罗非鱼保鲜贮藏的品质评价提供理论依据及参考。
1 材料与方法
1.1 材料与试剂
新鲜发色罗非鱼片购自海南海口某罗非鱼加工厂。
甲基红(分析纯)、溴钾酚绿 国药集团化学试剂有限公司;硼酸、盐酸(均为分析纯) 广州化学试剂厂;Tissue-Tek®4583 OCT包埋剂 美国Sakura Finetek公司;苏木精染液、伊红染液(均为分析纯) 南昌雨露实验器材有限公司;4%组织细胞固定液(分析纯) 合肥新恩源生物技术有限公司。
1.2 仪器与设备
NMI20-040H-I低场强核磁共振分析仪 苏州纽迈分析仪器股份有限公司;HM 550型冷冻切片机 德国MICROM公司;CR-10型色差仪 日本柯尼卡美能达公司; CT3型质构分析仪 美国博勒飞公司;TDR100时域反射计 美国Campbell Scientific公司;K9840半自动凯氏定氮仪 济南海能仪器有限公司;BCD-356WJ型电冰箱 青岛海尔股份有限公司;179-UI无纸温度记录仪 艾普瑞(上海)精密光电有限公司;Eclipse ci光学显 微镜 日本尼康公司。
1.3 方法
1.3.1 样品的制备
选取规格约为(130±10)g的新鲜发色罗非鱼片,冷链条件下迅速运回实验室,擦干鱼片表面水分后密封包装置于温度分别为(-4.0±0.4)、(-18.0±1.5)、(-30.0±2.0)℃冰箱中,并用179-UI无纸温度记录仪监控温度。冻藏5 d后取出,于室温下解冻,鱼片中心温度达到0 ℃后放置10 min,即完成第1次冷冻-解冻过程。随机选择样品进行各指标测定,剩余的样品放入冰箱,按照上述操作依次完成第2~4次冻融,探究冷冻-解 冻循环条件下对鱼片品质的影响,每个测试指标重复3 次取平均值。
1.3.2 质构分析
使用CT3型质构分析仪的TPA模式,压缩目标距离为2 mm,触发负载为7 g,探头移动速率为4 mm/s,探头型号为直径6 mm的圆柱形TA41探头。选取鱼片背部的鱼肉进行质构测定,每片测定3 次,选择3 组样品进行测定,结果取平均值。
1.3.3 电导率的测定
使用TDR100时域反射计和专用软件测定电导率,擦干样品表面水分后,将探针从背部完全插入鱼片中,点击“BULK EC”按键,记录测定结果后再更换两次探针插入点,操作同上,3 次测定结果取平均值。
1.3.4 总色差的测定
参考Su Dianbin等[8]的方法并稍作修改,将色差仪探头置于样品尾部色泽最鲜艳处,测定L*、a*和b*值。颜色变化总色差(ΔE)按下式计算。
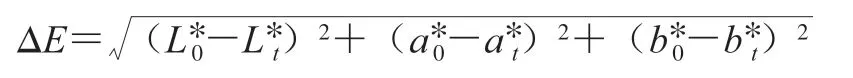
式中:下标0表示鱼片冷冻前;下标t表示鱼片冻融第t次。
1.3.5 总挥发性盐基氮含量的测定
按郭学骞等[9]的方法测定TVB-N含量。
1.3.6 水分迁移及含量的测定
参考汪春玲等[10]的方法并稍作修改。使用NMI20-040H-I 低场强核磁共振分析仪分析水分迁移情况及含量,切取背部鱼肉(3 cm×3 cm×2 cm),用无干扰的保鲜膜包装鱼肉块,进行横向弛豫时间的测定,选取数据量200、弛豫时间点数400、反演方式SIRT、迭代次数100 000对数据进行批量反演,实验测得样品各峰面积之和(总峰面积)为3 种状态水分含量总和,除以样品质量后,可代表样品中总水分富集程度。
1.3.7 冷冻切片及分维计算
参考Chen Zheng等[11]的方法并稍作改动。鱼片切成2 cm×2 cm×2 cm的肉块并冷冻,使用时取出。将样品置于工作温度为-20 ℃的冷冻切片机内,使用 Tissue-Tek®4583 OCT包埋剂包埋,切片厚度为10 μm,切片完成后置于载玻片上进行苏木精-伊红染色。染色完成后使用Eclipse ci光学显微镜以40 倍放大倍数观察样品的组织结构,并拍摄组织微结构图像。
通过ImageJ软件采用盒维计数法计算得到分形维数,先将组织显微图像二值化,用长度分别为图像边长1/2、1/4、1/8、1/16、1/32、1/64的子方格覆盖二值化图像,统计覆盖图像中肌肉组织的格子数,记为N(1/ε),ε表示测量尺度。令y=lnN(1/ε)、x=ln 1/ε,对x和y进行回归分析,直线斜率即为组织微结构的分形维数[12]。
1.4 数据处理与分析
采用Excel 2019软件对实验数据进行统计,采用Origin 2017软件作图,采用SPSS 24软件对实验数据进行皮尔逊相关性分析。
2 结果与分析
2.1 冻融条件下罗非鱼片质构特性的变化
罗非鱼片的质构特性是评价鱼肉品质的重要指标,直接影响到鱼肉的感官和功能。罗非鱼片在3 种低温冻融条件下的硬度如图1A所示。新鲜罗非鱼片的硬度为(123.4±9.4)g,随着冻融次数的增加,硬度逐渐降低。至冻融4 次时,3 组样品硬度存在明显差异, -4 ℃保存的样品在4 次冻融循环后硬度最低,下降了64.34%,而保存在-18 ℃和-30 ℃的样品冻融4 次后硬度分别下降60.29%、49.27%。鱼片的硬度可能与其肌肉纤维有关,更紧密堆积的肌肉纤维会赋予鱼片更大的硬度,鱼片在反复冻融过程中,鱼肉组织内的冰晶由于不断地融解、冻结,使得维持肌肉结构的氢键持续断裂,肌纤维逐渐软化,硬度逐渐降低[13]。

图1 冻融条件下罗非鱼片质构特性的变化Fig.1 Changes in textural characteristics of tilapia fillets under freeze-thaw conditions
鱼片的弹性如图1B所示。新鲜罗非鱼片的弹性为(1.73±0.05)mm,随着冻融次数的增加,弹性呈现出下降趋势。-4、-18 ℃和-30 ℃冻融条件下鱼片的弹性在整个过程中分别下降了24.50%、18.38%和13.87%,由此可以发现,在较低温度下,鱼片弹性较高,可能是较低的温度在一定程度上保持了鱼肉组织的结构特性。弹性反映的是鱼片发生形变后的恢复能力,弹性与肌肉组织中肌球蛋白、肌动蛋白和弹性蛋白等含量密切相关,由于反复冻融,肌肉中蛋白质遭到破坏后逐渐降解,故鱼片的弹性逐渐下降[14]。
2.2 冻融条件下罗非鱼片电导率的变化
由图2可知,新鲜罗非鱼片的电导率为 2.134 mS/cm,电导率在整个冻融期间呈上升趋势,且冻藏温度越高的样品电导率增长速率越快。Liu Χiaochang等[15]报道了虹鳟贮存过程中存在类似的电导率变化现象。电导率随冻融次数增加而提高是由于冻存过程中肌肉纤维的膜渗透性增强和含水量降低,而3 组样品电导率增加速率不同是由于较低的温度对组织分解和细菌生长具有更明显的抑制作用[16]。电导率作为分析肌肉组织电解质浓度的指标,受到细胞的体液平衡和膜结构完整程度的影响。此外,肌肉组织的劣变和体液的流失又会反过来改变肌肉组织的结构。因此,导电性与肌肉组织的结构之间存在着密切的关系。

图2 冻融条件下罗非鱼片电导率的变化Fig.2 Changes in electrical conductivity of tilapia fillets under freeze-thaw conditions
2.3 冻融条件下罗非鱼片总色差的变化
图3为鱼片总色差在冻融期间的变化。鱼片的色泽是评价品质优劣的重要指标之一,根据鱼肉的色泽可判断其新鲜程度,其是影响消费者是否购买的主要因素。由图3可知,3 个温度下鱼片的色差随着冻融次数的增加而增加。第一次冻融结束时,-4、-18 ℃和-30 ℃组 样品的ΔE就出现明显差异,冻融4 次时,-4、-18 ℃和-30 ℃下鱼片ΔE分别为9.48、7.35、6.28,说明-4 ℃的样品冻融前后颜色变化程度大,而-18、-30 ℃样品的颜色变化程度相近,ΔE变化相对较小。研究过程中发现-4 ℃的鱼片在冻融中出现褐变,颜色变得暗淡,而其他两组温度能较好地维持鱼片褐变的速度。其主要原因可能是肌肉组织的颜色变化主要是由肌红蛋白的含量和不同氧化还原形式(紫红色的脱氧肌红蛋白、鲜红色的氧合肌红蛋白和褐红色的高铁肌红蛋白)决定的,冻融循环产生的冰晶破坏了肌肉细胞结构,加快了蛋白质氧化作用,促使肌肉组织中的肌红蛋白在贮藏过程中自动氧化为高铁肌红蛋白,导致鱼片出现不同程度的褐变[17]。

图3 冻融条件下罗非鱼片ΔE的变化Fig.3 Changes in color difference (ΔE) of tilapia fillets under freeze-thaw conditions
2.4 冻融条件下罗非鱼片总挥发性盐基氮含量的变化
TVB-N含量是评价水产品腐败程度的重要指标,其越低意味着水产品新鲜度越高。根据GB 5009.228—2016 《食品安全国家标准 食品中挥发性盐基氮的测定》[18], 冻罗非鱼片合格标准的TVB-N限量为不高于20 mg/100 g。不同温度下,冻融次数对鱼片TVB-N含量的影响如图4所示。新鲜罗非鱼片的TVB-N含量为8.3 mg/100 g。随着反复冻融的进行,TVB-N含量逐渐增大。在相同的冻融次数,-4 ℃冻藏样品的TVB-N含量最高。鱼片经4 次反复冻融后,在-4、-18 ℃和 -30 ℃条件下样品TVB-N含量分别增长至23.5、16.5、17.4 mg/100 g。其中,-4 ℃条件组TVB-N含量的上升幅度较其他组大,且4 次冻融循环后TVB-N含量高于20 mg/100 g,已为腐败不合格品,而其他两组样品在冻融4 次后仍然合格。由于反复冻融会破坏肌肉的细胞结构,细胞内释放出溶酶体酶、血红素铁和其他促氧化剂,使鱼肉中含氮化合物在酶和促氧化剂的作用下发生降解,产生氨以及胺类等挥发性碱性含氮化合物,导致TVB-N含量升高[19]。样品贮藏温度越低,其TVB-N含量增加速率越低,说明较低的温度能够抑制酶和促氧化剂的活性,从而减少挥发性盐基氮类物质的形成。
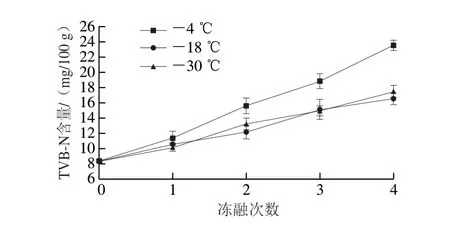
图4 冻融条件下罗非鱼片TVB-N含量的变化Fig.4 Changes of TVB-N contents of tilapia fillets under freeze-thaw conditions
2.5 冻融条件下罗非鱼片水分迁移及含量的变化
利用低场核磁共振检测罗非鱼片中的水分迁移状态和水分含量变化。由图5A~C可知,所有样本都观察到3 个峰,T2b(0.1~10 ms)代表与大分子亲水基团紧密结合的结合水;T21(10~100 ms)主要对应固定在肌纤维网中或厚薄肌丝间的不易流动水,是存在于肌肉中的主要水分;T22(100~1 000 ms)表示纤维束间空间中存在的自由水[20]。从新鲜鱼片的水分分布可知,T22和T21所占比例较高,T2b较低。冻融4 次后,-4 ℃组样品水分含量最低(图5D),可能是在冻融循环过程中,在细胞内部或外部形成的冰晶引起细胞膜的破坏,细胞膜周围的渗漏导致细胞内空间的水移动到细胞外空间,增加了融化后肌肉的滴水损失[21]。
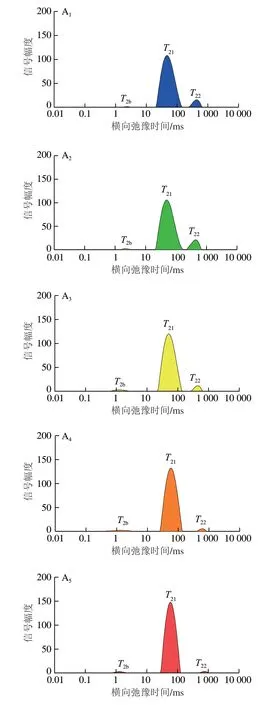
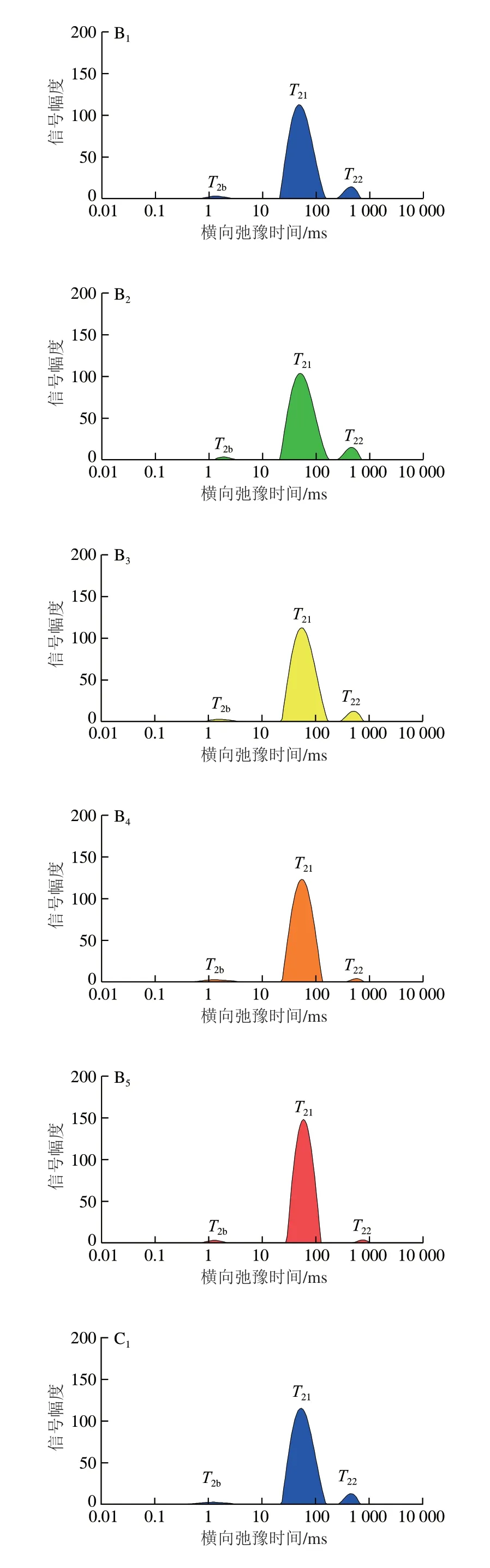
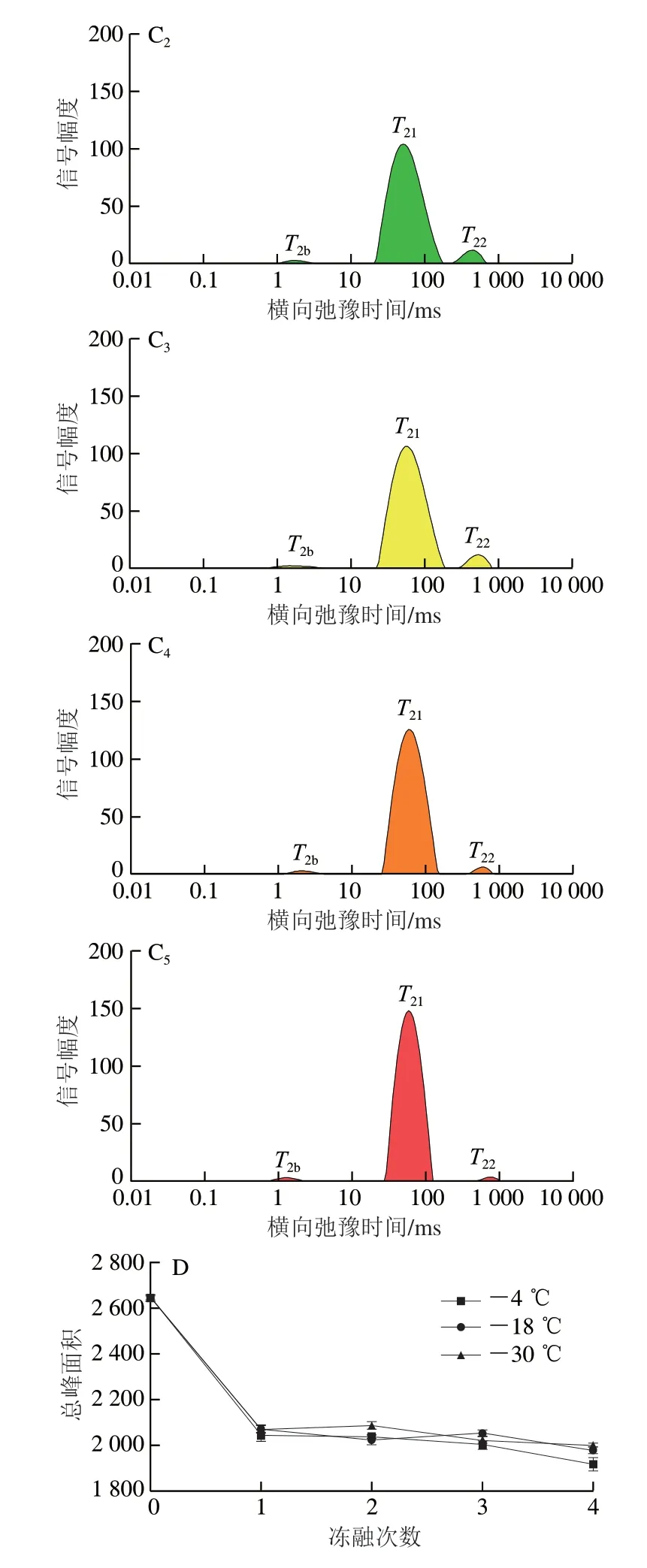
图5 冻融条件下罗非鱼片水分迁移及含量的变化Fig.5 Changes in water mobility and content of tilapia fillets under freeze-thaw conditions
2.6 冻融条件下罗非鱼片微结构及分形维数的变化
图6展示了罗非鱼样品在-4、-18 ℃和-30 ℃冻融条件下肌肉组织的形态变化。罗非鱼肌肉的微结构由两部分组成:红色部分是苏木精-伊红染色后的肌肉组织,白色部分是冰晶留下的孔隙[22]。新鲜鱼片致密排列的肌肉组织图像覆盖率为72.78%,冰晶孔隙细小且圆滑。鱼片在-4、-18、-30 ℃条件下经历4 次冻融循环后,肌肉组织的图像覆盖率分别下降到55.07%、61.36%、62.78%,冰晶孔隙变得不规则且尺寸增大,占据了图像中很大部分区域,冰晶的孔隙率随着贮藏温度的降低而明显减小。这种现象可能是由于冻融使组织脱水和退化,其中,水分迁移和冰晶不断生成造成不规则孔隙的形成,较大尺寸的冰晶会破坏肌肉,使其软化腐败从而导致肌纤维的形态变化[23],而较低温度下冰晶尺寸较小,因此减小了冰晶对肌肉组织的破坏[24]。分形维数对结构、尺寸和面积分数敏感,适用于表征罗非鱼肌肉纤维的不均匀分布。因此,分形维数的变化可以反映这些孔隙的变化。
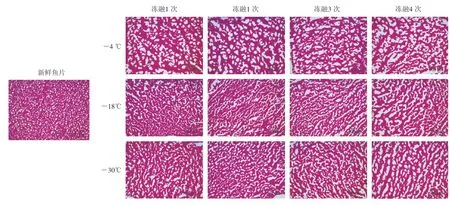
图6 不同温度冻融条件下罗非鱼片微观结构的变化Fig.6 Changes in microstructure of fish fillets under different freeze-thaw conditions
研究发现,冷冻鱼肉中冰晶破坏后的多孔肌纤维结构为无尺度结构,不能通过普通的数学方法测量。分形维数反映了复杂形体占有空间的有效性,它是复杂形体不规则性的量度,对区分微小的结构差异足够敏感,因此它可以恰当地表征肌肉纤维在鱼肉组织中的不均匀分布[25]。在不同的冷冻温度和冻融次数下,鱼片的分形维数如图7所示。总地来说,分形维数随冻融次数的增加呈下降趋势,且在低温下样品分形维数的下降速率较低。新鲜样品的分形维数为1.925。冻融4 次后,-4、-18 ℃和-30 ℃样品的分形维数分别下降到1.815、1.843和1.853。本实验结果与He Qi等[26]报道的结果一致,其发现陈皮提取物处理的冷冻罗非鱼组织分形维数随温度的升高和贮藏时间的延长而减小。陈政等[27]发现分形维数越低,表明冰晶破坏后微结构的不规则程度越高。由于大而不规则的冰晶使肌纤维物理破裂而造成微结构的机械损伤,从而导致分形维数降低、蛋白质变性和其他相关品质参数的变化。

图7 冻融条件下罗非鱼片微结构分形维数的变化Fig.7 Changes in microstructure fractal dimension of tilapia fillets under freeze-thaw conditions
2.7 冻融条件下罗非鱼片微结构分形维数与品质指标的相关性分析
皮尔逊相关系数被广泛用于确定两个变量之间的线性依赖程度[28]。图8给出了分形维数与电导率、总峰面积、TVB-N含量等品质指标的皮尔逊相关系数热图。分形维数与6 个品质指标间有较好的相关性,其中总峰面积、硬度与-4、-18 ℃组的分形维数均呈显著正相关(P<0.05,P<0.01),电导率、TVB-N含量和ΔE与-4、-18 ℃组的分形维数呈显著负相关(P<0.05,P<0.01)。结果表明利用分形维数可以准确地反映上述品质参数的变化,分形维数可以作为定量评价冻融条件下罗非鱼片品质参数变化的可靠指标,与熊铭[29]的研究结果一致。
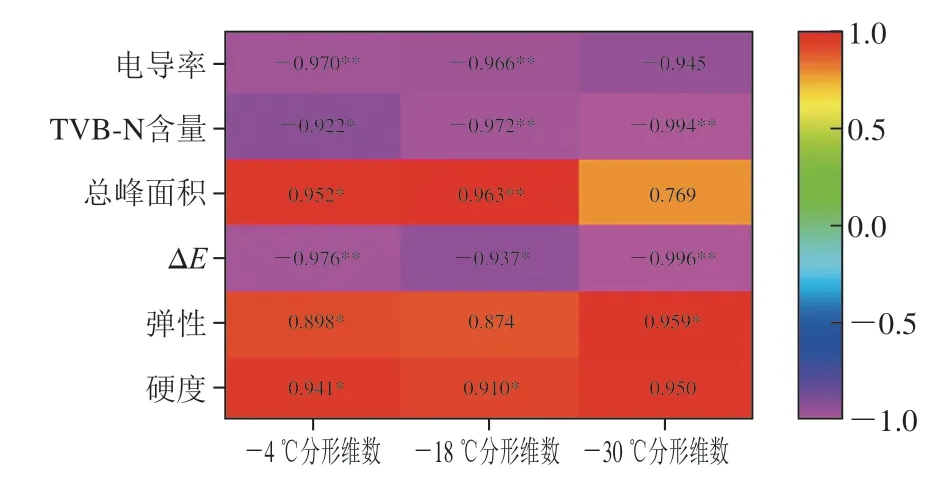
图8 冻融条件下罗非鱼片剖面分形维数与品质指标的相关性Fig.8 Correlation between microstructure fractal dimension and quality parameters of tilapia fillets under freeze-thaw conditions
3 结 论
本实验分析了经多次冻融循环后罗非鱼片微结构和品质指标的变化。结果表明,罗非鱼肌肉组织的剖面分形维数可以用作表征样品微结构变化的有效方法,并且在不同温度冻融过程中分形维数与品质指标(电导率、总峰面积以及TVB-N含量等)显著相关,分形维数变化的幅度随着冷冻温度的降低而降低。因此,分形维数可用于罗非鱼的品质评价。与传统方法相比,分形维数法更好地揭示了微结构的变化,是一种新颖的品质指标,它将为食品保藏研究提供新的思路。
