羧甲基普鲁兰多糖螯合钙的制备及其功效评价
2021-08-31李海鹰杨祥禾魏珍珍杨文智
李海鹰,杨祥禾,魏珍珍,贾 蓓,杨文智*
(河北大学药学院,河北省药物质量分析控制重点实验室,河北 保定 071002)
钙是人体所含最丰富的营养素,且参与了一系列生理过程,如骨骼发育、血管收缩、血管扩张、肌肉功能、神经传递、细胞内信号和激素分泌[1]。人生长、发育及衰老过程中,钙摄入后得到良好的吸收是增强或稳定骨量的关键。有报道显示,青少年摄取钙量与骨密度关系密切[2], 发育期缺钙,则成熟骨骼的骨峰值低,会增加骨质疏松的患病风险。一般男性和女性分别在21 周岁和19 周岁时骨量达到峰值,此后骨量增长停滞[3],中年后骨量明显损失,每年损失总骨量的0.5%~1%[4]。研究表明增加钙摄入量可使骨折风险降低12%[5]。为了保证较高的骨密度,老年人日摄入800 mg钙可有效预防骨流失[6-7]。根据年龄和性别不同,成人每日钙摄入量应在500~1 200 mg之间[8]。 虽然钙可从膳食中摄取,但日常饮食难以达到推荐摄入量[9],调查发现大多数东南亚国家人群的平均膳食钙摄入量低于400 mg/d[10]。2017年《中国家庭健康大数据报告》发布,“补钙”一词榜上有名,中国人钙元素缺失排名第一[11]。因此,补钙制剂也是人群关注的热点。
市场上的补钙制剂可分为无机钙、有机酸钙、有机钙和天然生物活性钙,这些补钙制剂各有优缺点,生物利用度也不尽相同[12-14]。无机钙(如碳酸钙),钙含量高且价格低,但体内吸收率低,易引发结石,从而影响服用者正常的胃肠道功能,此外胃酸分泌差的人群存在严重的吸收问题。有机酸钙可改善无机钙的上述缺点,但葡萄糖酸钙中钙含量相对较低,且高糖成分不适合糖尿病患者;乳酸钙进入消化道产生乳酸根离子,能引起机体酸痛或疲劳;醋酸钙会抑制小肠对锌等微量元素吸收,提升高钙血症的风险[12]。有机钙主要是氨基酸或复合氨基酸螯合钙,钙离子与酸根结合稳定,此类补钙制剂具有左旋结构和较好的脂溶性,显示出良好的生物活性,但其制备工艺相对复杂且价格贵[15]。近年来,研究者发现天然生物活性多糖钙溶解性好,对胃肠道刺激小,不良反应低,能克服传统钙盐的缺点,是一类值得研究与开发的补钙剂[16]。为了更好地获得多糖螯合钙制剂,有研究者将多糖分子的羟基衍生化,引入强亲核原子或基团,常见含氮、磷或羧酸衍生物,从而在多糖分子链上引入强配体基团与钙离子产生稳定螯合[17]。
普鲁兰多糖是一种非离子链状多糖,其来源广泛,具有天然多糖的生物相容性和可生物降解性,同时具有良好的水溶性、黏性和成膜性特点[18]。此外,其分子链上的大量羟基可用于化学修饰,制备衍生物,引入功能基团,拓宽其应用范围。目前,将普鲁兰多糖及其衍生物应用于食品、保健品和药品等领域已获得研究者的 广泛关注[19]。本实验以天然普鲁兰多糖为原料合成羧甲基 普鲁兰多糖鳌合钙,用于治疗骨质疏松小鼠,为新型钙补充剂的开发提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
15~20 g清洁级Balb/C小鼠24 只,雌雄各半,由河北省实验动物中心提供(生产许可证号:SCΧK(冀)2018-004)。
普鲁兰多糖(2 000 kDa) 日本林原化学株式会社;羧甲基普鲁兰多糖(carboxymethyl pullulan,CMP)由实验室自制;氯化钙 北京惠宝联化科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
FTIR-8400s傅里叶变换红外光谱仪 日本岛津仪器公司;T6紫外-可见分光光度计 北京普析通用仪器有限公司;LGJ-18冷冻干燥机 宁波新芝仪器有限公司;TM3000扫描电子显微镜 日本日立仪器公司;AU680全自动生化分析仪 美国Beckman公司;YD-20KZ 硬度仪 天津天大天发科技有限公司。
1.3 方法
1.3.1 CMP-Ca(II)的制备及表征
参考文献[20]合成CMP,经络合滴定法测得制备的CMP羧甲基取代度为40%。配制质量分数1%的CMP水溶液,50 ℃水浴条件下滴加CaCl2溶液,使Ca2+与CMP质量比为2∶1,用2 mol/L NaOH溶液调节反应液pH值至10。反应一定时间后,反应液以4 000 r/min离心5 min除去沉淀(直至无沉淀产生),取上清液,加入过量的2 mol/L Na2CO3溶液除去游离钙离子,4 000 r/min离心5 min。上清液减压浓缩后,加入无水乙醇进行醇沉,静置24 h后抽滤获得CMP-Ca(II)粗品,适量去离子水溶解,装入透析袋(截留分子质量8~12 kDa)中用蒸馏水透析后,将透析液冻干,得CMP-Ca(II)纯品。CMP和 CMP-Ca(II)样品用紫外光谱、傅里叶变换红外光谱和扫描电子显微镜进行表征。
1.3.2 紫外光谱分析
将CMP与CMP-Ca(II)分别溶于蒸馏水中,以蒸馏水为对照,采用紫外-可见分光光度计,在200~500 nm波长范围内进行扫描,分析两者扫描图谱的差异。
1.3.3 傅里叶变换红外光谱分析
分别取干燥的CaCl2、CMP和CMP-Ca(II)样品,与KBr混合,研磨均匀后压片,用傅里叶变换红外光谱仪在4 000~400 cm-1范围内扫描,测定样品的红外吸收光谱。
1.3.4 扫描电子显微镜观察微观结构
采用扫描电子显微镜在真空条件下扫描CMP与 CMP-Ca(II)样品,电压为15 kV,放大倍数为100,观察样品的微观形貌特征。
1.3.5 CMP-Ca(II)配合物中钙离子质量分数测定
精密称定CMP-Ca(II)35 mg,置于烧杯中,加6 mol/L HCl 5 mL和蒸馏水30 mL溶解,煮沸5 min,冷却后转移至50 mL容量瓶中,定容,摇匀。精确量取5.0 mL样品溶液至锥形瓶中,用NaOH溶液调pH值至13~14,加1 滴钙紫红素指示剂,用0.05 mol/L的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液滴定至溶液由紫红色变为蓝色,即达到滴定终点。记录消耗EDTA溶液体积,按下式计算钙离子质量分数,平行测定3 次。

式中:cEDTA为EDTA滴定液浓度/(mol/L);VEDTA为消耗EDTA溶液体积/mL;MCa为Ca的原子质 量/(g/mol);m为待测溶液中CMP-Ca(II)的质量/mg。
1.3.6 CMP-Ca(II)配合物制备工艺优化
选取反应pH值(X1)、m(Ca2+)∶m(CMP)(X2)和反应温度(X3)为考察因素,以钙离子质量分数为评价指标,采用单因素试验考察3 个因素的影响,每个单因素试验平行操作3 次[21]。固定m(Ca2+)∶m(CMP) 为1∶1和温度为50 ℃,考察反应pH值分别为7、8、9、10、11和12时对CMP-Ca(II)配合物钙离子质量分数的影响;固定反应pH值为9和温度为50 ℃,考察m(Ca2+)∶m(CMP)为4∶1、3∶1、2∶1、1∶1、1∶2和1∶3时对CMP-Ca(II)配合物钙离子质量分数的影响;固定m(Ca2+)∶m(CMP)为1∶1和反应pH值为9,考察反应温度为30、40、50、60 ℃和70 ℃时对CMP-Ca(II)配合物钙离子质量分数的影响。依据单因素试验结果,设计3因素3水平的Box-Benhnken响应面试验[22],按照表1优化反应条件。其中用1、0、-1代表自变量的高、中、低3 个编码水平,响应值Y为钙离子质量分数,进行17 次试验。用Design Expert 8.0软件对结果进行分析,获得 CMP-Ca(II)最佳制备的工艺条件并验证。
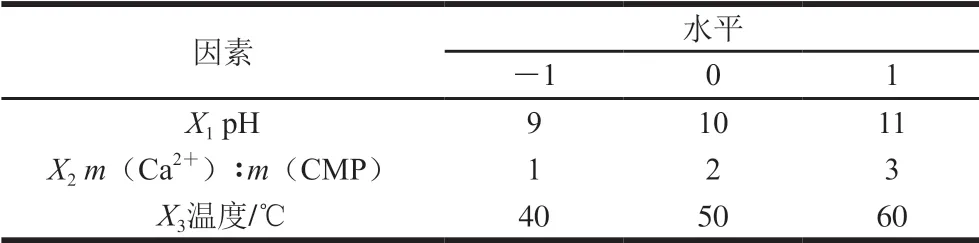
表1 Box-Benhnken响应面法因素水平表Table 1 Factors and levels used for Box-Benhnken design
1.3.7 骨质疏松Balb/C小鼠造模及CMP-Ca(II)体内评价
将15~20 g清洁级Balb/C小鼠随机分为3 组,每组8 只,雌雄各半,分别为空白对照组、模型对照组和CMPCa(II)组。在第1~14天,模型对照组和CMP-Ca(II) 给药组灌胃维甲酸70 mg/(kgmb·d),建立小鼠骨质疏松模型[23],第15~42天,模型对照组灌胃生理盐水,CMP-Ca(II)给药组灌胃100 mg/(kgmb·d) CMP-Ca(II),空白对照组在1~42 d均灌胃生理盐水。实验期间各组小鼠分笼饲养,饲喂标准饲料,自由饮水,每天记录体质量。实验完毕后,小鼠断头取血,血液室温静置30 min,4 000 r/min离心10 min,分离血清置于4 ℃冰箱贮存。血清样本采用AU680全自动生化分析仪测定碱性磷酸酶(alkaline phosphatase protein,ALP)活力,通过偶氮砷III法测定血钙浓度。小鼠取血后,剥离其双侧股骨,剔除骨上附着组织,60 ℃烘至恒质量并称量,以股骨干质量/体质量来计算骨质量指数,游标卡尺测量其左侧股骨长度、宽度和厚度。通过排水法测定股骨体积,以股骨干质量/股骨体积计算骨密度。采用硬度仪测定股骨的骨硬度,记录最大承载力。
1.4 数据统计与分析
2 结果与分析
2.1 CMP-Ca(II)制备工艺优化结果
采用单因素试验考察反应pH值、m(Ca2+)∶m(CMP) 和反应温度对钙离子质量分数的影响。由图1A可知,CMP-Ca(II)的钙离子质量分数随着pH值的增大先升后降。低pH值时,CMP分子中羧基解离度低,不利于与钙离子发生配合;pH 10时CMP-Ca(II)配合物中钙离子质量分数最高;pH>10时,配合物中钙离子质量分数随着pH值的增大而降低,pH值增大可使溶液产生氢氧化钙沉淀,不利于CMP-Ca(II)配合物的合成。因此,选择pH 10为制备CMP-Ca(II)的最佳条件。 Ca2+与CMP二者的质量比也影响CMP-Ca(II)的钙离子质量分数,由图1B可知,在选定的比例下,随着m(Ca2+)∶m(CMP)减小,CMP-Ca(II)配合物钙离子质量分数先升高后降低,适宜的m(Ca2+)∶m(CMP)为2∶1。适当升高反应温度可提升反应物CMP与Ca2+之间的碰撞频率,促使产物生成。50 ℃时, CMP-Ca(II)配合物钙离子质量分数最高(图1C),若再提高反应温度,则CMP分子和Ca2+运动速度过快,限制了CMP分子上的配位基团与Ca2+的结合。
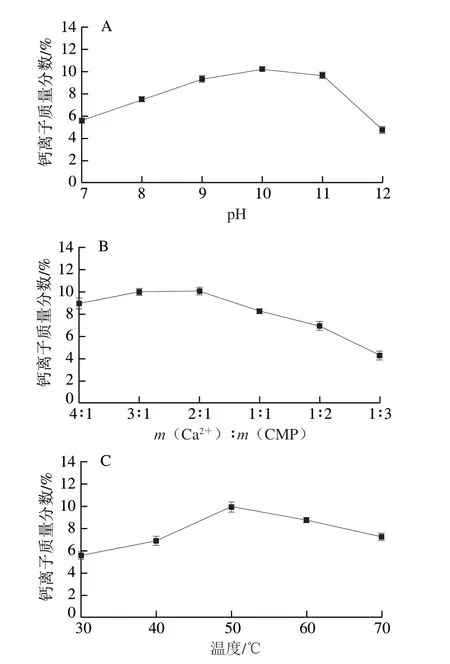
图1 pH值(A)、m(Ca2+)∶m(CMP)(B)和反应温度(C) 对CMP-Ca(II)配合物钙离子质量分数的影响Fig.1 Effect of pH (A), m (Ca2+)∶m (CMP) ratio (B) and temperature (C) on Ca2+ content of CMP-Ca(II)
参考单因素试验结果,设计3因素3水平的 Box-Benhnken响应面实验考察pH值(X1)、m(Ca2+)∶m(CMP)(X2)和反应温度(X3)对CMP-Ca(II)配合物制备工艺的影响,以钙离子质量分数(Y)为评价指标,结果见表2。各因素交互作用对钙离子质量分数影响的等高线和响应面图见图2。

表2 响应面法优化CMP-Ca(II)配合物制备工艺参数结果Table 2 Experimental design with results for response surface analysis

图2 各因素交互作用对钙离子质量分数影响的等高线和响应面图Fig.2 Contour plots and three-dimensional response surface plots describing the interactive effects of different factors on calcium content of CMP-Ca(II)
利用Design-Expert软件,得到回归方程:Y=-166.179 5+31.145X1+4.329X2+0.614 75X3-0.01X1X2-0.006 5X1X3-0.005X2X3-1.531X12-0.981X22-0.005 36,其决定系数R2为0.999 3,模型方程拟合度良好;变异系数为0.46%,实验误差小,能准确地预测实际情况。回归方程失拟性检验P=0.896 9>0.05,符合模型要求,可利用该模型分析预测。经方差分析和统计学检验,模型的一次项X1、X2、X3,交互项X1X3、X2X3和二次项X12、X22、X32对CMP-Ca(II)复合物钙离子质量分数(Y)影响显著(P<0.05),其中X1、X12、X22和X32影响高度显著(P<0.000 1)。
为探讨各因素对制备CMP-Ca(II)配合物钙离子质量分数的影响,采用Design Expert软件绘制CMP-Ca(II) 中钙离子质量分数(Y)与反应pH值(X1)、m(Ca2+)∶m(CMP)(X2)和反应温度(X3)之间的等高线图和三维响应面图,考察X1、X2和X3对Y的影响。 图2A1和图2A2为反应pH值与m(Ca2+)∶m(CMP)交互作用对钙离子质量分数的影响,图2B1和图2B2为反应pH值与反应温度的交互作用对钙离子质量分数的影响,椭圆形等高线表示反应pH值与m(Ca2+)∶m(CMP)和反应pH值与反应温度对CMP-Ca(II)配合物钙离子质量分数有显著影响。图2C1和图2C2为m(Ca2+)∶m(CMP)与反应温度的交互作用对钙离子质量分数的影响,等高线稀疏且呈圆形,说明m(Ca2+)∶m(CMP)与温度对CMP-Ca(II)配合物钙离子质量分数影响不显著。采用Design Expert软件优选CMPCa(II)配合物的最佳制备条件为50 ℃、pH 10和m(Ca2+)∶m(CMP)=2∶1。为验证模型可靠性,采用优化条件制备3 批CMP-Ca(II)配合物,获得的最高钙离子质量分数为10.3%,与模型方程预测值相一致。
2.2 CMP-Ca(II)的结构表征
CMP-Ca(II)配合物紫外光谱图如图3所示,CMP溶液在255 nm波长处显示出较强吸收峰,但CMP-Ca(II) 在200~400 nm波长处未见明显的紫外吸收,CMP在255 nm波长处的最大紫外吸收峰消失,表明CMP中的 —COOH与Ca2+发生络合,使得CMP-Ca(II)未见明显的羰基基团紫外吸收峰。

图3 CMP及CMP-Ca(II)配合物的紫外光谱Fig.3 UV spectra of CMP and CMP-Ca(II) complex
CMP-Ca(II)配合物傅里叶变换红外光谱分析结果见图4。CMP与CaCl2发生配合反应生成CMP-Ca(II),其红外光谱与CMP相比,—OH特征吸收峰由3 420 cm-1处 移至3 391 cm-1处,CMP-Ca(II)红外光谱曲线中CMP在1 732 cm-1处的羰基吸收峰消失,于1 600 cm-1处出现新的强吸收峰,证明成功合成CMP-Ca(II)配合物。CMP-Ca(II) 配合物合成过程中CMP的—OH和—COOH与Ca2+形成强配位键,导致CMP的羰基吸收峰消失。此外, CMP-Ca(II)的红外光谱图与CaCl2钙供体的红外光谱图存在显著不同,这与文献[21,24]报道的结果类似。

图4 CMP-Ca(II)傅里叶变换红外光谱图 Fig.4 FTIR spectra of CMP-Ca (II)
由图5可看出,CMP呈较为致密的层状结构,表明多糖分子间作用可形成重叠结构。而CMP与钙离子配合后,CMP-Ca(II)的结构发生根本改变,表面变为不规则的颗粒状,说明CMP与金属离子配合时其糖链发生不同程度的卷曲,配位键的形成极大改变了多糖结构,配位前后表面形貌发生了显著的变化[25]。

图5 CMP(A)和CMP-Ca(II)(B)扫描电子显微镜图 Fig.5 SEM images of CMP (A) and CMP-Ca(II) (B)
2.3 CMP-Ca(II)治疗小鼠骨质疏松效果的初步评价
体质量是反映生物体健康状况的重要指标,经维甲酸及CMP-Ca(II)制剂干预后小鼠体质量的变化如图6所示。模型对照组小鼠4 d后体质量持续下降,而生理盐水灌胃的空白对照组小鼠体质量正常增长(图6A),说明维甲酸对小鼠的生长影响显著。维甲酸灌胃3 d后,小鼠摄食量、活动量均明显减少,反应迟钝,蜷缩成团,可见被毛枯槁乍起、眼鼻部及耳部黏膜红肿发炎、后腿站立不起等变化。14 d后处死小鼠,比较发现空白对照组小鼠股骨光滑,骨骼关节发白发亮,未发现自发性骨折,而维甲酸模型对照组股骨表面略显粗糙,有肉眼可见骨质缺失,骨骼关节发黑发暗(图7A)。摘取空白 对照组与模型对照组小鼠的心、肝、脾、肺和肾,肉眼观察未见两组小鼠脏器的大小、形态的异常改变,表明给予70 mg/(kgmb·d)维甲酸建立小鼠骨质疏松模型成功。图6B是CMP-Ca(II)组和空白对照组小鼠在28 d内体质量的变化情况。初始时,空白对照组小鼠体质量明显高于模型组,基本维持在25 g左右。随着补充 CMP-Ca(II),CMP-Ca(II)组小鼠的体质量呈现快速上升趋势。表明灌胃一定剂量的CMP-Ca(II)在小鼠自身生长过程中可参与营养骨骼并促进小鼠生长。

图6 不同组别的Balb/C小鼠体质量变化Fig.6 Body mass variation of Balb/C mice in different experimental groups
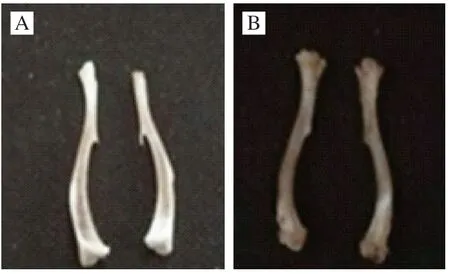
图7 空白对照组(A)与模型对照组(B)小鼠股骨形态图Fig.7 Appearance of femur in normal (A) and model (B) mice
骨质疏松早期无明显症状,通常以测定骨密度来初步判断是否骨质疏松[26-27],但仅凭骨密度不能反映骨强度,如患有石骨病时患者骨密度虽正常,但该病引起的骨折发生率却很高,故除骨密度外,骨硬度也是反映骨是否正常的重要指标[28]。另外,骨质量与骨结构紧密相关,股骨干质量、股骨钙含量变化等也被作为评价补钙制剂效果的指标[29]。为全面反映骨骼生长情况,对空白对照组、模型对照组和CMP-Ca(II)给药组小鼠股骨指标、骨密度、骨硬度、血钙浓度、ALP活力进行了测定,结果如表3所示。与空白对照组相比,模型对照组 小鼠的股骨长度、宽度、厚度、干质量和骨质量指数均显著降低,骨密度和骨硬度均显著减小(P<0.05),说明维甲酸灌胃对小鼠的骨骼发育产生了明显影响。动物体内99%以上的钙沉积于骨骼与牙齿中,正常生物体血钙含量低,且与骨钙含量维持动态平衡,但骨质疏松可促使骨钙溶出,导致血钙含量升高。此外,骨质疏松时,血液中ALP活力会明显升高。故测定骨代谢的血钙浓度和ALP活力对骨质疏松症等代谢性骨病的诊断具有重要意义[30]。由表3可知,维甲酸使得模型对照组ALP活力显著升高,表明模型小鼠破骨细胞的活性依旧较强。但血钙浓度与空白对照组无显著差异,这可能与长期停用维甲酸后小鼠自身稳态调节有关。上述结果表明,模型对照组小鼠骨骼处于负钙平衡状态,骨质疏松倾向明显,说明造模成功。与模型对照组相比,CMP-Ca(II)组小鼠股骨长度并未增加,表明成年小鼠钙质的补充并不能增加骨长,但小鼠股骨的宽度、厚度、干质量和骨质量指数均有不同程度的增加,说明CMP-Ca(II)对提高骨质量有明显效果,主要是通过增加骨横径及骨质量实现;此外,CMP-Ca(II)组小鼠股骨的骨密度、骨硬度较模型对照组均有不同程度的改善,ALP活力下降,说明 CMP-Ca(II)可抑制骨破坏并调节骨重建,具有一定改善维甲酸导致的骨质疏松作用。
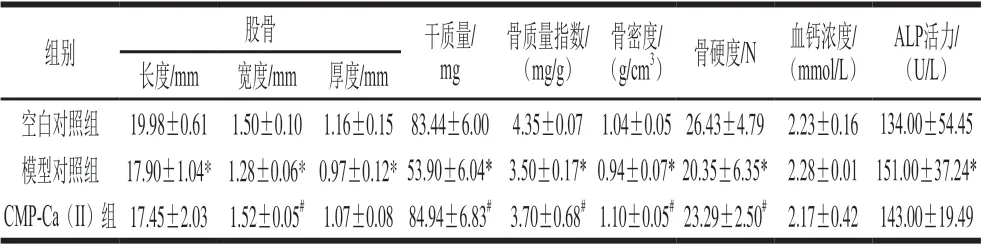
表3 不同小鼠不同指标的测定结果Table 3 Measured bone indexes of mice in different groups
3 结 论
本实验采用单因素试验和Box-Benhnken响应面实验优化条件,制备了钙离子质量分数为10.3%的 CMP-Ca(II)。CMP-Ca(II)与CMP相比,紫外光谱和傅里叶变换红外光谱图差异明显,CMP-Ca(II)的紫外光谱中255 nm波长处最大吸收峰消失,而在红外光谱中于1 600 cm-1处出现新的吸收峰,证明CMP-Ca(II) 配合物成功合成。扫描电子显微镜观察结果显示, CMP-Ca(II)产物为粒状结构。采用维甲酸构建骨质疏松小鼠模型,以CMP-Ca(II)配合物为补钙剂,验证其对骨质疏松小鼠补钙效果。经过28 d干预,CMP-Ca(II)可提高骨质量,其中,以增加骨横径及骨质量为主,此外CMP-Ca(II)还可改善骨密度、骨硬度,具有一定改善维甲酸导致的骨质疏松作用。
