葡萄籽原花青素低聚体治疗实验性自身免疫性脑脊髓炎小鼠的机制研究
2021-08-31薛丽媛丁智斌李彦青宋丽娟李艳花尉杰忠王颖莉马存根
薛丽媛,王 青,丁智斌,苗 强,李彦青,宋丽娟,3,李艳花,尉杰忠,5,王颖莉,马存根,3,
多发性硬化症是中枢神经系统的炎症性脱髓鞘疾病,影响全世界200多万人,主要病理特征包括炎症、脱髓鞘、轴突丢失和胶质细胞增殖等[1]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是研究多发性硬化症的经典动物模型,具有相似的多发性硬化症特征[2]。目前治疗多发性硬化症的药物主要是激素和免疫抑制剂,副作用多,价格昂贵[3]。因此,研究致力于从天然化合物中寻找活性成分,探索新型治疗药物[4]。
原花青素(procyanidins,PC)是从植物的皮、壳和种子中提取获得的一类具有代表性的黄烷醇类化合物,低毒性、高效率和生物利用度高的特点[5]。PC是由儿茶素或表儿茶素聚合而成,根据聚合程度不同分为原花青素低聚物(procyanidolic oligomers,OPC,二聚体到四聚体)和原花青素高聚体(procyanidolic polymers,PPC,五聚体以上的聚合物)[6]。葡萄籽含有丰富的PC,具有抗氧化、抗炎、抗癌、神经保护等作用[7]。有研究显示,PC对阿尔茨海默病和多种中枢神经系统疾病显示出良好的临床疗效[8-11]。然而,PC治疗多发性硬化症的相关研究较少。网络药理学从多层次,如靶点和途径,系统阐明药物的作用机制[12]。本研究采用网络药理学与实验结合的方法分析葡萄籽原花青素低聚体(grape seed oligomeric procyanidins,GPC)治疗EAE小鼠的作用机制,为GPC在多发性硬化症治疗中的临床应用提供依据。
1 材料与方法
1.1 实验材料
1.1.1 有效成分的筛选和GPC目标的预测 使用PubMed数据库(https://pubmed.ncbi.nlm.nih.gov/)检索参考文献,并收集GPC中具有神经保护作用的活性化合物。之后从PharmMapper(http://www.lilabecust.cn/pharmmapper/)和STITCH(http://stitch.embl.de/)数据库中获得目标靶点。来自PharmMapper数据库的靶点通过分数>0.9进行筛选,通过UniProt数据库(http://www.uniprot.org/)对靶点进行标准化处理。利用Cytoscape 3.6.1软件绘制“药物-靶点”网络。
1.1.2 获取多发性硬化症的相关靶基因 利用人类基因数据库(GeneCards,https://www.genecards.org/)和人类孟德尔遗传数据库(OMIM,https://omim.org/),通过检索“multiple sclerosis”检索多发性硬化症的相关靶基因。通过相关性评分>6.705对GeneCards数据库中的靶基因进行筛选。
1.1.3 网络的构建和拓扑分析 利用Cytoscape拓扑分析功能分析蛋白质-蛋白质相互作用(PPI)网络中靶基因的平均自由度和最大自由度的拓扑参数。利用Excel函数功能获取药物与疾病靶点的交集,得到GPC对多发性硬化症的治疗靶点,并在微生物信息平台(https://www.bioinformatics.com.cn)绘制韦恩图。将目的基因引入STRING 11.0数据库(https://string-db.org/)中,以收集靶基因之间的功能关系。将所得数据引入Cytoscape 3.6.1软件中,建立靶基因间的PPI网络。利用Cytoscape 3.6.1绘制“药物-靶点-疾病”网络。利用Cytoscape拓扑分析功能分析PPI网络中靶基因的平均自由度和最大自由度的拓扑参数。
1.1.4 核心靶点的生物学功能和途径富集分析 将1.1.3中获得的核心目标以“GeneSymbol”的格式导入DAVID6.8 (http://david.nifcrf.gov/)数据库进行基因本体(GO)分析和京都基因和基因组百科全书(KEGG)通路富集分析。筛选出重要的生物学功能和核心通路(P<0.05,count≥7),绘制气泡图。
1.2 实验动物和EAE模型的建立 10~12周龄的C57BL/6雌性小鼠(12只),购自北京维通利华实验动物技术有限公司,饲养室温为25 ℃,无致病菌。所有动物实验均经山西中医药大学实验动物伦理委员会批准。将MOG35-55多肽(myelin oligodendrocyte glycoprotein 35-55,上海强耀生物科技有限公司)每只小鼠200 μg溶解于生理盐水,结核杆菌H37R(美国 DIFCO公司)每只小鼠400 μg完全溶解于弗氏佐剂(美国 Sigma公司)。每只小鼠注射抗原乳剂,诱导腰骶背膨大区的EAE。免疫时间记录为免疫后第0天。每只小鼠在第0天和第2天腹腔注射300 ng百日咳毒素(PTX,美国 ListLabs公司)。至少两名研究员隔日对动物进行1次双盲临床评分评定。
1.3 GPC管理及临床评分 将12只小鼠分为EAE对照组和GPC治疗组,各6只。GPC购自天津尖峰天然产品研发有限公司。从免疫后第3天至第28天,GPC治疗组小鼠采用GPC灌胃[50 mg/(kg·d)][13-14],对照组小鼠以生理盐水灌胃。
采用国际标准的5分法,从第0天起定期观察并评价实验小鼠症状。评价标准:无任何临床症状计0分;步态蹒跚或尾部张力丧失计1分;后肢和尾部部分瘫痪计2分(共济失调);单侧后肢和尾部全瘫痪计3分;双后肢和尾部全瘫痪计4分;濒死或死亡计5分。两个标准之间的症状测量为±0.5分。
1.4 样本收集和分析 免疫后第28天,每只小鼠以100~150 μL戊巴比妥钠(10 g/L)在无菌条件下腹腔注射麻醉。之后将两组各3只小鼠心内灌注生理盐水,磷酸盐缓冲液(0.01 mol/L,pH=7.4)中加入4%多聚甲醛灌注,固定分离出小鼠脊髓组织后,采用15%、25%、30%的蔗糖溶液浸泡24 h,快速提取和脱水,包埋组织于液氮中快速冰冻。使用冰冻切片机(CM1850,德国Leica)获得脊髓(10 μm)冠状切片,并在4℃环境中保存,用于苏木精-伊红(hematoxylin/eosin,HE)、固蓝(luxol fast blue,LFB)和免疫荧光染色。其余小鼠仅在心脏灌注生理盐水取出脊髓,进行酶联免疫吸附法(enzyme-linkedimmunosorbent assay,ELISA)和蛋白质印迹法(Western Blotting)检测。
1.4.1 组织学染色 采用HE和LFB染色检测脊髓病理变化。HE染色:将玻片浸泡在苏木精溶液中2 min,水中浸泡1 min,之后在伊红溶液中浸泡10 min。之后在1%盐酸乙醇中分化10 s。LFB染色:玻片在56 ℃条件下浸入固蓝溶液中16 h,在95%乙醇和蒸馏水中去除过量的染液,在碳酸锂溶液中分化15 s。采用蒸馏水和80%乙醇洗涤后,以梯度乙醇脱水,最后使用中性树胶封片。在光学显微镜(DM4000B,德国Leica公司)下成像一组匹配的连续切片(每只小鼠3片)。采用Image Pro Plus 6.0测量脊髓HE染色浸润细胞数量和LFB染色的累积光密度(>20个单核细胞/片)。
1.4.2 免疫荧光染色 将脊髓冰冻切片采用1%牛血清白蛋白(bovine serum albumin,BSA)在室温下封闭30 min;两组切片分别加入1%BSA配制的一抗髓鞘碱性蛋白(myelin basic protein,MBP)1∶500,4 ℃孵育过夜;次日PBST漂洗切片3次,之后加入相应的二抗,在室温下孵育1 h;PBST漂洗切片3次,孵育DAPI 5 min;甘油封片,并在荧光显微镜下以盲法观察玻片;使用Image Pro Plus 6.0软件进行光密度值测定。
1.4.3 ELISA检测 根据说明书步骤,采用ELISA试剂盒测定脊髓上清液中氧化应激和炎症反应指标水平,包括超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、活性氮自由基(reactive nitrogen species,RNS)、活性氧自由基(reactive oxygen species,ROS)、γ-干扰素(interferon-γ,INF-γ)、白细胞介素17(interleukin-17,IL-17)、白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)。读取OD值(450 nm),结果以pg/mL表示。
1.4.4 Western Blotting检测 在免疫后第28天,采用生理盐水灌胃小鼠,使用微量组织匀浆器(美国 KimbleKontes)对脊髓进行匀浆,使用蛋白质提取试剂盒(美国 Sigma),辅以蛋白酶抑制剂。匀浆在4 ℃环境中以13 000 r/min离心20 min,收集上清液。采用BCA法测定蛋白质浓度。配SDS-PAGE胶,上样等量蛋白质(30μg)转至聚偏二氟乙烯(PVDF)膜上(Imobilon-P,美国 Millipore)。使用5%脱脂奶粉封闭,在4 ℃与一抗兔抗MBP抗体、蛋白激酶B(protein kinase B,Akt)抗体、细胞外信号调节激酶(extracellular signal-related kinase,ERK)抗体、c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)抗体、磷酸化蛋白激酶B(p-Akt)抗体、磷酸化细胞外信号调节激酶(p-ERK)抗体、磷酸化c-Jun氨基端激酶(p-JNK)抗体、β-actin抗体(1∶1 000,美国Bioworld)孵育过夜。次日洗膜后,与相应二抗在室温下摇床孵育2 h。应用增强化学发光(ECL)法对波段进行可视化。

2 结 果
2.1 GPC主要活性化合物和靶点 通过文献检索筛选出7种有效成分[15-21],详见表1。在PharmMapper和STITCH数据库中预测了78个药物靶点,在Uniprot数据库中对潜在靶点进行了标准化。使用Cytoscape 3.6.1软件构建“药物-靶点”网络,详见图1。网络由85个节点和215条边组成。
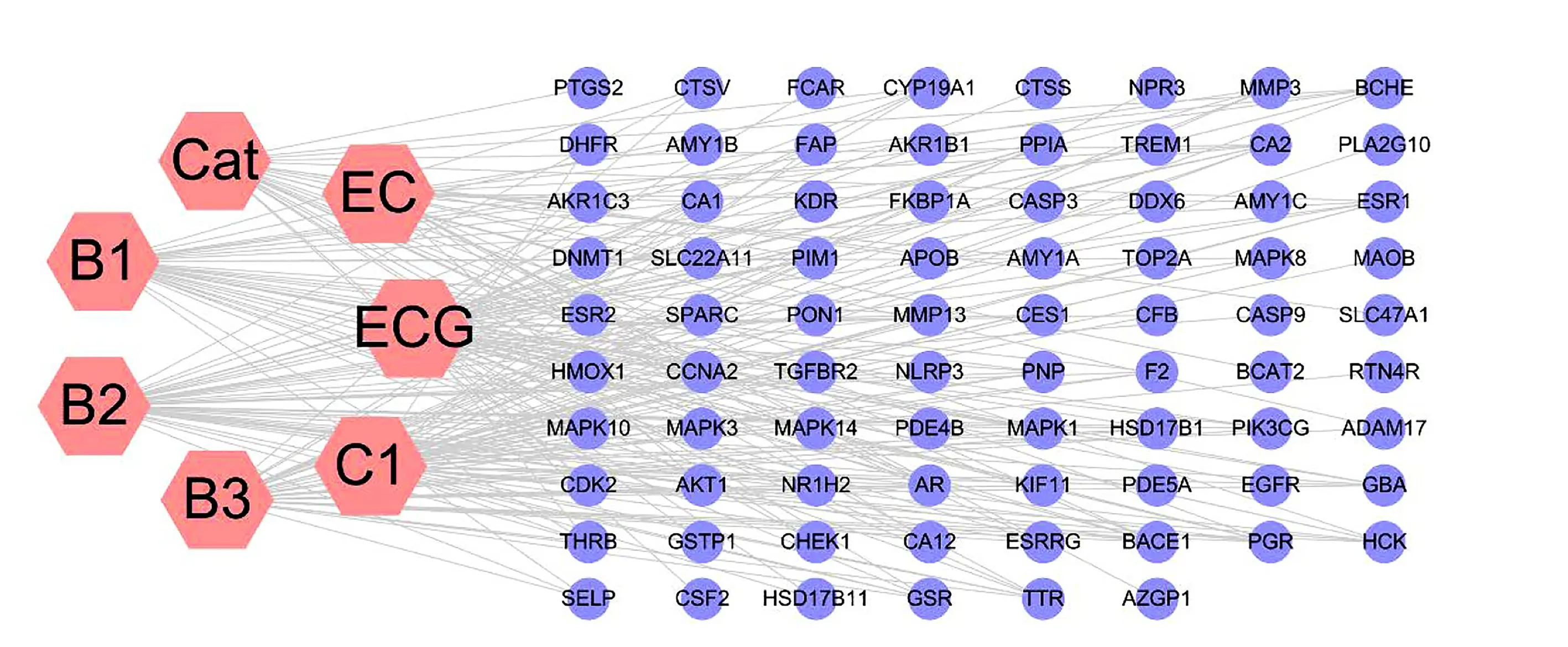
图1 “化合物-靶点”网络
2.2 疾病靶基因的预测和网络构建 分别在GeneCards和OMIM数据库中检索“multiple sclerosis”,收集1 701个多发性硬化症相关靶点(删除重复项)。将药物的靶蛋白和疾病的靶基因取交集,获得共同靶点,利用微生物信息平台绘制Venny图,详见图2A。使用STRING 11.0数据库和Cytoscape 3.6.1构建PPI网络,详见图2B。网络(隐藏1个断开的节点)由41个节点和260条边组成。度值表示网络中节点的重要性顺序,度值越大,靶点越重要。平均度值为12.4,AKT1的度值最大(为32)。节点表示靶点,边表示靶点间的交互关系。从网络可以看出,AKT1、CASP3、MAPK1、EGFR、PTGS2、MAPK3、MAPK14、MAPK8是GPC治疗多发性硬化症的核心靶点。使用Cytoscape 3.6.1软件构建“化合物-靶点-疾病”网络,每条边表示目标与化合物或疾病之间的关系,详见图2C。网络由50个节点和165条边组成。
2.3 富集分析 GO属于基因功能分类系统,有3个分支,包括生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)。通过对靶标的富集分析,GO生物学功能表明GPC治疗EAE小鼠的药效机制涉及27项(P<0,count≥7),包括10个生物学过程(肽酰丝氨酸磷酸化、对脂多糖的反应、细胞增殖的正调控、基因表达的正调控、转录的正调控、信号转导、蛋白质磷酸化、RNA聚合酶Ⅱ启动子转录的正调节、凋亡过程、转录和DNA模板)、10个细胞化合物(胞外空间、胞浆、核质、线粒体、细胞质、胞外区、核、胞外体、质膜和细胞内)和7个分子功能(酶结合,蛋白质结合、激酶活性、丝氨酸/苏氨酸激酶活性、ATP结合、蛋白激酶活性和锌离子结合),详见图3。本研究筛选出32条信号通路(P<0.05,count≥7),与肿瘤(如肿瘤坏死因子信号通路)、炎症(如MAPK信号通路)、病毒感染(如乙肝)等有关,详见图4。
2.4 GPC减轻EAE小鼠临床症状和中枢炎症,保护髓鞘 免疫第11天,小鼠出现相关症状。与EAE对照组比较,GPC治疗组小鼠临床评分较低,详见图5。HE染色显示,与EAE对照组比较,GPC治疗组小鼠炎性细胞浸润减少(P<0.05),详见图6A。LFB染色显示,与EAE对照组比较,GPC治疗组脱髓鞘减少(P<0.01),详见图6B。免疫荧光染色显示:GPC治疗组MBP平均荧光强度高于EAE对照组(P<0.05),详见图6C。Western Blotting显示:GPC治疗组MBP相对蛋白表达量高于EAE对照组(P<0.05),详见图6D。
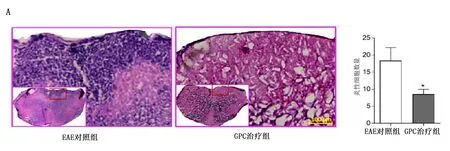
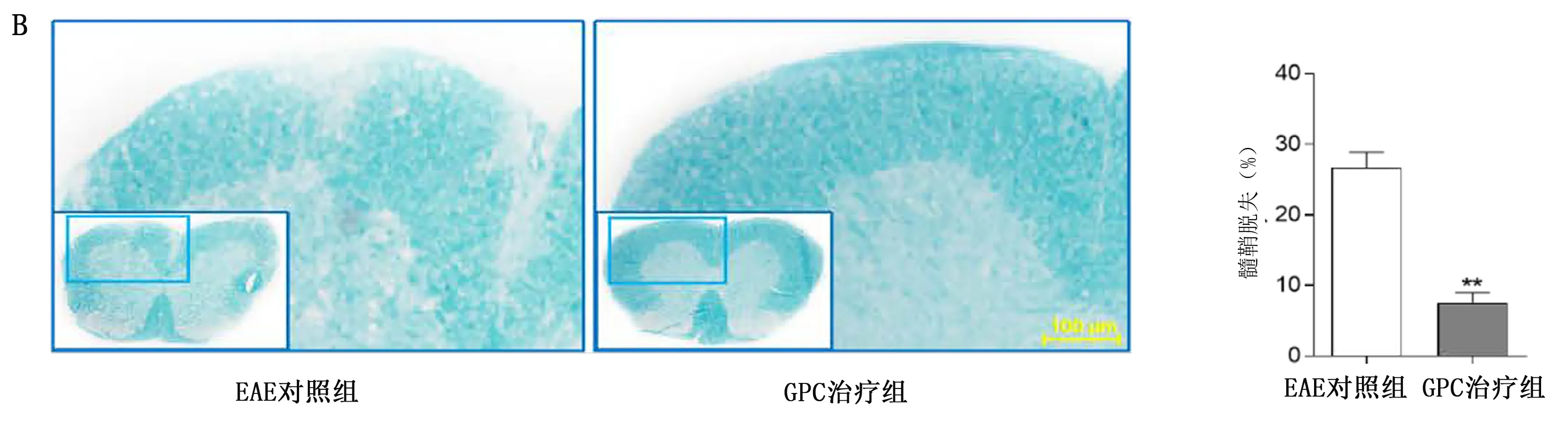
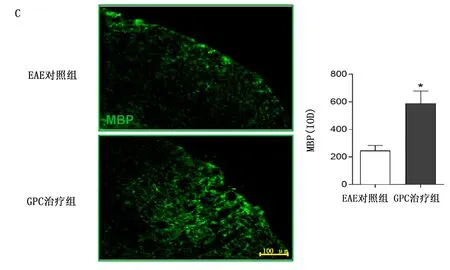

图5 两组小鼠每日临床评分变化
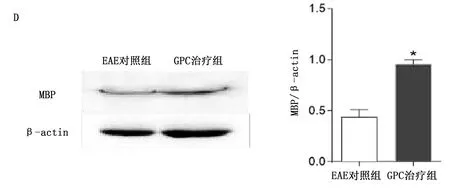
与EAE对照组比较,*P<0.05,**P<0.01。
2.5 GPC对氧化应激和炎症反应指标的作用 GPC具有较好的抗氧化应激和抗炎作用。与EAE对照组比较,GPC治疗组MDA(P<0.01)、RNS(P<0.01)、ROS(P<0.001)表达降低;GPC治疗组INF-γ(P<0.05)、IL-17(P<0.01)、IL-1β(P<0.01)、IL-6(P<0.001)和TNF-α(P<0.01)表达受到抑制。详见图7。
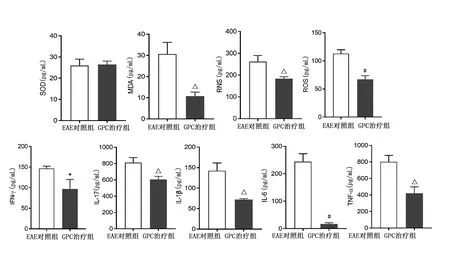
与EAE对照组比较,*P<0.05,△P<0.01,#P<0.001。
2.6 GPC抑制炎症信号通路 为验证GPC在EAE小鼠中的抗炎机制,根据KEGG富集分析结果,验证GPC对MAPK和PI3K/Akt信号通路的调节作用。Western Blotting检测Akt、JNK和ERK及磷酸化水平,发现GPC能抑制Akt、JNK和ERK磷酸化。详见图8。
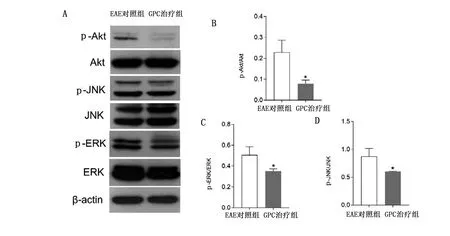
与EAE对照组比较,*P<0.05。
3 讨 论
目前,多发性硬化症发病机制尚不明确,炎症反应是发病机制中的一个关键过程[22]。多发性硬化症的治疗主要包括抗炎和免疫调节,相关西药治疗靶点单一,不良反应多[23]。中药多靶点特征可能优于单靶点药物[24],但由于其多化合物和多目标协同效应,具有复杂性和挑战性。网络药理学通过收集生物活性化合物,预测药物靶点,区分疾病相关基因的优先级,进一步建立“药物-靶点-疾病”网络,以整体的思维方式和较强的预测能力为中医药现代化和新药开发提供理论依据[25]。本研究通过网络药理学和动物实验分析GPC治疗多发性硬化症的潜在机制。
首先,分析出7种GPC活性化合物作用于42个靶点治疗多发性硬化症,表明GPC治疗多发性硬化症是多个化合物和多个靶点协同作用的结果。从PPI网络中发现AKT1、MAPK1、MAPK3等具有较高度值的靶点,表明这些靶点可能是GPC治疗多发性硬化症的核心靶点。GO富集分析表明,GPC治疗多发性硬化症是通过调节细胞增殖、调控转录、信号转导、蛋白磷酸化和凋亡过程实现的。KEGG通路富集了32条与氧化应激、炎症、肿瘤、病毒感染等多种生物学过程相关的途径。在KEGG通路的富集结果中,通过P值和count值筛选后,观察到MAPK和PI3K/Akt信号通路是两个重要的靶通路,这两种途径与细胞增殖、应激、炎症和凋亡有关[26-27],与多发性硬化症的发生和发展密切相关。相关研究显示,这两种途径的异常激活与EAE模型中炎症细胞浸润和脱髓鞘程度密切相关[28-29]。GPC是一种良好的抗炎物质和抗氧化剂,可抑制这两种途径,表明可能对多发性硬化症具有潜在的治疗作用。
基于上述发现,本研究探讨GPC对EAE的治疗作用及其对上述两种信号通路的影响。结果显示,GPC通过下调AKT、JNK和ERK的磷酸化,改善EAE小鼠临床症状,减少中枢炎症细胞浸润和脱髓鞘,抑制相关氧化应激指标和炎性因子表达,这些与MAPK和PI3K/Akt信号通路有关。MAPK信号通路包括p38MAPK、JNK和ERK。有研究显示,所有MAPK激酶在EAE动物模型的脊髓中被激活,p-ERK和p-JNK更明显[30]。Akt是PI3K/Akt信号通路的重要下游分子[31]。在D-半乳糖诱导的阿尔茨海默病大鼠中,海马突触密度和p-Akt水平降低,外部干预后,上述动物模型临床症状改善,病变相应的蛋白质磷酸化水平下调[32-33],与本研究结果一致。
血液和脑组织之间存在血脑屏障,由毛细血管内皮细胞、基底膜和星形胶质细胞突起的脚板组成[34],可维持中枢神经系统稳态,保护神经组织免受毒素和病原体侵害[35]。药物能否通过血脑屏障是治疗中枢神经系统疾病的关键。然而,关于GPC药代动力学的研究较少,对其穿透血脑屏障的能力有不同的评价。来自TCMSP和Swiss Targe Prediction数据库显示,大多数PC难以穿透血脑屏障,相关研究显示,PC能有效缓解中枢神经系统疾病的症状[8-9,36]。认为与疾病引起的血脑屏障损害有关,已证实EAE小鼠和多发性硬化症病人均存在血脑屏障破坏[37]。因此,本研究探讨GPC对EAE的治疗作用,结果证明GPC治疗有效。由于EAE和多发性硬化症的具体发病机制不同,而EAE是人为诱导外周免疫引起的中枢性炎症损伤,GPC靶点是在中心还是周围有待进一步研究。
本研究采用网络药理学和实验验证方法对GPC的活性成分、靶点和通路进行分析和验证。结果表明,GPC治疗多发性硬化症通过多成分、多靶点和多通路的协同作用发挥疗效。结果证实,GPC的治疗作用是通过MAPK信号通路和PI3K/Akt信号通路抑制炎性因子的表达而发挥抗炎作用。
