基于网络药理学-分子对接探讨保元汤调控线粒体功能治疗冠心病的作用机制
2021-08-31刘启予樊懿萱王彤歆王安璐
刘启予,樊懿萱,王彤歆,王安璐,徐 浩
冠心病是全球疾病负担的重要组成部分,也是中老年人死亡的主要原因[1],其发病机制主要为动脉粥样硬化形成导致冠状动脉管腔变窄甚至阻塞,引起心肌缺血、缺氧甚至梗死。由于线粒体在细胞氧化还原平衡及能量稳态中的核心作用,目前研究认为线粒体结构和功能异常与冠心病发生发展密切相关。观察冠心病病人心肌细胞发现,线粒体DNA(mtDNA)完整性破坏,其编码的呼吸复合物活性降低,电子传递链(ETC)紊乱,氧化磷酸化(OXPHOS)代谢异常,造成三磷酸腺苷(ATP)生成减少,活性氧生成增加[2]。一方面引起心脏供能不足,另一方面导致氧化应激、促进炎症反应和细胞凋亡、血管内皮损伤等,影响动脉粥样硬化形成[3-4]。保元汤始载于明代魏直《博爱心鉴》,后经张景岳等医家发挥,其组方包括人参、黄芪、甘草、肉桂四味药物,是治疗冠心病等心血管疾病的常用方剂之一。“保元者,保守此元气之谓也”,元气者,人生立命之基也。张锡纯指出“是大气者,原以元气为根本”,元气足,大气(即宗气)得以充养,贯注于心脉之中,发挥行血气之功以治疗冠心病。现代药理学研究显示,保元汤通过抗细胞凋亡、抗氧化应激、改善血管内皮舒张功能、增加冠状动脉血流量等发挥心肌保护作用[5-6]。富集保元汤对应的小鼠心肌保护靶点发现,多数靶蛋白均定位于线粒体,由此推测保元汤发挥心肌保护的核心机制可能是调节线粒体功能[7]。针对保元汤多靶点、多途径综合调节的作用特点,本研究运用网络药理学方法及分子对接技术,预测保元汤治疗冠心病的有效成分、潜在靶点及信号通路,探讨保元汤如何通过调控线粒体功能改善冠心病。
1 资料与方法
1.1 中药的活性成分及相应靶点筛选 运用北京蛋白质组研究中心开发的在线生物信息学分析工具BATMAN-TCM平台(http://bionet.ncpsb.org/batman-tcm)分别检索“人参”“黄芪”“甘草”“肉桂”的有效成分及对应的潜在靶点,设置检索参数为Score cutoff≥48、P<0.05进行筛选。
1.2 疾病靶标获取 在人类基因数据库(GeneCards,https://www.genecards.org/)、人类孟德尔遗传数据库(OMIM,https://omim.org/)中以 “coronary heart disease”为检索词进行检索,将两个数据库所得结果合并去重,最终得到冠心病的相关靶标。
1.3 “有效成分-作用靶点”网络构建 将疾病靶标与药物靶点进行比对,筛选两者交集基因,获得保元汤治疗冠心病的作用靶点。运用Excel表格将作用靶点与药物成分进行映射,并将其对应关系整合至Cytoscape 3.7.2软件构建“中药成分-作用靶点”网络图,对网络进行拓扑分析,计算自由度(degree)预测关键靶点。
1.4 蛋白互作网络图构建及聚类分析 运用STRING数据库(https://string-db.org/)分析作用靶点之间的相互作用关系,绘制蛋白互作网络(PPI),设定物种为“Homo sapiens”,互作评分为“medium confidence(0.400)”,去除无相互作用的靶蛋白,其余参数保持默认值。导入Cytoscape 3.7.2软件进行聚类分析,运用MCODE插件识别功能模块,设定参数degree≥2,K-Core≥2进行筛选。该插件可测定大型蛋白质互作网络中的关系密集区域,从而预测可能表达的分子复合物,使后续功能注释具有针对性和准确性[8]。
1.5 基因本体(GO)分析和基于京都基因与基因组百科全书(KEGG)富集分析 利用R 3.6.2软件对上述聚类结果分别进行富集分析,运用Cluster Profiler软件包进行GO功能注释和KEGG富集分析,设定参数为P≤0.05,Q≤0.05,并进行可视化。
1.6 分子对接 选择degree≥30的化合物及靶点进行分子对接,在中医系统药理学技术平台(TCMSP)、Drugbank平台中搜索化合物结构,保存为mol2文件。阳性对照药物选择曲美他嗪(trimetazidine,TMZ),在Drugbank平台中得到曲美他嗪的mol2文件。该药可提高冠心病病人心肌细胞对糖的利用能力,使细胞合成ATP增多,能量供应增强[9]。将关键靶点导入PDB网站(http://www.rcsb.org/),通过放射度(R值)筛选得到对应的靶点蛋白,保存蛋白结构为pdb文件。将mol2及pdb文件导入CB-Dock在线对接平台(http://cao.labshare.cn/cb-dock/)进行分析并可视化,其对接结果主要参考Vina分数(Vina score)与空腔大小。
2 结 果
2.1 保元汤治疗冠心病的活性成分及作用靶点预测 运用BATMAN-TCM平台进行检索,共筛选出保元汤活性成分195个及相应潜在靶点717个。在GeneCards数据库、OMIM数据库中共提取冠心病相关靶标4 010个。将药物潜在靶点与疾病相关靶标取交集,共预测341个保元汤治疗冠心病的作用靶点,对应有效药物成分190个,其中作用于靶点数量超过30个的有效成分共11个。详见表1。

表1 保元汤治疗冠心病的主要有效成分
2.2 药物成分-作用靶点网络图构建 运用Cytoscape 3.7.2软件对保元汤作用于冠心病的有效成分与靶点间的互作关系进行可视化及拓扑分析。有效成分-作用靶点网络图中,共包括531个节点(190个成分节点,341个靶点节点)、1 524条边。详见图1。对网络进行拓扑分析,图中节点大小反映度值大小,节点度值越大表示其在治疗中可能越关键。故筛选出核心基因(degree值≥16)共23个。详见表2。
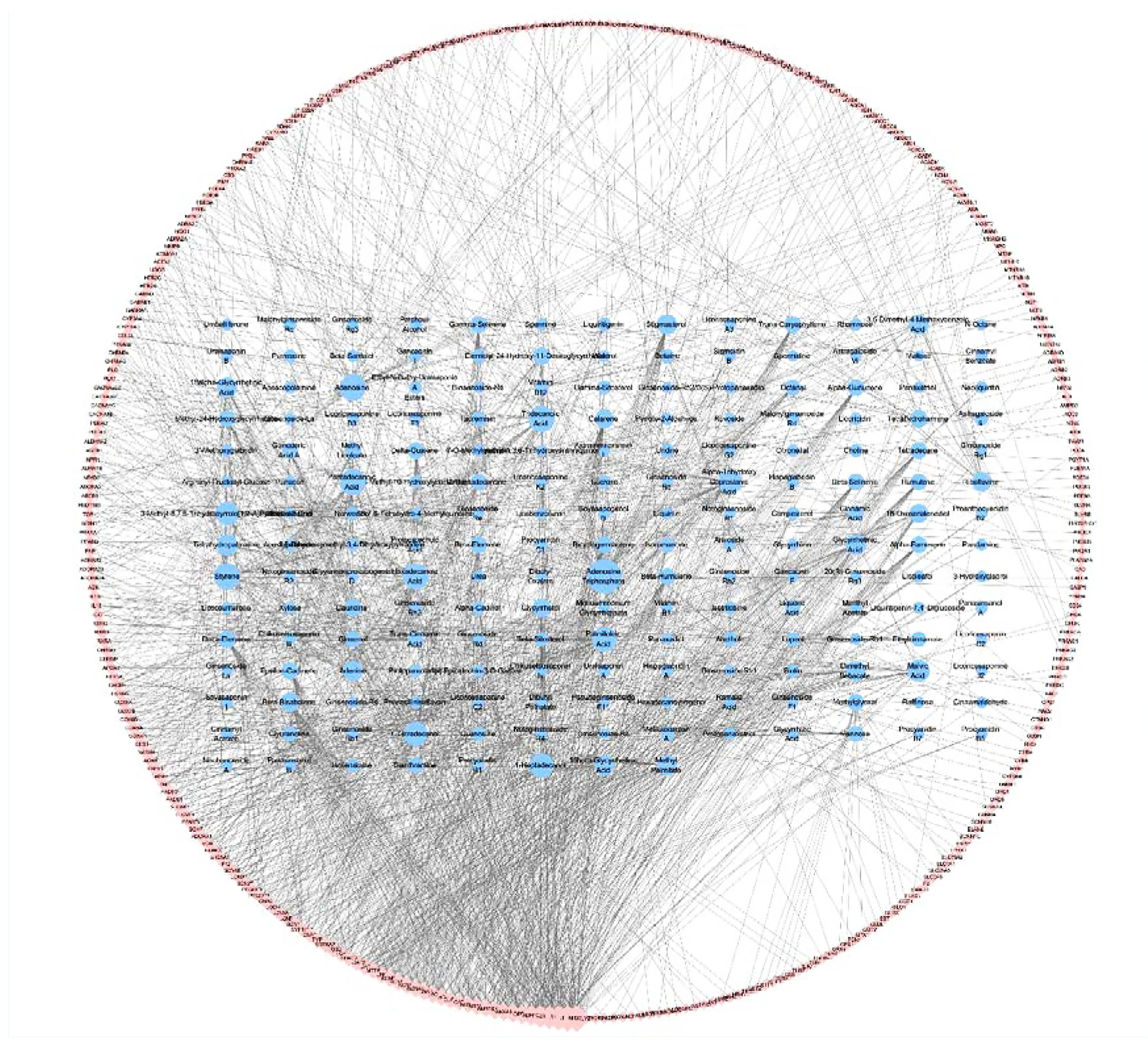
图1 有效成分-作用靶点网络图
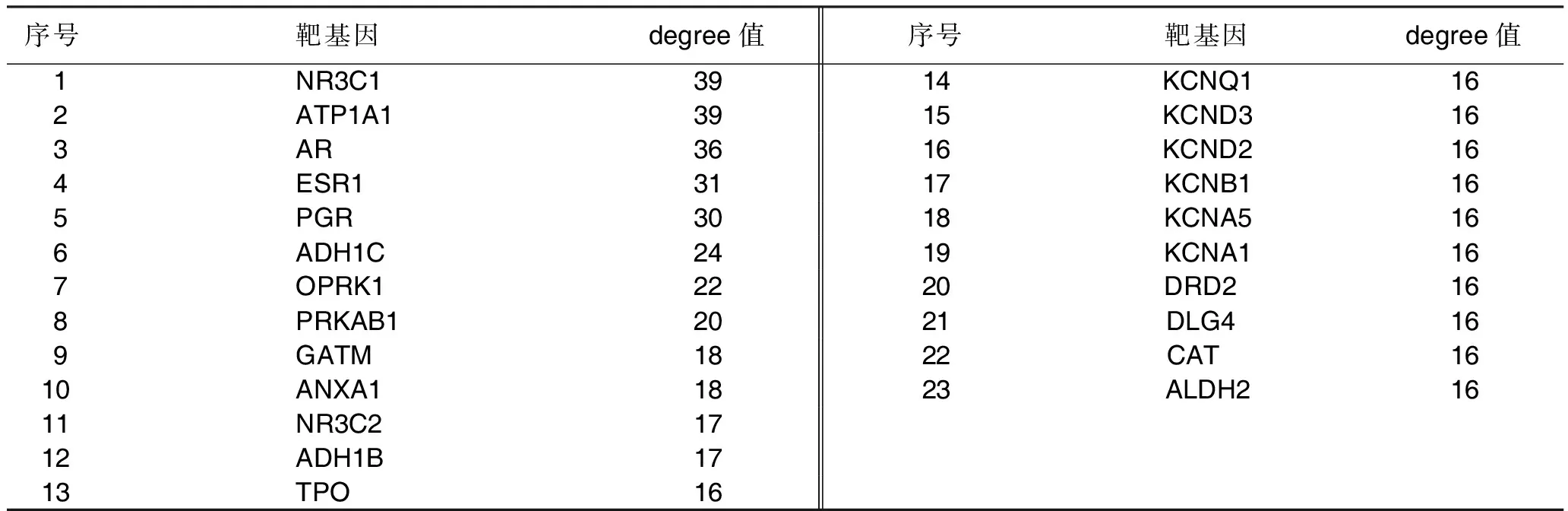
表2 核心基因序列
2.3 PPI网络构建及聚类分析 将获得的341个作用靶点全部导入STRING数据库中,得到靶蛋白之间PPI。为识别该复杂蛋白互作图中的主要功能模块,将PPI导入Cytoscape 3.7.2软件中进一步聚类分析,运用MCODE算法共识别子簇14个并进行可视化,其中K-Core≥4的子簇共6个,其互作网络及相关靶点详见表3、图2。
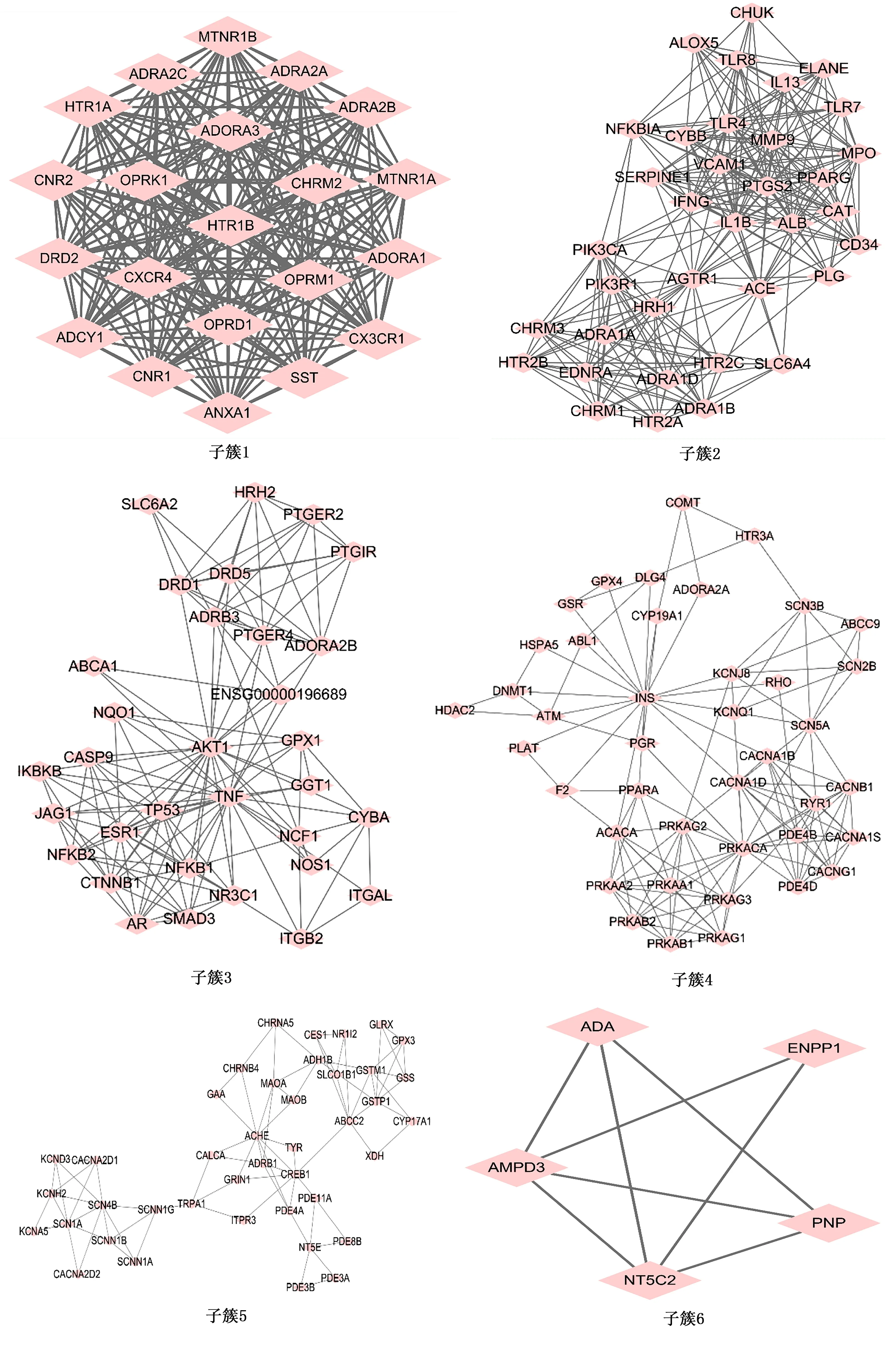
图2 关键子簇的靶点互作图

表3 PPI网络中的关键子簇
2.4 GO生物过程及KEGG通路富集分析 运用R 3.6.2软件对上述6个子簇进行GO及KEGG富集分析。结果显示:子簇1主要参与的生物过程(biological process,BP)为G蛋白偶联受体信号通路、偶联环核苷酸第二信使、腺苷酸环化酶调节G蛋白偶联受体信号通路、腺苷酸环化酶抑制G蛋白偶联受体信号通路等,涉及的信号通路为神经活性配体与受体间的相互作用、cGMP-PKG信号通路、cAMP信号通路;子簇2主要参与的BP为血管收缩、血管直径负性调节、调节血管直径,涉及的信号通路为神经活性配体与受体间的相互作用、钙信号通路、Toll样受体信号通路等;子簇3主要参与的BP为活性氧代谢过程、腺苷酸环化酶激活G蛋白偶联受体信号通路、对脂多糖的反应,涉及的信号通路为流体切应力和动脉粥样硬化、前列腺癌、人类T细胞白血病病毒1感染等;子簇4主要参与的BP为心肌收缩力、离子跨膜转运的调控、心脏传导,涉及的信号通路为长寿调节通路、肥厚型心肌病、胰高血糖素信号通路等;子簇5主要参与的BP为心脏传导、膜电位调节、参与收缩的心肌细胞动作电位等,涉及的信号通路为嘌呤代谢、肾素分泌、酪氨酸代谢等;子簇6主要参与的BP为核苷磷酸分解代谢过程、嘌呤核苷酸分解过程、含嘌呤的化合物分解代谢过程等,涉及的信号通路为嘌呤代谢、烟酸和烟酰胺代谢、嘧啶代谢等。详见表4。
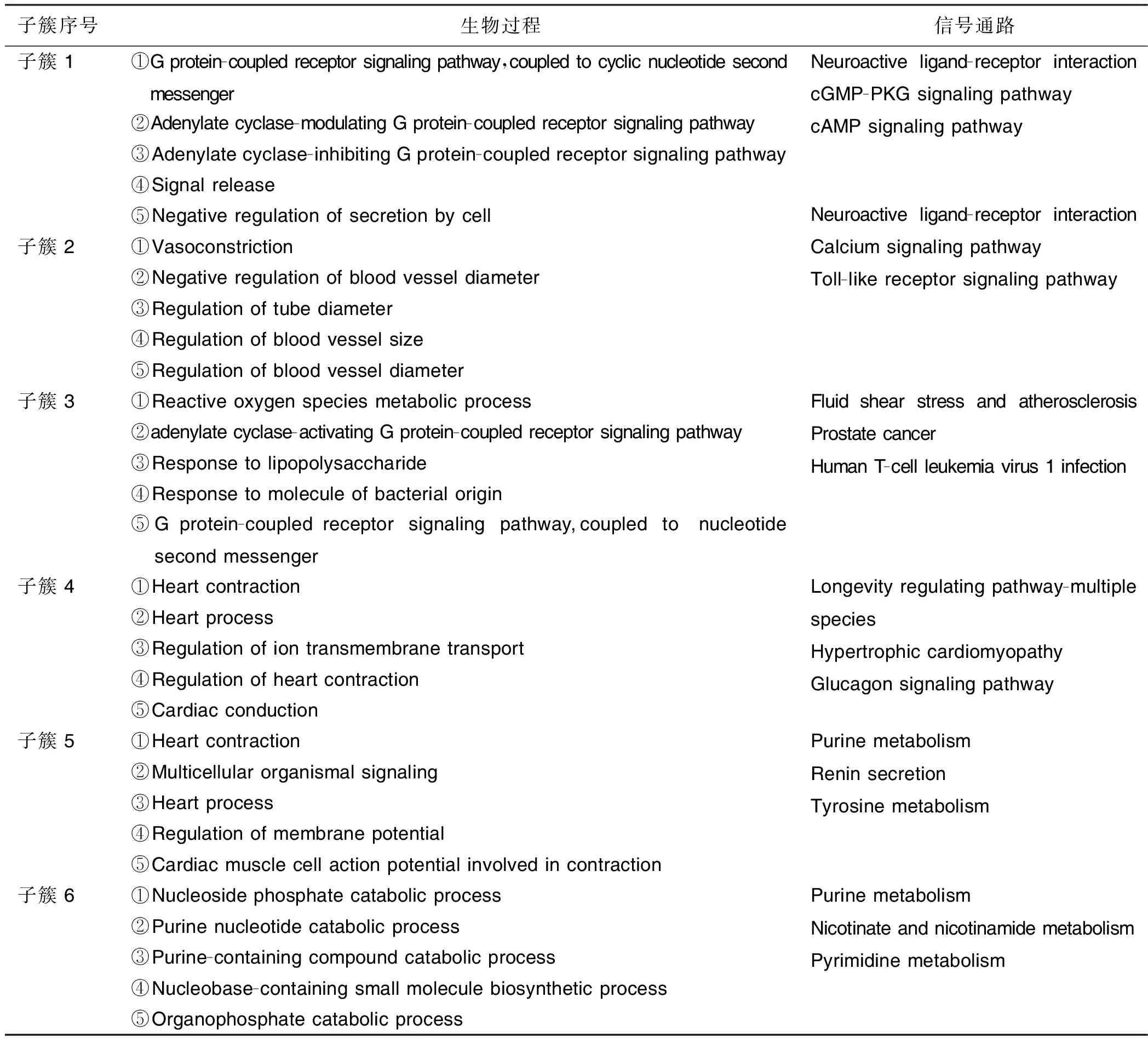
表4 关键子簇GO及KEGG富集结果
2.5 分子对接验证 最终选择5个关键靶点NR3C1、ATP1A1、AR、ESR1、PGR与上述保元汤主要有效成分进行分子对接验证。所有化合物与靶点均具有一定的对接能力。Vina分数总体接近或低于曲美他嗪,且腔体大小基本与曲美他嗪接近,说明保元汤药物成分与靶点结合能力较好,详见表5、表6。化合物与PGR和AR的结合力较好。结合能居前7位的成分与靶点进行可视化分析,选择配体小分子模式为“Spacefill”,受体蛋白模式为“Cartoon”,可见靶点蛋白与活性成分对接结构。详见图3~图9。
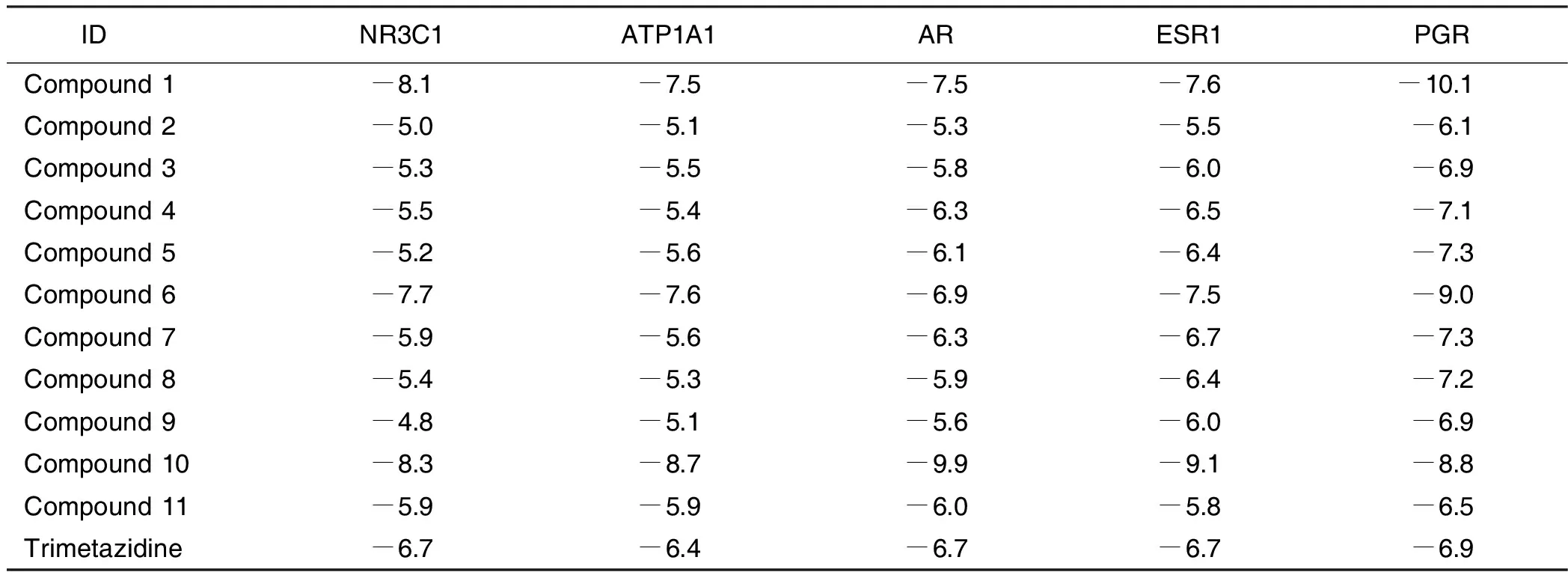
表5 化合物和曲美他嗪与靶点对接的Vina分数
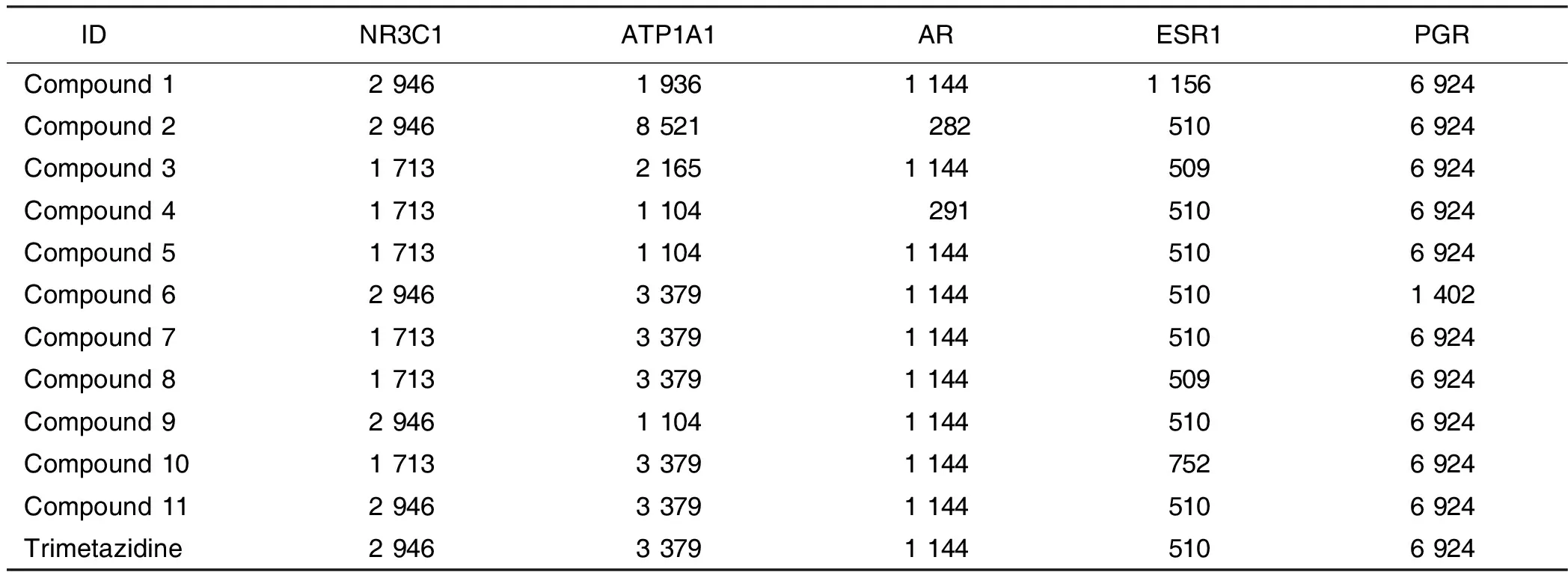
表6 化合物和曲美他嗪与靶点对接的腔体大小
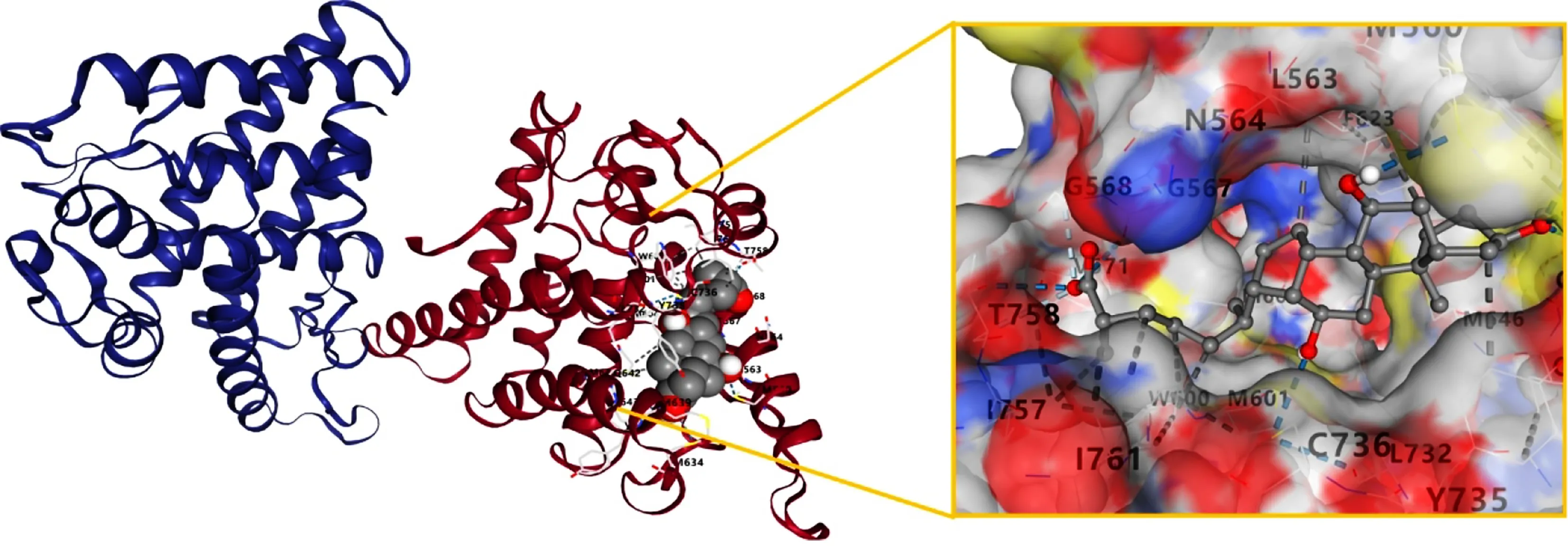
图3 Compound 10与NR3C1对接结果
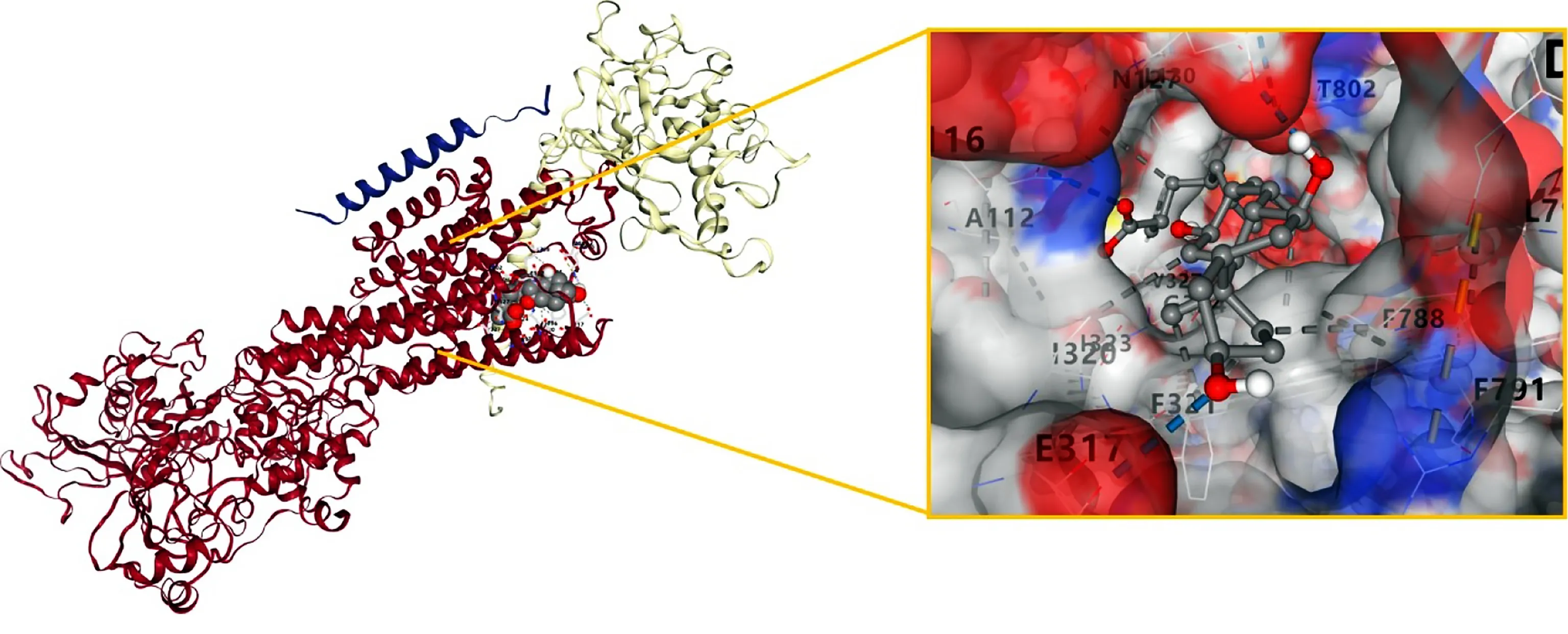
图4 Compound 10与ATP1A1对接结果
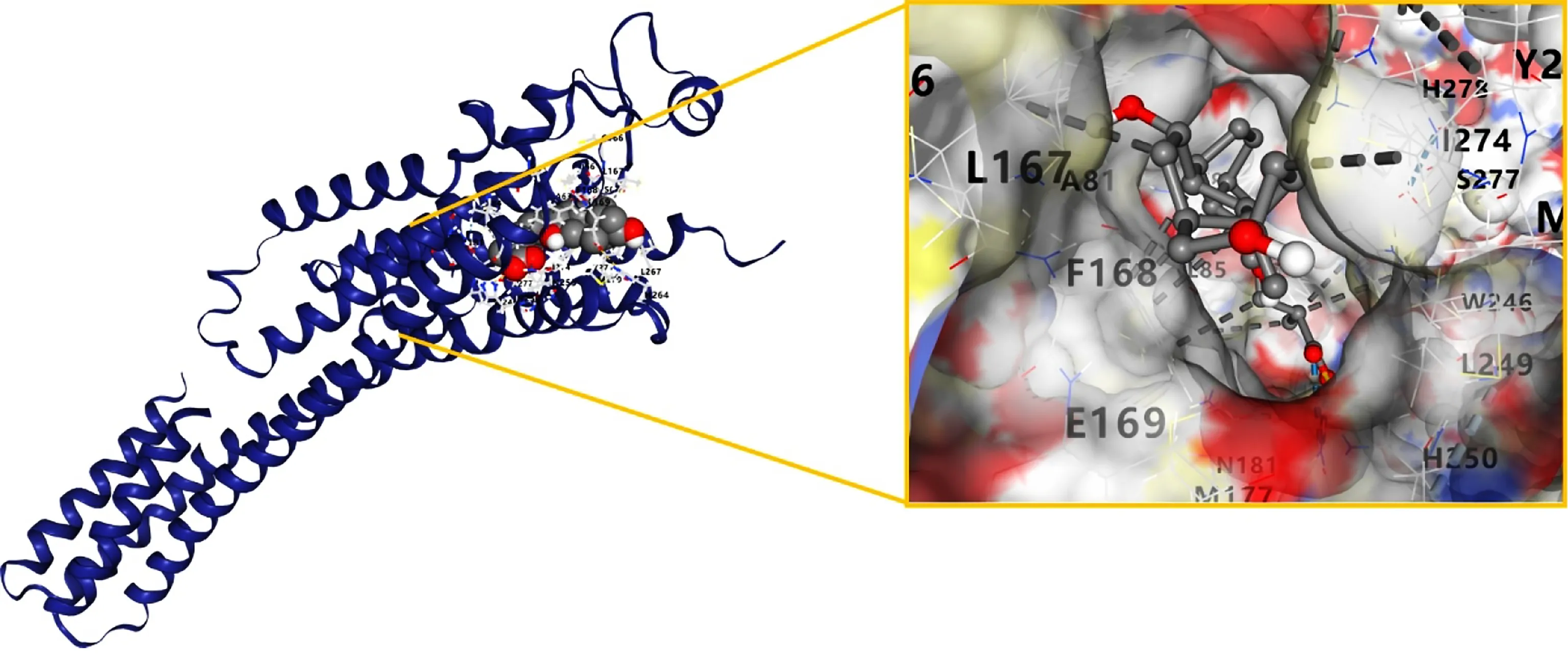
图5 Compound 10与AR对接结果
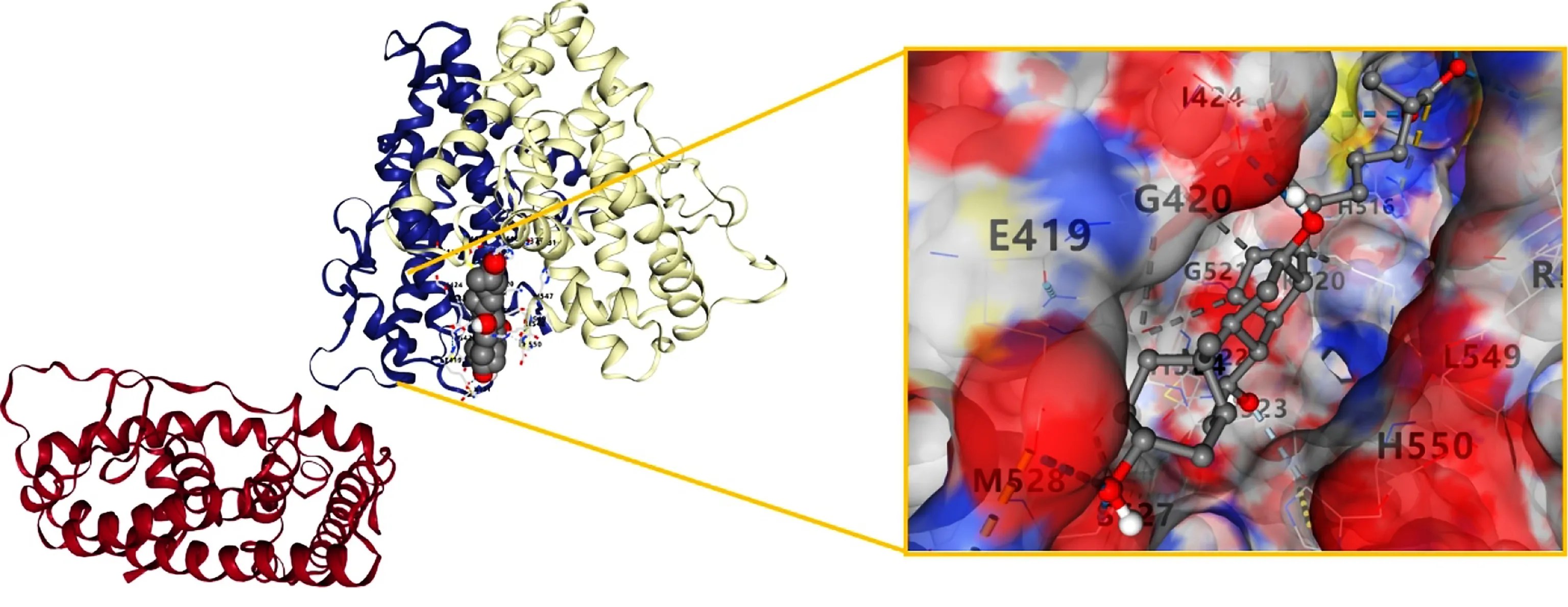
图6 Compound 10与ESR对接结果
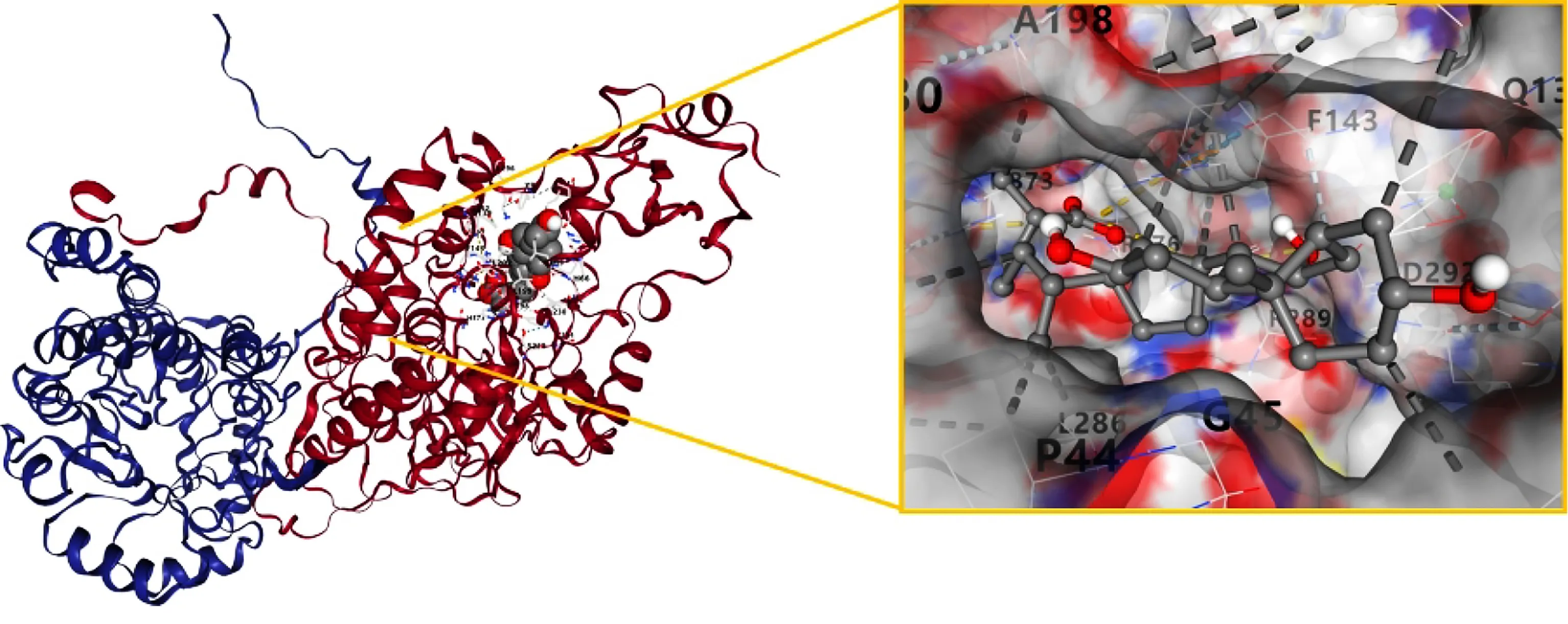
图7 Compound 10与PGR对接结果
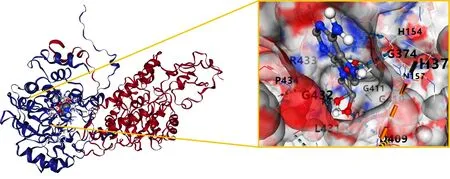
图8 Compound 6与PGR对接结果
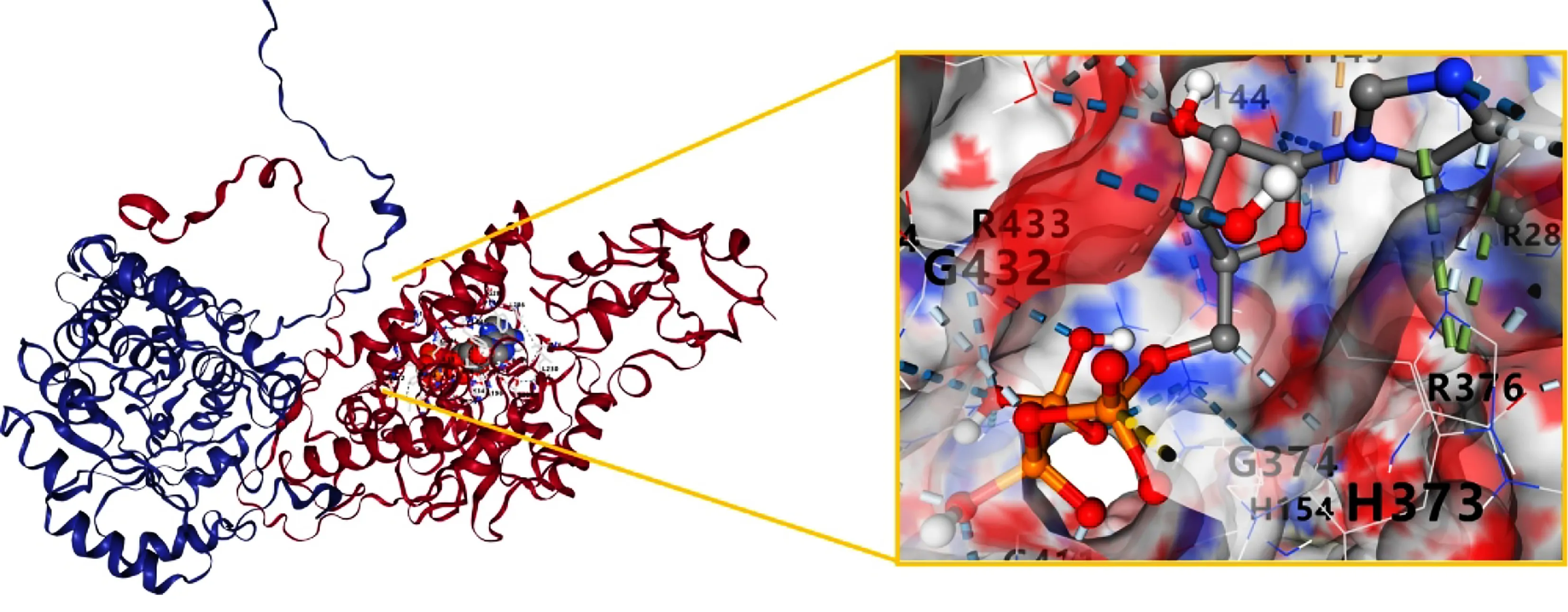
图9 Compound 1与PGR对接结果
3 讨 论
冠心病属中医学“胸痹”范畴,其病机多以本虚标实为主,本虚多以气虚为主,标实多以血瘀为主[10]。保元汤可补虚培元,气旺则血行,运用以补为通之法治疗胸痹。由于保元汤在临床应用及实验研究中表现出的良好治疗作用,目前对相关机制的研究也越来越多。本研究利用网络药理学及分子对接方法进一步探讨保元汤治疗冠心病的作用机制,GO及KEGG富集分析结果显示保元汤通过调控多条通路,作用于线粒体三羧酸循环、氧化磷酸化过程,影响细胞代谢(如能量代谢、活性氧代谢、嘌呤代谢)、细胞凋亡等过程,从而发挥保护心肌的作用。
有氧过程中线粒体通过OXPHOS产生约95%心脏所需的ATP[11],缺氧期间线粒体功能损伤导致能量代谢改变。保元汤治疗冠心病的主要成分包括三磷酸腺苷、腺苷、各类脂肪酸等,主要参与能量稳态调节。包裹在脂质体中的外源性ATP可有效减轻缺血性心肌损伤[12-13]。腺苷不仅参与调节能量代谢,并且具有自己的信号传导功能[14]。外源性腺苷可协助恢复心肌缺血期间存活细胞的ATP水平;腺苷与其腺苷受体结合可改善心肌能量的供需平衡,提高O2的利用率,抑制炎症级联反应,减少活性氧合成,恢复钙稳态,降低氧化应激,预防并减少血管内皮损伤,抑制血小板聚集等[15]。十三酸、十五烷酸、棕榈酸、棕榈油酸均属于脂肪酸类,脂肪酸和葡萄糖是心肌所需供能的主要底物,底物的利用失衡均引起心脏收缩功能受损[16]。其中棕榈油酸属于单链不饱和脂肪酸类,通过降低肝脂肪变性,提高胆固醇流出能力等调节脂质代谢,下调促炎因子白细胞介素-1β、肿瘤坏死因子α表达,抑制炎症反应,从而延缓动脉粥样硬化的发展[17]。
通过GO及KEGG富集分析结果显示,得到不同子簇主要调控cAMP信号通路、cGMP-PKG信号通路、钙信号通路等,参与能量代谢、氧化应激、嘌呤代谢、细胞凋亡等生物过程。子簇1主要调控G蛋白偶联受体及其介导的cAMP、cGMP-PKG信号通路。G蛋白偶联受体(GPCR)是最大的信号膜受体家族,可调节心血管、内分泌等方面的信号转导。G蛋白可激活质膜上的腺苷酸环化酶(sAC),将ATP转化为cAMP。子簇1中ADORA1、DRD2、HTR1A、MTNR1A、ADRA2A、CHRM2、MTNR1B、HTR1B等基因均通过G蛋白信号转导,下调sAC活性,减少cAMP信号通路传导。cAMP信号通路中主要的效应子为蛋白激酶(PKA),可使ETC中复合物磷酸化,造成OXPHOS异常;通过调节线粒体基因转录及表达,调控线粒体的生物发生,最终影响能量代谢[18]。sAC激活及PKA磷酸化均促进Bax向线粒体移位,诱导细胞色素C释放,Caspase-9裂解,引起细胞凋亡[19]。cGMP-PKG信号通路在内源性心脏保护的信号转导中发挥着关键作用,抑制线粒体Ca2+超载,降低复氧过程中Ca2+峰值和Ca2+振荡,抑制膜通透性改变,限制细胞凋亡,同时减少心肌过度收缩[20];减少内皮性一氧化氮合酶(eNOS)解偶联,抑制氧化应激[21]。腺苷可激活cGMP-PKG信号通路,增加一氧化氮生成,抑制线粒体通透性过渡孔(mPTP)开放,从而达到调节能量稳态的目的[22]。
子簇2主要参与血管内皮调节及钙信号传导的生物过程。Ca2+信号转导是线粒体调节细胞代谢的关键因素。线粒体Ca2+摄取可影响胞浆Ca2+瞬变、Ca2+振荡的形成,进而调节心肌收缩功能[23]。线粒体Ca2+可调控丙酮酸脱氢酶复合物(MDH)等三羧酸循环相关酶及线粒体ATP合酶的活性,同时引起胞浆NADH增加,刺激电子传递链传导,增加能量生成[24-26]。若钙稳态失衡,线粒体内膜上钙离子单向转运蛋白(MCU)表达增加,线粒体Ca2+超载,导致ETC失调,电子泄漏增加,同时谷胱甘肽还原酶等抗氧化剂活性抑制,最终活性氧生成过多,引起氧化应激[27];导致mPTP开放,Ca2+外流,造成膜电位和ATP产生破坏,同时细胞色素C等线粒体相关凋亡蛋白释放,诱导细胞凋亡[28]。
子簇3主要参与活性氧的代谢过程。90%的活性氧均由ETC产生[29]。正常情况下,电子传递形成ATP的过程中,仅有不到0.1%的质子泄漏,与强氧化剂氧分子结合形成超氧化物,同时还原型辅酶Ⅱ及其氧化形式(NADPH/NADP+)和谷胱氨肽及其氧化型(GSH/GSSG)等及时清除活性氧,维持体内氧化还原水平[30]。线粒体中mtDNA编码异常,复合物Ⅰ、Ⅲ结构及功能异常,膜电位降低,Ca2+超载及mPTP开放等情况均引起ETC紊乱,OXPHOS异常,氧化还原失衡,活性氧生成增多,从而诱发氧化应激,进一步造成低密度脂蛋白氧化增加、巨噬细胞极化、内皮功能障碍,促进动脉粥样硬化形成[31]。
子簇4、子簇5主要参与调节心肌收缩力、信号传导等生物过程,神经细胞兴奋后产生的动作电位传递到心肌细胞,经过兴奋-收缩耦联,细胞外Ca2+内流,肌浆网终池释放大量Ca2+,最终使肌丝滑行,心肌发生收缩。子簇5、子簇6同时参与嘌呤代谢、氨基酸代谢等过程。腺嘌呤和鸟嘌呤主要参与细胞DNA和RNA合成,氧化后生成次黄嘌呤和黄嘌呤,经过黄嘌呤氧化酶再氧化生成尿酸。缺血/缺氧可介导此过程中生成大量氧自由基和过氧化氢,降低一氧化氮生物利用度,引起氧化应激[32]。
分子对接结果显示,主要化合物与相关靶标对接良好。PGR作为雌激素受体,可能与冠心病的性别差异相关[33];AR参与ATP酶结合,调节能量代谢;NR3C1甲基化状态对急性冠脉综合征预后可能产生不良影响[34];ATP1A1可催化ATP水解,为细胞提供能量;ESR1是冠心病的候选基因[35]。其中化合物三磷酸腺苷、α-三羟基粪甾烷酸与PGR和AR的结合力较好,与阳性对照药曲美他嗪相比,对接效果更佳。相关研究显示,曲美他嗪可降低氧化应激反应,减轻炎症反应,提高冠心病病人心肌能量代谢和心脏功能等[36-37]。本研究结果显示,保元汤对线粒体功能有一定调控功能,也对冠心病病人具有较好的心肌能量供应和保护作用,与相关研究结果[7]一致。
本研究综合网络药理学和分子对接方法,预测保元汤治疗冠心病的活性成分、作用靶点、信号通路。根据得到的结果初步发现保元汤通过多成分、多靶点、多通路方式调控线粒体三羧酸循环、氧化磷酸化过程,进而调节能量代谢、活性氧代谢、细胞凋亡等发挥保护心肌的作用,为进一步明确冠心病发病机制和治疗原则提供新思路。
