TRAIL基因多态性及其血清水平与急性白血病的相关性研究
2021-08-26闫晓华刘瑞磊彭宝相张纪云孙运芳程振娜
闫晓华,刘瑞磊,彭宝相,张纪云 ,孙运芳,程振娜
(1山东医学高等专科学校,山东 临沂 276000;2临沂市人民医院;3临沂市肿瘤医院)
急性白血病(Acute leukemia,AL)分为急性髓细胞白血病(Acute myeloid leukemia,AML)和急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL),是一类死亡率较高的血液系统恶性肿瘤。近年来,其发病率逐渐增高,主要诱发因素有物理、化学、生物及遗传因素等。肿瘤坏死因子相关凋亡诱导配体(Tumor necrosis factor related apoptosis inducing ligand,TRAIL)是肿瘤坏死因子超家族成员,有研究显示其在肿瘤防御方面有一定作用。本研究探讨TRAIL与AL的相关性。
1 资料与方法
1.1一般资料 选取2018年1月—2020年5月本院就诊及住院的85例AL患者为AL组,其中男52例,女33例;年龄18~67岁,平均(41.1±11.9)岁;AML 51例,ALL 34例。纳入标准:均为原发性病变;采样前均未经放疗及化疗。另选同期来本院的体检者80例作为对照组,其中男50例,女30例,年龄18岁~65岁,平均(40.3±12.6)岁。纳入标准:对照组血常规、尿常规、粪便常规、生化检查、影像学检查均为正常。排除标准:两组均排除合并心、脑、肝、肾、肺及免疫性疾病患者。所有研究对象间无血缘关系,两组年龄、性别比等无统计学意义(P>0.05),具可比性。所有参与研究者均经知情同意。
1.2方法
1.2.1标本采集 空腹采血4 ml分置2管中,其中1管为EDTA抗凝血2 ml,-20℃保存;另1管为肝素抗凝血2 ml,离心取血清,-20℃保存。
1.2.2仪器与试剂 PCR试剂、全血基因组DNA提取试剂盒(Tiangen 公司),限制性内切酶(Tas I、Rsa I,Fermentas公司),紫外显像系统(美国Bio-tech公司)。
1.2.3TRAIL基因多态性分析 ①基因组DNA的提取:按照试剂说明提取全血基因组DNA,提取产物通过核酸浓度检测仪和琼脂糖凝胶(EB)电泳验证。②PCR扩增目的基因片段:上游引物5′-AACATCTTCT-GTCTTTATAATC-3′,下游引物5′-AAATAACACGTACTTACTGAAG-3′(上海博亚公司),扩增片段长度为484 bp,扩增产物用2%琼脂糖凝胶电泳验证。③等位基因及基因型分析:基因测序:由于无法获得1588位点的限制性内切酶,因此所有PCR产物进行测序分析(上海生工生物工程有限公司)。PCR-RFLP法分析基因:随机抽取20份PCR产物限制性内切酶分析,并与测序结果比对。1525位点用Rsa I 酶切,1595位点用Tas I 酶切。酶切产物均用2.5%琼脂糖凝胶电泳及紫外显像系统分析。
1.2.4血清sTRAIL水平的检测 所有肝素抗凝标本离心取血清,使用ELISA法检测血清sTRAIL浓度。
2 结果
2.1Hardy-Weinberg平衡定律检验 TRAIL基因1525G/A、1588G/A、1595C/T位点基因型的理论分布频率采用直接计算法,期望值与观察值无统计学差异(χ2=0.449,P=0.799),达到遗传平衡,说明实验所选样本具备群体代表性。
2.2TRAIL基因多态性 1525G/A位点经Rsa I酶切,电泳可见3组电泳条带:AA基因型(286、187、11 bp)、GA基因型(473、286、187、11 bp)和GG基因型(473、11 bp),见图1;1595C/T位点经Tas I酶切,电泳出现3组电泳条带:CC基因型(291、193 bp)、CT基因型(291、193、131、62 bp)和TT基因型(291、131、62 bp),见图2。所选样本酶切结果基因序列与测序结果一致,且均与GenBank序列一致。

A 图1 Rsa I酶切产物电泳图(1525位点)注:1.2000 bp DNA Marker;2.PCR产物;3.AA 基因型;4.PCR产物;5.2000 bp DNA Marker
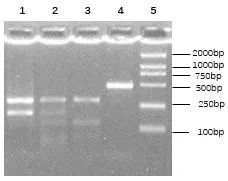
B 图2 Tas I酶切产物电泳图(1595位点)注:1.CC基因型;2.CT基因型;3.TT基因型; 4.GA基因型;5.GG基因型
2.3两组基因型与等位基因的比较 AL组TRAIL基因第五外显子3'-UTR区1525(G/A)、1588(G/A)、1595(C/T)三位点基因型和等位基因一致,即三位点突变情况完全一致;两组TRAIL基因第五外显子3’-UTR区1525(G/A)、1588(G/A)、1595(C/T)基因型及等位基因分布不一致。见表1。

表1 两组基因型与等位基因比较[ n(%)]
2.4两组血清sTRAIL水平比较 对照组血清sTRAIL水平高于AL组;按照白血病细胞系列归属分为AML组和ALL组,AML组血清sTRAIL水平与ALL组比较无统计学意义。见表2。
表2 两组血清sTRAIL水平比较
3 讨论
本研究显示AL组与对照组TRAIL基因的1525G/A、1588G/A及1595C/T基因型分布不同,AL组1525G、1588G及1595C等位基因频率明显高于对照组,提示TRAIL基因第五外显子3'-UTR区携带1525G/1588G/1595C罹患AL的风险增高。AL组血清sTRAIL浓度明显高于对照组,AML组与ALL组之间比较无统计学差异。本研究结果与笔者以前对TRAIL在实体瘤中表达结果不一致[1-3],提示实体瘤与血液恶性肿瘤发生发展的差异性。本研究AL患者血清TRAIL表达量升高,推测可能由于AL患者TRAIL死亡受体(DR)表达降低或其他诱导凋亡途径受阻,导致白血病细胞发生免疫逃逸。有研究认为,虽然TRAIL mRNA在AML原始细胞中表达上调,但由于自身表面死亡受体低表达,使AML原始细胞均对TRAIL抵抗,进而限制了TRAIL的诱导凋亡效应[4]。Cappellini A等[5]通过检测AML白血病细胞TRAIL受体发现,死亡受体DR4、DR5表达较少,而诱骗受体DcR-1、DcR-2高表达,因此引起肿瘤细胞发生免疫逃逸。目前,有关TRAIL与AL的研究多涉及如何结合药物提高TRAIL死亡受体的表达,诱导白血病细胞凋亡,起到治疗AL的目的[6-7]。
综上所述,通过本实验发现了TRAIL存在AL的易感基因及AL患者血清sTRAIL水平上升,对AL的早期预防及靶向治疗研究提供了实验依据。
