HBeAg阴性慢性乙型肝炎患者B、C基因型 HBV S蛋白变异比较
2021-09-10章晓鹰顾超马道亮张珏高月求孙学华
章晓鹰 顾超 马道亮 张珏 高月求 孙学华
对于乙型肝炎病毒(hepatitis B virus,HBV)基因型与疾病转归预后的关联,不同的研究结论存在着较大的分歧,有的研究认为病毒C基因型患者更容易转变为肝硬化与肝癌,而有些研究则认为与基因型无关;报道提示B基因型对干扰素γ(interferon-γ,IFN-γ)的疗效优于C 基因型,且C基因型也更容易发生多重核苷类药物的耐药变异[1-6]。但也有报道持不同观点,认为不同基因型的耐药变异无明显区别[7-8]。
目前基因型与病毒变异关联研究多集中于HBV P区,少有研究报道不同病毒基因型的HBV S蛋白变异差异,然而HBsAg不仅仅有B细胞表位,还含有辅助T细胞(T-helper,Th)表位与细胞毒T淋巴细胞(cytotoxic T lymphocytes,CTL)表位[9-10],均在宿主相关的免疫功能刺激中发挥重要作用[11]。但鉴于HBeAg血清学转换过程中所产生的免疫压力是S蛋白变异的主要原因[12],并且,S蛋白的变异与病程和年龄有关[13]。因此,本研究重点分析比较了HBeAg阴性慢性乙型肝炎患者HBV基因型的S蛋白变异差异,探讨病毒基因型对疾病临床转归可能的影响。
资料与方法
一、一般资料
2019年1月至2019年10月上海中医药大学附属曙光医院东院肝炎科门诊或住院的HBeAg阴性慢性乙型肝炎患者 99例,其中B基因型50例,C基因型49例。纳入标准参照2015版《慢性乙型肝炎防治指南》[14],所有患者均HBV DNA测序成功。HBeAg阴性慢性乙肝定义为HBeAg阴性、抗-HBe阳性,丙氨酸氨基转氨酶(alanine aminotransferase,ALT)持续或反复异常,HBV DNA>2E3 IU/mL[14]。以上患者均有抗病毒药物治疗史。所有患者排除合并其他病毒感染。
二、仪器、试剂、检测方法
1.DNA提取试剂盒为QIAmp Blood Mini Kit(QIAGEN,德国);DNA第一次纯化试剂盒为QIAGEN MinElute Purification Kit(QIAGEN,德国);DNA第二次纯化试剂盒为BigDye Xterminator Purification Kit(Applied Biosystems,美国)。之江生物乙型肝炎分型试剂盒。
2.实验仪器:DNA测序仪(ABI 3500 Dx Genetic Analyzer,美国,Applied Biosystems);实时荧光定量PCR仪(美国,ABI7500)
3.HBV DNA提取:取患者血浆(EDTA抗凝管)200 μL用于核酸提取,按说明书进行操作。根据Genbank HBV DNA(HBV genotype B DNA,complete genome,LC036263;HBV genotype C DNA,complete genome,AB644286)的S基因序列,利用Primer Primer 5.0设计引物,引物序列见表1。二者均涵盖整个S蛋白。
4.PCR与S蛋白变异检测:HBV DNA提取后分别进行PCR第一轮扩增与纯化,纯化后的PCR产物进行PCR第二轮扩增与纯化,加入10 μL去离子甲酰胺(Hi-Di Formamide),短时振荡溶解DNA,95℃变性5 min,迅速置于冰上或4℃冷却4 min,ABI 3500 Dx基因分析仪上样测序。
第一轮PCR反应条件:5×PCR buffer 10 μL(含Tris 盐酸 buffer,dNTP、Mg+)、Taq酶3 μL、10 μmol/L的上游引物与下游引物各1 μL(终浓度为200 nmol/L),DNA模板10 μL,补充蒸馏水25 μL至总体积为50 μL。
第一轮扩增条件:50 ℃尿嘧啶糖苷酶反应防污染 2 min;经95 ℃ 预变性15 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共40个循环;最后,72 ℃终延伸 7 min。

表1 HBV NDA S区引物序列
第二轮PCR反应条件:BigDye 2 μL、BigDye Sequencing buffer 3 μL、F或R引物0.5 μL(终浓度为250 nmol/L),纯化的DNA模板1 μL,补充蒸馏水13.5 μL至总体积为20 μL。
第二轮扩增条件:96 ℃ 预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,共25个循环。
5.数据分析:利用Primer Primer 5.0将核苷酸序列翻译成氨基酸序列,BLAST分析软件进行氨基酸序列比对。
6.HBV基因分型:采用上海之江生物乙型肝炎分型试剂盒,严格按操作说明书进行。
三、统计学方法
利用SPSS 16.0统计软件。计数资料以例数(百分数)表示,组间比较采用χ2检验;非正态分布计量资料以M(P25,P75)表示,两组间比较采用非参数Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
结 果
一、HBeAg阴性慢性乙型肝炎B、C基因型患者一般资料
HBeAg阴性慢性乙型肝炎B、C基因型患者的年龄、性别、HBV DNA载量差异均无统计学意义(均P>0.05)。见表1。
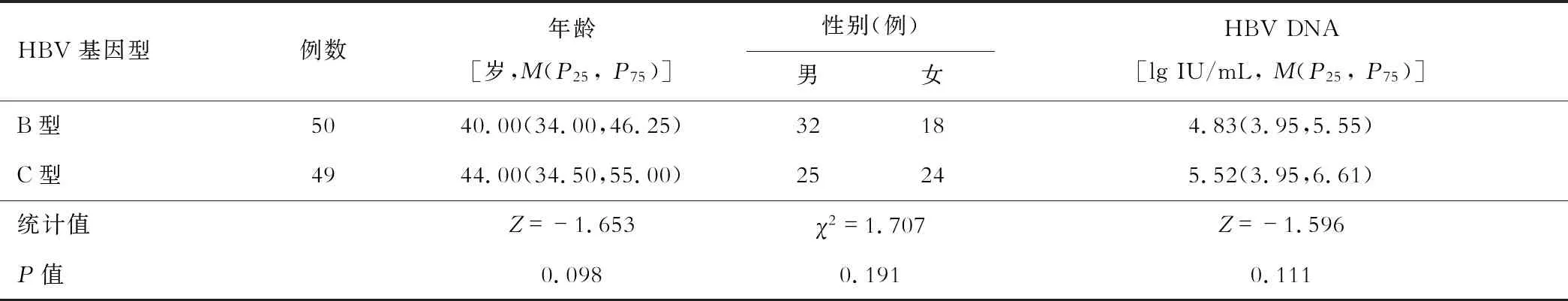
表1 HBeAg阴性慢性乙型肝炎B、C基因型患者一般资料比较
二、HBeAg阴性慢性乙型肝炎B、C基因型HBV S蛋白及各区域变异比较
HBeAg阴性慢性乙型肝炎C基因型S蛋白总体变异率高于B基因型,无论MHR还是MHR外以及MHR的”a”决定簇与MHR外的CTL+Th免疫表位、非免疫表位,C基因型变异率均高于B基因型,差异均有统计学意义(均P<0.05)。见表2。

表2 HBeAg阴性慢性乙型肝炎B、C基因型HBV S蛋白及各区域变异比较[例(%)]
三、HBeAg阴性慢性乙型肝炎B、C基因型HBV S蛋白变异热点及差异
HBeAg阴性慢性乙型肝炎组患者B、C基因型HBV S蛋白总变异点分别为56点、106点,平均每人变异1.12(56/50例)和2.16(106/49例)。
MHR与“a”决定簇热点变异位点为T/I126/T/S/A,B基因型与C 基因型分别为3例和13例,两基因型之间差异有统计学意义(χ2=7.699,P=0.006)。MHR外非免疫表位热点变异位点为I68T/N,B基因型与C 基因型分别为3例和14例,两基因型间差异有统计学意义(χ2=8.865,P=0.003)。MHR外免疫表位热点变异位点为L21S,B基因型与C 基因型分别为6例和3例,连续校准统计学显示这两基因型之间差异均无统计学意义(P>0.05)。此外,MHR外非免疫表位的P203R/L位点,B基因型与C 基因型分别0例与6例,连续校准显示两基因型差异有统计学意义(χ2=4.544,P=0.033)。
讨 论
S蛋白的aa100-169 为主要亲水区(major hydrophilic region,MHR),为B淋巴细胞表位,“a”决定簇(aa124-147)即位于此区域,而aa1-99与aa170-226被称为MHR外,在MHR 外分别有CTL表位、Th表位与非免疫表位[10,15]。
先前研究提示,经过HBeAg至抗-HBe血清学转换,MHR外变异率明显升高,并在HBeAg阴性慢性乙型肝炎患者达到峰值,认为S蛋白变异尤其是MHR外变异不仅为免疫压力所致的后果,可能也是乙型肝炎复发的原因[16]。从本次观察数据来看,HBeAg阴性慢性乙型肝炎C基因型患者S蛋白总体变异率明显高于B基因型,且无论是MHR还是MHR外,以及MHR外的免疫表位与非免疫表位,或MHR内的“a”决定簇,B与C基因型之间的变异差异均有统计学意义,提示C基因型更容易产生S蛋白变异,增加的变异位点为随机性分布,因此,两基因型之间的变异差异在S蛋白的各个区域相当。
由于C基因型不仅仅在B淋巴细胞表位,在CTL+Th免疫表位还有非免疫表位均出现变异增加,从理论而言MHR变异直接影响HBsAg抗原性,导致与抗体结合能力下降,这与疫苗等免疫逃逸有关,并可使体液免疫功能下降[9];同样MHR外区域由于含有CTL表位与Th表位,其变异也可影响患者的细胞免疫功能[10]。有研究提示S蛋白变异可通过诱导表面抗原合成的不平衡并使其在胞浆内质网中停留,从而引起内质网应急反应,这可能与肝脏疾病的严重性有关[17,18]。因此推测细胞免疫与体液免疫功能的影响或者内质网应急的产生等可能是不同基因型与疾病进展预后关联的原因。
MHR 热点变异位点为I/T126T/S/,此位点被称之为“免疫逃逸”位点[9],通常B基因型为苏氨酸,C基因型为异亮氨酸。有研究称,大部分C基因型患者为异亮氨酸,约有10%为苏氨酸,但从异亮氨酸转变为苏氨酸时伴随着胸腺嘧啶(ATT)转变为胞嘧啶(ACT),这可以导致HBsAg 抗原性改变[12]。本研究结果显示,该位点C基因型变异均高于B基因型,但此变异究竟是不是属于亚型变异,以及此位点变异是否影响了HBsAg 抗原性,可能还要进一步观察。除此之外,MHR外非免疫表位与免疫表位热点变异位点分别为I68T/N与L21S,I68T/N在B、C基因型之间差异均有统计学意义,C基因型高于B基因型,而L21S则两基因型之间无任何差异。但是,I68T/N变异及其变异的临床意义尚未见报道,因此,本观察仅能提示C基因型更容易出现I68T/N位点变异。有研究报道,有两个C端区位点P203Q与S210R与肝癌显著相关[18],但此次观察中,HBeAg阴性慢性乙型肝炎基因型之间P203R/L变异差异有统计学意义,C基因型高于B基因型,而S210R/I则未显示该位点变异与基因型有关。
另外,由于S蛋白与P区的反转录酶区(RT区)重叠,两者之间变异可互为影响,但是,可产生核苷类药物耐药的变异位点多见于rtM204I/sW196*,rtA181T/sW172* 与rtV191I/sW182*这3个P与S区相关联位点[19]。本实验仅在HBeAg阴性慢性乙型肝炎C基因型患者中检测出3例rtM204I/sW196*变异位点,患者均有拉米夫啶治疗史,但无法确定S区与P区谁先变异。
总之,HBeAg阴性慢性乙型肝炎患者C基因型较B 基因型更容易产生S 蛋白变异,并可能由此通过HBsAg免疫原性改变、或通过影响细胞免疫与体液免疫功能的或通过内质网应急等机制左右疾病的预后转归。
