微波辅助高压法提取金针菇黄酮的纯化及活性测定
2021-08-25王广慧于德涵
王广慧,于德涵,黎 莉
(绥化学院 食品与制药工程学院, 黑龙江 绥化 152061)
金针菇(FLammuLinaveLutipes(Fr.)Sing)是我们非常熟悉的一种食用菌。它具有很高的营养价值,富含蛋白质、多糖、黄酮、维生素、矿物质及各种人体所必需的氨基酸等营养成分,尤其是金针菇中的黄酮类物质具有抗菌、抗氧化、抗肿瘤等作用,可开发为保健食品或动物饲料添加剂[1-5]。大孔树脂常被用于黄酮类物质的纯化,因其具有良好的稳定性、强吸附性以及可以在温和的条件下重复使用等优点[6],但目前关于将大孔树脂用作金针菇黄酮纯化介质的研究甚少。本项目组曾在文献[7]中探讨了微波辅助高压法制备金针菇黄酮的最佳条件,笔者将在此基础上继续研究以H103型大孔树脂作为金针菇黄酮纯化介质的工艺条件,并通过抑菌和抗氧化实验检测金针菇黄酮的活性,以期为其未来的开发利用提供参考。
1 材料与仪器
1.1 材料
H103型大孔吸附树脂(天津浩聚树脂科技有限公司);实验所用各种化学试剂都为国产分析纯,购自常州市旭宏化工有限公司;金针菇及所用四种细菌(金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌)均为绥化学院发酵实验室培养所得。
1.2 仪器
752型分光光度计(上海舜宇恒平科学仪器有限公司); YM50FG型立式高压蒸汽灭菌器(山东博科生物产业有限公司);WBFY-205型微波化学反应器(上海一科仪器有限公司)。
2 方法
2.1 金针菇黄酮的提取
金针菇黄酮的提取方法及含量测定方法(硝酸铝-亚硝酸钠法)均按照文献[7]中所述步骤进行操作。
2.2 H103型大孔树脂的预处理
用95%乙醇先将H103型大孔树脂浸泡24 h,然后反复清洗至液体澄清,再用蒸馏水洗至乙醇味消失。再先后用5%(g·g-1)的盐酸溶液和4%(g·g-1)的氢氧化钠溶液各浸泡处理4 h,每次处理后都要用蒸馏水清洗至pH值为中性。
吸附率和解析率的计算公式:


式中:C1代表上样液中金针菇黄酮的质量浓度(mg·mL-1),C2代表吸附饱和时流出液中金针菇黄酮的质量浓度,C3代表洗脱液中金针菇黄酮的质量浓度;V1代表吸附饱和时所消耗的上样液体积(mL),V2代表吸附饱和时流出的液体体积,V3代表洗脱液体积。
2.3 纯化工艺优化[8]
将预处理过的H103型大孔树脂装入普通玻璃层析柱(16 mm×240 mm)中,树脂高度为12 cm,分别考察样品液的pH、浓度、上样速度对金针菇黄酮吸附率的影响,以及乙醇的浓度、洗脱速度、用量对黄酮解析率的影响。每组实验重复三次。
2.4 纯化效果检测
按优化后的最佳条件用H103型大孔树脂对金针菇黄酮进行纯化,然后通过计算金针菇黄酮在解析液及样品液烘干后物质中所占的比例,求得纯化倍数。
2.5 抗菌活性测定[9~12]
采用抑菌圈法进行检测。
2.5.1 菌悬液的制备 在37℃下,用气浴恒温振荡器以120 r·min-1的转速连续培养四种活化菌株,并持续关注菌悬液在波长600 nm处的OD值,当其为0.1时停止培养。菌体浓度此时约为1×106~1×107CFU( Colony-Forming Units,菌落形成单位) ·mL-1。
2.5.2 抑菌活性检测实验 将四种菌悬液各0.1 mL涂布在LB固体培养基平板上,插入牛津杯(内径6 mm),取0.1 mL质量浓度分别为0.10、0.25、0.40、0.55、0.70 mg·mL-1的金针菇黄酮样品液加入杯中,37℃培养24 h后测量抑菌圈直径。
2.6 抗氧化实验[11~14]
2.6.1 清除ABTS·能力检测 在250 mL容量瓶中加入40.00 mg的ABTS、10 mL的蒸馏水以及8.00 mL的过硫酸钾(浓度为1.0 mg·mL-1),室温避光反应16 h。加蒸馏水32 mL,以无水乙醇定容后静置10 h备用。
取浓度分别为0.1、0.15、0.2、0.25、0.3 mg·mL-1的金针菇黄酮溶液各0.5 mL,加入1.5 mL 95%乙醇及2 mL配制好的ABTS溶液,反应30 min后测其在734 nm处的光吸收值A1。
将ABTS溶液换成蒸馏水,重复上述步骤,所测吸光值为A2。保留ABTS溶液,以95%乙醇代替黄酮提取物,重复上述步骤,所测吸光值为A0。同时以VC为对照。
2.6.2 清除DPPH·能力检测 取3.5 mL 的DPPH溶液(浓度为1.0×10-4mol·L-1,以无水乙醇配制而成)与0.5 mL无水乙醇混合,闭光反应30 min,测其在517 nm处的吸光值 A0;
以0.5 mL纯化后的金针菇黄酮提取液替代0.5 mL无水乙醇,按上述方法进行操作,测得其吸光值 A1;
以3.5 mL 无水乙醇替代DPPH溶液,同样加入0.5 mL黄酮提取液,测得其吸光值 A2。所用对照品为VC。
2.6.3 清除OH·能力检测 在2.0 mL FeSO4溶液(1.8 mmoI·mL-1)中各加入1.0 mL浓度分别为0.1、0.15、0.2、0.25、0.3 mg·mL-1的金针菇黄酮溶液,再加入1.8 mmol·mL-1的水杨酸-乙醇溶液1.5 mL和0.3%(g·mL-1)的过氧化氢溶液 0.1 mL,混合均匀。在37 ℃水浴中静置30 min后测其在510 nm下的吸光值A1。
将过氧化氢溶液换成蒸馏水,重复上述实验操作,所测吸光度值为A2。
将黄酮提取液换成蒸馏水,重复上述实验操作,所测吸光度值为A0。所用对照品依然为VC。
3 结果与分析
3.1 线性回归方程
实验所得测定黄酮含量的线性回归方程为y = 10.273x + 0.001 2, R2= 0.9959。其中y为吸光值,x为黄酮浓度(mg·mL-1)。
3.2 纯化工艺优化结果
3.2.1 上样液pH对吸附率的影响 用5%盐酸溶液和2%的氢氧化钠溶液将浓度为1.45 mg·mL-1的金针菇黄酮样品液pH调为3、4、5、6、7,以0.3 mL·min-1的流速进行吸附,然后计算饱和吸附率(饱和吸附点的判定标准为:流出液中黄酮浓度约为其上样液中初始浓度的十分之一)。
实验结果见图1。

图1 上样液pH对吸附率的影响
由图1可知,在所测定的样品液pH范围内,当样品液的pH大于5.0时,黄酮吸附率随样品液pH的增大而减小;当样品液的pH在3.0~5.0范围内,吸附率呈上升趋势;当样品液pH为5.0时,黄酮吸附率达到最大值。分析原因可能是金针菇黄酮属于多羟基酚类化合物,只有在适当酸性条件下能够形成氢键,利于大孔吸附树脂吸附。当酸性太强时,黄酮分子内的氧原子易质子化,不易被吸附;而在碱性条件下黄酮分子中形成酚氧负离子,影响氢键的形成,也会导致吸附率下降。
3.2.2 上样液浓度对吸附率的影响 考察时所设定的吸附条件是:pH5的样品液,吸附速率为0.3 mL·min-1,样品液浓度分别为0.85、1.15、1.45、1.75、2.05 mg·mL-1。实验结果见图2。

图2 上样液浓度对吸附率的影响
由图2可知,在所测量的上样液浓度范围内,在0.85~1.45 mg·mL-1时,吸附率逐渐增加;当浓度大于1.45 mg·mL-1时,吸附率随浓度的增加而降低。因此选择1.45 mg·mL-1作为上样液最适浓度。
3.2.3 上样液流速对吸附率的影响 考察时所设定的吸附条件是:样品液pH为5,上样液浓度为1.45 mg·mL-1,流速分别为0.30、0.55、0.80、1.05、1.30 mL·min-1。
实验结果见图3。

图3 上样液流速对吸附率的影响
由图3可知,吸附率随上样液流速逐渐加快而逐渐降低,说明较慢的上样速度利于树脂对黄酮的吸附,但流速太慢势必会使吸附时间过长,综合考虑工作效率问题,选择0.30 mL·min-1为最佳流速。
3.2.4 洗脱剂浓度对解析率的影响 先用蒸馏水反复冲洗已饱和吸附有金针菇黄酮的H103型大孔吸附树脂层析柱,直至流出的液体无色,再用60 mL乙醇以2 mL·min-1的速率进行洗脱,乙醇浓度分别设为50%、60%、70%、80%、90%。计算黄酮解析率。
实验结果见图4。
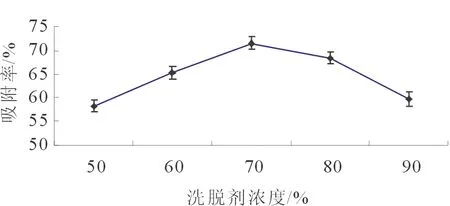
图4 洗脱剂浓度对解析率的影响
由图4可知,最佳洗脱剂浓度为70%,乙醇体积分数过大或过小都不利于黄酮的洗脱。
3.2.5 洗脱速率对解析率的影响 设定洗脱速率分别为2、2.5、3、3.5、4 mL·min-1,洗脱剂乙醇的浓度采用70%,乙醇用量采用60 mL,在此条件下分析黄酮解析率。
实验结果见图5。

图5 洗脱速率对解析率的影响
由图5可知,洗脱速率越小越有利于洗脱,原因可能是速率小时可使乙醇与树脂充分接触,宜于黄酮的洗脱,但速率过小会过分延长洗脱时间,因此综合考虑工作效率,选择2 mL·min-1为最佳洗脱速率。
3.2.6 洗脱剂用量对解析率的影响 用70%乙醇以2 mL·min-1进行洗脱,洗脱剂用量分别设为10、20、30、40、50、60 mL,计算黄酮解析率。
实验结果见图6。

图6 洗脱剂用量对解析率的影响
由图6可知, 60 mL 70%乙醇可将大孔树脂上吸附的金针菇黄酮彻底洗脱。
3.3 纯化效果检测
检测结果见表1。
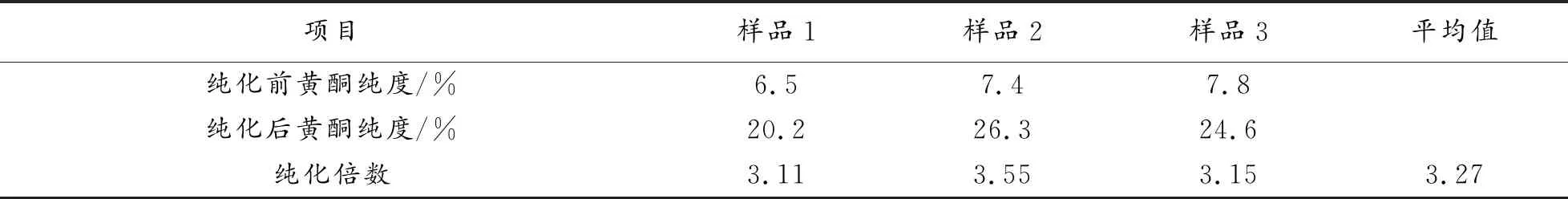
表1 纯化效果检测结果
由此表可见,纯化倍数可达3.27倍,说明用此工艺纯化金针菇黄酮能取得比较好的效果。
3.4 抗菌实验
测量3组平行实验所获得的抑菌圈直径,取平均值后所得数据见表2。
表2中数据表明,在所测量的0.10~0.70 mg·mL-1浓度范围内,金针菇黄酮对四种菌株都表现出一定程度的抗菌活性,且总体趋势是黄酮浓度越大,抗菌活性越强,其对四个菌种抗性顺序为:大肠杆菌最强,沙门氏菌次之,金黄色葡萄球菌第三,枯草芽孢杆菌最弱。

表2 黄酮浓度对菌种抑菌圈直径的影响
3.5 抗氧化实验
3.5.1 清除ABTS·能力检测结果 金针菇黄酮和VC清除ABTS·能力比较见图7。
图7表明,金针菇黄酮对ABTS·有一定的清除能力,并且黄酮浓度越高,对ABTS·的清除能力也越强,但与相同浓度的VC相比,金针菇黄酮对ABTS·的清除率低于VC。
3.5.2 清除DPPH·能力检测结果 金针菇黄酮和VC清除DPPH·能力比较见图8。

图8 黄酮和Vc清除DPPH·能力比较
图8表明,金针菇黄酮和VC对DPPH·都有清除能力,并且随着浓度升高,二者对 DPPH·的清除作用也越强,但相对于VC,金针菇黄酮的清除率上升幅度不是很明显,且在相同浓度时,金针菇黄酮清除DPPH·的能力弱于VC。
3.5.3 清除OH·能力检测结果 金针菇黄酮和VC清除OH·能力比较见图9。
图9表明,金针菇黄酮和VC对OH·都具有一定的清除能力,并且二者对OH·的清除能力与浓度呈正相关,但在相同浓度下,金针菇黄酮对OH·的清除能力不如VC强。

图9 黄酮和Vc清除OH·能力比较
4 结 论
对利用微波辅助高压法制取的金针菇黄酮的生物活性进行了检测,并对H103型大孔树脂作为金针菇黄酮纯化介质的最适条件进行了探讨。由研究结果可以做出以下结论:
(1)H103型大孔树脂纯化金针菇黄酮的效果很好,其最优纯化条件为:采用浓度为1.45 mg·mL-1、pH值为5的上样液以0.30 mL·min-1的流速进行吸附;采用体积分数为70%的乙醇60 mL以2 mL·min-1的流速进行洗脱。按此纯化条件得到的黄酮纯度可达到纯化前的3.27倍。
(2)抗菌性研究显示:金针菇黄酮对四种实验用菌都有一定的抑制作用,抑菌效果与金针菇黄酮浓度呈正相关。对四种菌株抗菌能力由强至弱顺序为: 大肠杆菌,沙门氏菌,金黄色葡萄球菌,枯草芽孢杆菌。
(3)氧化抗性实验结果表明:金针菇黄酮具有一定的氧化抗性,能有效消除ABTS·、DPPH·和OH·,并且随着浓度的增加,其抗氧化活性也在增强,但低于同浓度下的VC。
由此可见,利用微波辅助高压法提取金针菇黄酮不但可获得较高的提取率[13],且能保留黄酮的抑菌性和抗氧化性;使用H103型大孔树脂能对金针菇黄酮起到很好的纯化作用。这为金针菇黄酮产品的开发提供了依据。
