甲氨蝶呤治疗银屑病的药物基因组学文献分析*
2021-08-25王兰杨继章张小宁毛乾泰艾超
王兰,杨继章,张小宁,毛乾泰,艾超
(1.清华大学附属北京清华长庚医院/清华大学临床医学院药学部,北京 102218;2.清华大学医学院,北京 100084)
银屑病是一种具有强烈遗传倾向的炎症性增生性皮肤病,尽管银屑病主要局限于皮肤,但高达25%的患者患有相关的关节病[1],且该症与患者心血管死亡风险增加相关[2]。研究证实,银屑病可对受影响者造成严重的社会心理疾病,并与其生活质量受损有关[3]。虽然目前有多种治疗银屑病的有效方法,但患者个体对治疗的反应却表现不一[4]。患者属性(如年龄、性别、身高、体质量、种族、饮食和基因组学)对于精准诊断、治疗和监测至关重要,该领域的研究将有助于通过识别患者属性来提高药物治疗的成功率,降低医疗的成本[5]。然而,相较于指数级增长的银屑病遗传易感性研究,有关该症治疗药物的遗传学研究则非常有限[6]。
甲氨蝶呤(methotrexate,MTX)于1971年由美国食品药品管理局(FDA)正式批准用于银屑病的治疗,因其疗效肯定,目前仍是公认的大多数中、重度银屑病患者的一线治疗药物,但MTX可引起相关不良反应,包括轻度和(或)自限性不良反应(如口腔溃疡、胃肠不耐受)和严重的不良反应(如骨髓抑制、肝毒性和肺毒性)[7],约30%患者因肝毒性而中止MTX治疗[8],且临床目前无法对MTX治疗银屑病的疗效和不良反应进行准确预测,使该药的应用受到一定的限制。药物基因组学可解释人群中20%~95%的药物治疗差异,关于MTX治疗银屑病的相关研究强调了药物基因组学在MTX药物治疗方案疗效和安全性个体差异分析中的意义[9]。现有研究多局限于与MTX代谢相关的基因功能性单核苷酸多态性(single nucleotide polymorphism,SNP)小规模回顾性病例对照研究,且以国外研究居多。由于种族差异,现有研究的结论不一定适用于我国患者,因而有必要加快发展我国银屑病治疗药物的基因组学研究。基于此,本研究采用文献计量学中引文分析的方法[10],以中国知网、万方、维普和Web of ScienceTM核心合集数据库等中英文数据库为资料来源,汇总2000—2019年发表的MTX治疗银屑病安全性及有效性的药物基因组学相关文献[11-44],就该领域研究概况、发展动向等进行回顾性分析,以期为MTX的个体化应用及相关药物基因组学研究提供参考。
1 资料与方法
检索Web of ScienceTM核心合集数据库(包括SCI-EXPANDED、SSCI、A&HCL、CPCI-S、CPCI-SSH、ESCI、CCR-EXPANDED及IC)获得外文文献数据,检索中国知网、万方、维普数据库获得中文文献数据。文献纳入标准:Web of ScienceTM核心合集数据库采用主题词检索,检索词为“TS=(Psoriasis AND methotrexate AND pharmacogenomics)or TS=(Psoriasis AND methotrexate AND gene)”;中国知网、万方、维普数据库采用高级检索,检索词为主题=“银屑病”并且“甲氨蝶呤”并且“基因”或主题=“银屑病”并且“甲氨蝶呤”并且“药物基因组学”。检索时限均为2000年1月1日—2019年12月31日。不同数据库相同题目、作者及动物实验、细胞学实验的研究文献除外。本研究分别从文献出版年份、文献类型、发表机构、国家及地区分布、被引情况等方面利用WPS 2019版对数据资料统计分析。采用双人文献检索、录入、统计,以确保数据客观准确。
2 结果
2.1文献发表年份及发表机构 2000—2019年,Web of ScienceTM核心数据库收录有关MTX治疗银屑病的药物基因组学研究外文文献共76篇,其中有效文献31篇,年均发表1.55篇;同期中文文献44篇,其中有效文献8篇,年均发表0.40篇,见表1。
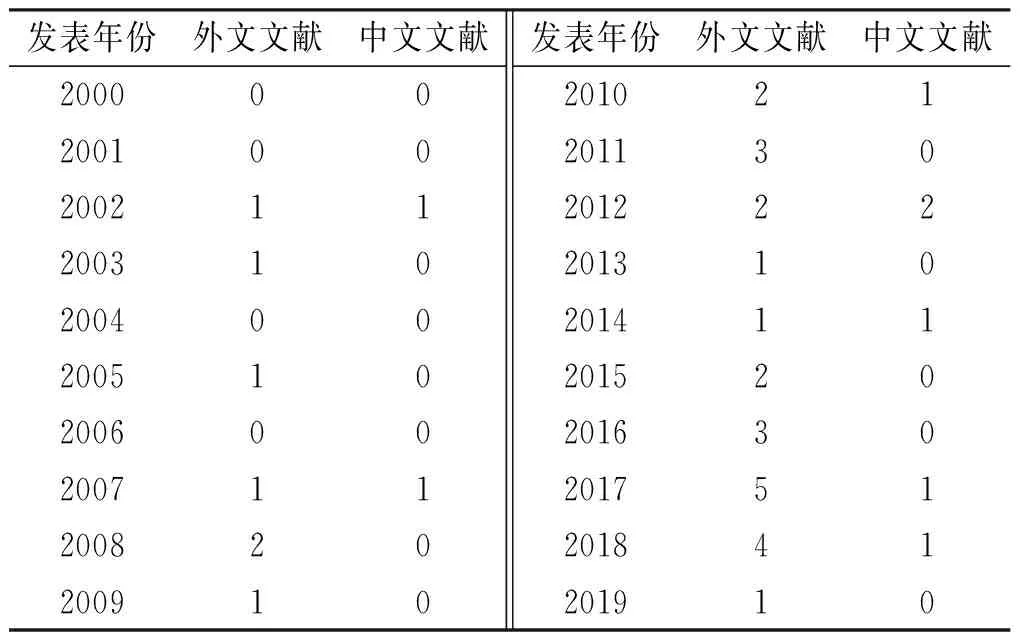
表1 2000—2019年MTX治疗银屑病的药物基因组学相关文献的发表数量
外文文献的发布机构以高校科研院所为主,共发表16篇,发表量占比51.61%;其次是医院、公司,分别发表11,4篇。中文文献的发布机构主要为高校科研院所和医院,各发表4篇,未见以公司为发表机构的中文文献发表。
2.2文献发表国家及文献引用频率 对纳入文献总被引频次排序前10位的高被引频次文献的发表国家及其被引频次、发表量等参数进行了统计,结果见表2。2000—2019年,全球共有26个国家于Web of ScienceTM核心数据库收录的相关期刊上发表研究文献,英国、美国、加拿大和中国针对MTX治疗银屑病药物基因组学的研究最为活跃,英国、爱尔兰、加拿大学者发表文献的总被引频次位列前三,中国学者于Web of ScienceTM核心数据库共发表3篇,分别来自河北师范大学(2017年)、复旦大学附属华山医院(2017,2019年),总被引8次,年均被引2.50次。
总被引频次排名前10位的文献中,4篇[15,17-18,20]刊登在British Journal of Dermatology,2篇[15,17-18,20]刊登在Journal of Investigative Dermatology;英国学者发表研究的文献有5篇[12-13,15,17,20],其中研究学者Warren RB发表的文献有3篇[10,17,20],总被引频次共147次,见表3(影响因子数据来自第2018版Journal Citation Reports)。同期国内中文研究文献较少,其所在数据库虽有进行被引频次的相关统计,但由于研究者及其研究机构的地域局限性,文献的国际影响力有限。

表2 2000—2019年Web of ScienceTM核心数据库中高被引频次文献的发表国家、被引频次及发表量统计(前10位)

表3 2000—2019年Web of ScienceTM核心数据库中高被引频次文献的基本信息(前10位)
2.3研究方向与内容 Web of ScienceTM核心数据库的有效文献中,主要涉及磷酸三腺苷(ATP)结合盒转运蛋白编码基因(ABCC1、ABCG2),腺苷受体A2a(adenosine receptor A2A,ADORA2a)编码基因,溶质载体家族19A1(solute carrier family 19a1,SLC19A1)编码基因,亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)编码基因,胸苷酸合成酶(thymidylate synthase,TYMS)编码基因,5-氨基咪唑-4-甲酰胺核糖核苷酸甲酰转移酶/次黄嘌呤核苷酸环水解酶(5-aminoimidazole-4-formamide ribonucleotide formyltransferase / hypoxanthine nucleotide cyclase,ATIC)编码基因,二氢叶酸还原酶(dihydrofolate reductase,DHFR)编码基因、肌动蛋白α2基因编码基因(ACTA2),Ⅰ型胶原α1链基因(type I collagen α 1-strand gene,COL1A1)编码基因,细胞色素P450家族2亚家族(cytochrome P450family 2 subfamily,CYP2E1)编码基因等。国内数据的有效文献中,除MTHFR基因多态性与MTX药物疗效与毒副反应的相关性研究外,鲜少涉及其他相关位点。MTX药物基因组学涉及基因多态性的相关信息统计见表4,SLC19A1、ADORA2a、MTHFR、ATIC等基因多态性影响MTX治疗银屑病安全性,ABCC1、TYMS等基因多态性可影响MTX治疗银屑病安全性和有效性。

表4 MTX药物基因组学研究中涉及的基因信息
3 讨论
3.1MTX治疗银屑病安全性及有效性的相关药物基因学
3.1.1SLC19A1与SLC19A1基因 SLC19A1是一种药物转运体,转运叶酸和MTX等进入细胞。有研究指出,编码SLC19A1的SLC19A1基因rs1051266位点多态性可能影响MTX的安全性,但对MTX的有效性并无明显影响:携带SLC19A1基因rs1051266位点A突变等位基因对MTX应答者和无应答者之间的MTX有效性没有显著影响;但在发生ADR患者中,rs1051266位点A等位基因更为常见(P<0.025);且在因不可耐受MTX毒副作用而停止药物治疗的患者中,SLC19A1基因rs1051266位点A等位基因的频率显著高于G等位基因(P<0.048)。此外该研究指出,任何SLC19A1变异基因型(GA或AA型)与停止使用MTX治疗银屑病的风险增加显著相关[OR=2.40,95%CI(1.21,4.75),P=0.01][13]。这与随后的银屑病、类风湿关节炎的相关研究结果一致,即编码RFC-1药物转运体的SLC19A1基因rs1051266位点GA型或AA型与患者MTX毒性增加的风险相关[OR=3.574,95%CI(1.10,12.00);P=0.039)[28-29]。由此可见,与GG型患者比较,SLC19A1基因rs1051266位点GA、AA型银屑病患者使用MTX治疗可能存在更高的毒性发生风险。
3.1.2ATP结合盒转运体与ABCC1、ABCG2基因 ATP结合盒转运体为一种跨膜蛋白,可利用ATP水解能跨膜转运以及RNA翻译、DNA修复等非转运过程将MTX主动转运出细胞外,从而影响MTX的安全性和有效性,相关基因主要包括ABCC1和ABCG2。ABCC1基因rs246240位点AA型、rs3784862位点AA型、rs2238476位点GG型(均为突变型)可能增加患者MTX毒性,其中ABCC1基因rs2238476位点GG型为独立关联因素(P=0.01)[12]。此外,ABCC1基因rs35592位点TT型、rs2238476位点GG型、rs28364006位点GG型及ABCG2基因rs13120400位点CC型、rs17731538位点GG型(均为突变型)患者可能具有更高的MTX有效率,其中ABCC1基因rs35592位点TT型与ABCG2基因rs17731538位点GG型与患者MTX临床疗效的提升最为相关[OR=2.20,95%CI(1.20,4.10),P=0.005;OR=2.10,95%CI(1.10,3.70),P=0.01][12]。
3.1.3TYMS与TYMS基因 TYMS是细胞增殖必需的关键酶,也是MTX作用靶点[13,22]。TYMS基因5′端非编码序列的启动子增强子区域具有基因多态性,该区域包含多个串联重复序列,其中rs34743033位点可能影响MTX治疗银屑病的安全性和有效性,rs34489327位点可能影响MTX治疗银屑病的安全性。在未行叶酸补充时,服用MTX发生总不良事件(P=0.002 5)、肝毒性(P=0.015)或有症状的药物副作用(P=0.0034)的患者中,TYMS基因rs34743033位点G等位基因的频率明显更高,其中GG型患者发生不良事件的风险较野生型患者增加13倍[13];此外,在对MTX无应答的银屑病患者中,TYMS基因rs34743033位点G突变等位基因的频率显著高于对MTX应答的患者(P=0.029),且该型患者MTX治疗反应率约为野生型患者的25%,1个或2个G等位基因的存在可显著降低MTX的有效性[OR=2.96,95%CI(0.96,9.06),P=0.048)。已有研究发现,TYMS基因rs34743033位点GG型患者的MTX毒性增加的风险可能与如下因素有关:该基因纯合突变可导致TYMS转录和(或)翻译活性增强以及TYMS酶底物(5,10-亚甲基四氢叶酸)耗竭,而5,10-亚甲基四氢叶酸是同型半胱氨酸甲基化的必需底物[22,30],由于代谢底物的缺乏导致同型半胱氨酸代谢异常,引起分子水平氧化还原失衡和氧化应激,造成蛋白质、核酸和碳水化合物氧化和脂质过氧化加剧,最终诱发细胞毒性[31-32]。
3.1.4ATIC与ATIC基因 ATIC为5-氨基咪唑-4-甲酰胺核糖核苷酸甲酰转移酶/次黄嘌呤核苷酸环水解酶,是嘌呤从头合成环节中的最后1个酶,也是MTX作用的靶点[33]。MTX可通过抑制ATIC酶活性导致腺苷积聚进而发挥强力的抗炎作用,但同时由于抑制ATIC酶活性导致嘌呤合成减少而产生毒性反应,可见该酶与MTX的疗效和毒性密切相关[9]。从理论上而言,ATIC基因rs2372536位点多态性可影响MTX的安全性及有效性,但现有文献指出,该位点突变等位基因G的频率在银屑病患者MTX应答者与无应答者差异无统计学意义(P>0.05)[13,17],但在停止MTX治疗的银屑病患者中,G等位基因的频率却显著增加(P=0.038),且GG型患者由于不良反应而停止MTX治疗方案的风险较CC型患者增加了1.6倍[13]。这提示ATIC基因rs2372536位点多态性可能只与MTX的安全性有关。
3.1.5ADORA2a与ADORA2a基因 腺苷受体包括2种亚型,ADORA1和ADORA2a,均为MTX的作用靶点[34]。虽有研究证实,ADORA2a基因多态性与MTX广泛的抗炎作用有关,即MTX治疗银屑的关键抗炎机制是腺苷释放,而这种释放过程可能是由腺苷途径中的腺苷受体所介导的[35];但也有研究指出,银屑病患者中ADORA2a基因多态性与MTX的有效性无关,携带ADORA2a基因rs5760410位点G突变等位基因的患者使用MTX可能会增加毒副反应发生的风险(P=0.03)[12],与携带ADORA2a基因rs5760410位点G等位基因应用MTX治疗类风湿关节炎患者发生ADR的风险增加有关的结论一致[OR=3.07,95%CI(1.20,8.70),P=0.01][34]。
3.1.6MTHFR与MTHFR基因 MTHFR是参与叶酸代谢途径的重要调节酶,可催化5,10-亚甲基四氢叶酸转化为5-甲基四氢叶酸,为同型半胱氨酸甲基化形成甲硫氨酸提供底物,目前MTHFR基因rs1801133、rs1801131位点是MTX治疗银屑病安全性和有效性的药物基因组学研究热点之一[13,15,17,20-22]。有研究指出,银屑病患者MTHFR基因rs1801133、rs1801131各基因型频率在使用MTX应答者和无应答者之间均无显著性差异,且rs1801133位点T突变等位基因与MTX安全性及有效性均无关[13],这一研究结论与MTX治疗类风湿关节炎的MTHFR基因多态性研究的结论基本一致[36-37]。但也有部分研究得出了不同的结论,如皮肖冰等[36]研究发现,rs1801133位点多态性与银屑病发病和MTX疗效无关,但与MTX治疗后的不良反应(如肝毒性等)有关,其中T突变等位基因是不良反应发生的高危因素;也有研究表明,携带MTHFR基因rs1801131位点C突变等位基因的银屑病患者和未补充叶酸的双杂合型患者(MTHFR基因rs1801133位点CT型或MTHFR基因rs1801131位点AC型)更易发生肝毒性[13,37]。MTHFR基因多态性与MTX安全性与有效性相关性研究的结论矛盾可能归因于样本量小、研究缺乏效力等[37-38]。此外,结论矛盾还可能与以下2种理论机制相关:一方面,MTHFR基因多态性导致甲硫氨酸生成障碍,导致患者使用MTX后出现肝肾毒性等严重的毒性反应;另一方面,MTHFR基因rs1801133位点CT、TT型可导致MTHFR酶活性下降40%~70%[39-40],而MTHFR酶活性的降低可导致5,10-亚甲基四氢叶酸积蓄,可一定程度地中和MTX代谢消耗的四氢叶酸,从而防止不良反应的发生[41]。
3.1.7DHFR与DHFR基因 DHFR为叶酸代谢途径中的另一代谢酶,其可将二氢叶酸转化为四氢叶酸,是细胞增殖必需的关键酶[42]。迄今唯一一项专为银屑病关节炎患者进行的药物基因组学研究发现,携带DHFR基因rs1232027位点A突变等位基因可提高MTX的有效性(P=0.02)[24],可作为相关药物基因组学研究的候选基因。
3.1.8其他药物基因位点 纤维化相关基因ACTA2和COL1A1导致的瞬时细胞因子上调机制是典型创伤预后反应的特征[43]。体外研究表明[19],在MTX处理的3D打印肝组织中(包括原代肝细胞、肝星状细胞和内皮细胞),ACTA2和COL1A1表达较未经MTX处理的空白组增加了2~3倍,且ACTA2和COL1A1表达的变化进一步证实了MTX治疗后体内纤维化反应的进展和药物作用的浓度依赖性。为临床研究MTX治疗银屑病导致肝纤维化的毒副反应提供新的基因研究位点。
CYP负责多种内源性和外源性物质,尤其是药物的代谢[26,44]。在关于MTX治疗银屑病的有限相关研究报道中,发现CYP在银屑病患者的皮肤组织水平表达显著增加,经过MTX治疗后,银屑病临床症状显著改善[19];同时研究发现,应用MTX治疗银屑病的患者中,CYP2E1水平下降与PASI评分改善之间存在显著相关性[26]。由此可见,CYP家族基因多态性可能影响化疗药物代谢过程、药物治疗反应甚至耐药性[26,46-47]。
3.2MTX药物基因组学研究思路启发 MTX在银屑病药物治疗方案中的作用机制尚不完全清楚,依据国际遗传药理学数据库(PharmGkb)药物代谢通路及本文纳入的药物基因组学研究文献,总结MTX体内代谢途径及作用机制可能为干扰叶酸和腺苷代谢途径进而发挥药理学效应,即MTX通过SLC19A1转运至细胞内,由ATP结合盒转运体(ABCC1、ABCG2)主动转运至细胞外。转运至细胞内的MTX可通过聚谷氨酸合成酶(FPGS)、谷氨酰胺水解酶(GGH)的作用生成多聚谷氨酸甲氨蝶呤(MTX-PG),MTX-PG的积蓄程度可决定MTX的治疗效果和毒性,并可通过叶酸代谢的细胞内效应影响MTHFR酶活性;影响MTX-PG积蓄程度的关键酶包括TYMS、DHFR、ATIC等,其中对MTX抑制强度最大的关键酶为ATIC酶,通过抑制由ATIC酶介导的将5-氨基咪唑-4-甲酰胺核苷酸(AICAR)转化为甲酰化AICAR,后者可促进有效的抗炎介质腺苷释放,导致腺苷积聚进而发挥强力抗炎效应[22]。由此可见,任何影响MTX吸收、分布、代谢、排泄的药物代谢酶、转运蛋白、受体或靶点等都可能影响药物治疗有效性及毒性。本文所纳入的MTX相关蛋白组学研究思路均基于药物代谢相关酶、转运体及其编码基因。笔者参考纳入文献绘制了MTX代谢主要酶、底物与药物基因位点关系图,见图1。由图1可见,编码MTX转运的转运体(如RCF-1、ABCC1、ABCG2)以及代谢或受体酶、作用靶点(如MTHFR、TYMS、DHFR、ATIC等)编码基因的多态性具有可能改变MTX的药动学和药效学特征,从而影响MTX的安全性和有效性,可一定程度解释MTX治疗银屑病的个体差异。
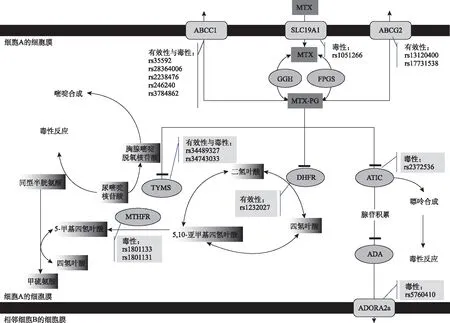
图1 MTX代谢相关的主要酶、底物与基因多态性
4 结束语
本文系统研究了近20年全球MTX治疗银屑病的药物基因组学相关文献。MTX转运体编码基因(SLC19A1、ABCC1、ABCG2),代谢酶编码基因(MTHFR、DHFR),药物靶点(TYMS、ATIC、ADORA2a)等基因的多态性可能影响MTX的安全性和有效性,一定程度解释MTX治疗银屑病的个体差异。我国科研人员可积极关注高产作者研究成果,以本文研究为参考,加强学术交流与合作,借助基因检测技术开展我国人群深入研究,提供临床MTX个体化治疗决策方案。
