纳米修复剂钝化重金属机理研究进展
2021-08-19鲁文超王志博步延鹏邓凯丽薛园园李露露彭李超邹雪艳
鲁文超,王志博,步延鹏,梁 静,韩 露, 邓凯丽,薛园园,李露露,彭李超,邹雪艳
(1. 河南大学 纳米材料工程研究中心, 河南 开封 475004; 2. 河南大学 化学化工学院, 河南 开封 475004; 3. 河南大学 药学院, 河南 开封 475004; 4. 河南大学 棉花生物学国家重点实验室, 河南 开封 475004)
随着人类城市化和工业化的发展,重金属污染问题(如Pb、Cd、As、Ni、Cr、Hg等)愈发凸显[1]。我国每年因污水灌溉造成的耕地重金属污染将近360万公顷[2];每年因土壤重金属污染而造成的粮食产量减少超过1 000万吨[3]。重金属污染不仅对人类赖以生存的土壤和水源安全造成严重威胁,更是人体生命健康的巨大隐患[4-5]。重金属可经过各种途径被人体摄入,进而在人体内不断富集,最终与蛋白质、核酸、生物酶等生命物质相结合并使其失去生理活性,对人体生长发育造成严重影响[6-12]。
不同的重金属元素对人体所造成的危害不同。有研究表明,Pb可造成人体神经退化、智力低下和发育迟缓[13-15];通过食物链进入人体的Cd主要富集在人体的肝脏和肾脏中,可造成肾衰竭、肺气肿和骨骼畸形等[16-17]。As通过食物摄取或皮肤吸收等方式进入人体对皮肤和肺脏产生严重的毒害作用[18-19]。
因此,重金属污染问题亟需解决,纳米材料作为21世纪的最具发展前景的新兴材料,近年来受到科研工作者的广泛关注[20-23]。因其具有比表面积大、活性位点多、修复能力强等优点在重金属污染修复中展现出十分优异的性能。常见的纳米修复剂包括纳米二氧化硅[24-25]、纳米二氧化锰[26-28]、碳纳米管[29-31]、羟基磷灰石[32-34]、纳米氧化铝[35-37]等。
ZOU等[38]通过简单的水热反应制备了多种形貌的纳米羟基磷灰石,并进一步探究了其对Pb2+、Cd2+、Cu2+、Co2+、Ni2+、Zn2+和Hg2+七种重金属离子的吸附性能,研究发现所制备的纳米羟基磷灰石对上述七种离子均具有较高的吸附率,其中对Hg2+的吸附效果尤为显著,吸附率可达99.90%。张治军等[39]以硅酸钠为原料,制备出了粒径在25~35 nm之间的二氧化硅纳米粒子,并进一步在其表面引入羧基、巯基、氨基等反应性官能团,通过大田试验表明,上述功能化的纳米二氧化硅可高效钝化土壤中的Pb、Cd、As等重金属元素,修复后土壤中重金属有效态含量降低90%以上。钝化是通过向污染土壤中加入修复剂,从而降低土壤中重金属的水溶性、扩散性和生物有效性,使重金属转化为低毒性或移动性较低的化学形态,以减轻重金属对生态和环境的危害。STAFIEJ等[40]等以碳纳米管(CNTs)作为吸附剂,探究了其对几种二价重金属离子(Cu2+、Co2+、Cd2+、Zn2+、Mn2+、Pb2+)的吸附特性,结果表明在pH = 9的条件下,CNTs对几种离子的吸附效果顺序为:Cu2+> Pb2+> Co2+> Zn2+> Mn2+。ZHU等[41]通过热分解法将含有零价铁内核的Fe2O3负载在石墨烯上,合成了饱和磁化强度为96.3 emu·g-1的强磁响应性的石墨烯复合物(MGNCs),并研究了其对水溶液中Cr(Ⅵ)的吸附行为,结果表明MGNCs对Cr(Ⅵ)的吸附动力学符合拟二级模型,可以快速、高效分离Cr(Ⅵ)。
尽管目前有关各类纳米材料在重金属修复方面的应用报道层出不穷,但是涉及到纳米材料对重金属元素的修复机理主要包括:物理吸附作用[42-44]、化学吸附作用[45-47]、离子交换作用[48-50]、氧化还原作用[51-52]等。通过对纳米材料修复去除重金属机理进行详细的归纳总结,将会对纳米材料在重金属修复方面的应用具有重要意义。本文将这些纳米材料按照基本成分划分为纳米金属单质、纳米金属氧化物、纳米非金属单质、纳米非金属氧化物以及纳米聚合物,分别对其钝化修复重金属的内在机理进行了归纳总结。
1 纳米金属单质

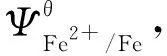
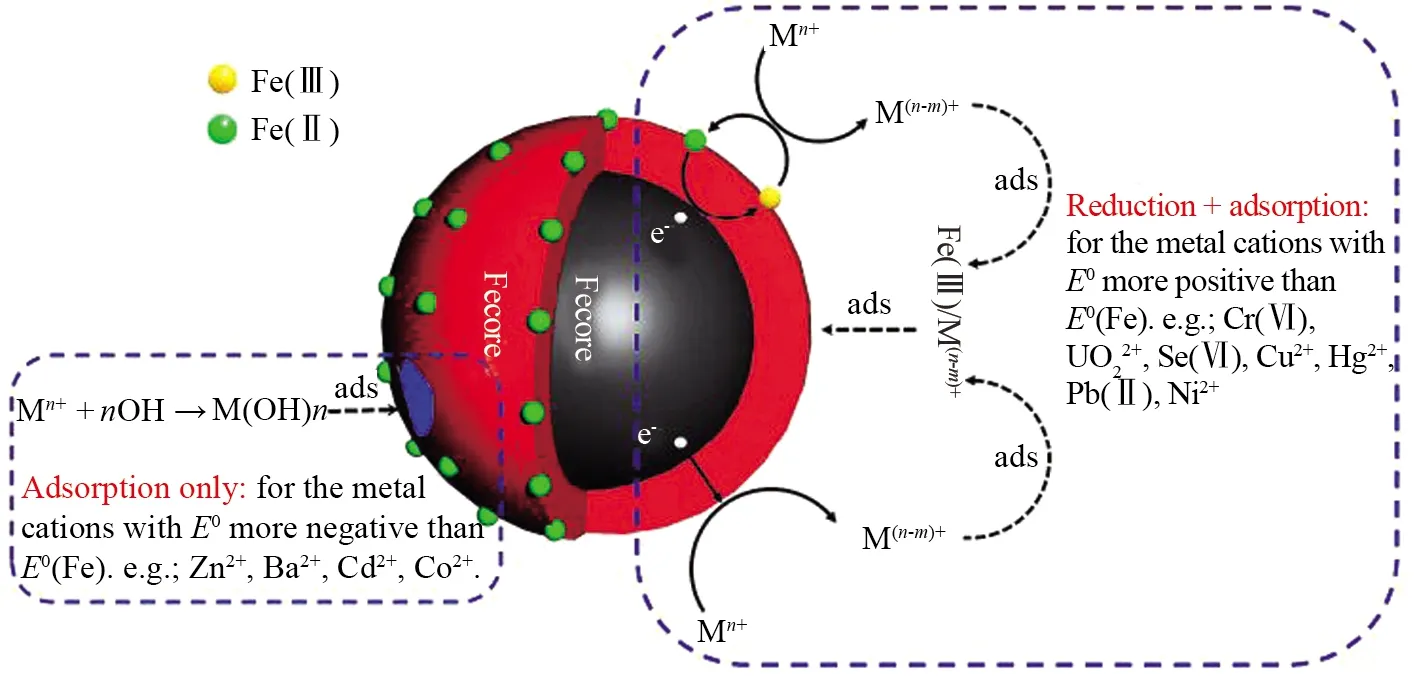
图1 nZVI去除重金属的机理图Fig.1 Mechanism diagram of the removal of heavy metal by nZVI
nZVI虽然具有很强的还原能力,但是其存在易团聚、易氧化的缺陷,在一定程度上降低其吸附重金属的性能,而且易造成二次污染。为了解决nZVI的团聚及表面氧化的问题,通常会将nZVI与另一种零价金属材料复合,形成纳米铁基双金属结构。王毅[65]和钱文涛[66]分别探究了nZVI/Cu和nZVI/Ni对Cr(Ⅵ)的吸附,发现负载金属铜和镍能够显著提高nZVI的反应活性,相较单一nZVI具有更好的吸附性能。对Cr(Ⅵ)仍是依靠Fe0的还原能力,将Cr(Ⅵ)还原成Cr(III),再通过形成氢氧化物沉淀或者共沉淀分离。CHEN等[67]将nZVI固定在碳纳米管上合成磁性Fe/C交联纳米颗粒(MNZVI/CNTs-OH),从而提高了nZVI的分散性,对Cr(Ⅵ)的吸附包括表面吸附、离子交换和化学氧化还原反应。由于纳米零价铁原料成本低,更易大规模生产,并且借助其良好的磁响应特性,在未来重金属污染的水体修复及土壤修复方面都将具有很大的潜力及市场应用价值。
2 纳米非金属单质
在重金属修复材料中,纳米非金属单质是一类热门材料,包括碳纳米管、多孔碳、石墨烯、富勒烯等,它们具有大的比表面积、良好的环境相容性、高的吸附容量,在环境修复、染料、电池、杀虫剂等领域具有广泛的应用。
2.1 纳米碳材料
碳纳米管(Carbon nanotubes,CNTs),主要是片状的石墨按照同一中心卷轴形成的空心管状结构材料,分为单壁纳米管和多壁纳米管[68]。其独特的结构使得碳纳米管具有很大的比表面积以及独特的吸附特性[69],是一种常见的重金属修复剂[70-71]。
单独的CNTs主要通过范德华力,使重金属吸附在CNTs明确的位点上,如内部位点、沟槽位点、外部位点和间隙位点[72-73]。但因为吸附位点有限且是物理吸附作用,所以单独的CNTs对重金属的吸附能力很低。TOFIGHY等[74]采用浓硝酸对CNTs薄片进行氧化处理,使得CNTs薄片的末端和缺陷部位形成更多的含氧基团,如羧基、内酯、酚等不同的含氧官能团,主要通过化学键的作用对重金属离子进行吸附。KOSA等[29]利用8-羟基喹啉对多壁碳纳米管(MWCNTs)进行改性,引入羟基对Cu2+、Pb2+、Cd2+和Zn2+进行吸附,结果表明通过8-羟基喹啉改性后的MWCNTs对重金属离子的去除具有明显的促进作用。为了提高对重金属的吸附能力,还可将碳纳米管与其他材料复合或者引入极性官能团[75-78]。JING等[79]将聚乙烯醇(PVA)与多壁碳纳米管从而获得了一种新型的大孔复合吸附剂PVA/CNTs,在pH = 5~7之间对Pb2+和Cu2+重金属离子去除率达到最大,该吸附过程通过吸附剂PVA/CNTs表面大量-OH吸附络合和氢氧化物沉淀去除。总之,单独的CNTs对重金属主要是物理吸附(范德华力、静电吸附等),稳定性不高。随着对CNTs的表面功能化,CNTs对重金属的吸附由物理吸附转变为更加稳定的化学吸附(络合、化学沉淀等)。
2.2 石墨烯材料
碳原子以sp2杂化方式形成的六角环状二维原子晶体材料,具有比表面积大、化学稳定性好、可修饰性强、表面具有多孔结构等特点,是一种很有应用潜力的水中重金属离子修复剂[80-81]。但未经处理的石墨烯由于存在较强的π-π相互作用、且粒径小,易团聚、吸附容量小,严重限制其在环境污染修复方面的应用。多数研究是将其氧化,形成表面有羧基、羟基等含氧基团的氧化石墨烯(GO),或者直接进行官能团修饰以及与其他材料进行复合,通过以上改性之后可以大大提高石墨烯的性能[82-84]。
为了解决石墨烯团聚的问题,方伟[85]创新性地将SiO2插入到石墨烯层间,形成石墨烯/ SiO2复合材料(GS),随后进一步将聚吡咯颗粒均匀分散在石墨烯表面,形成石墨烯/ SiO2@聚吡咯复合材料(GS-PPy),用GS-PPy去除溶液中的Cr(Ⅵ),并对其内在去除机理进行了探究(图2),主要包括静电吸引、离子交换以及氧化还原作用。

图2 GS-PPy去除 Cr(VI)的机理图Fig.2 Mechanism of the removal of Cr(VI) by GS-PPy
WU等[86]探究了GO对Cu2+的吸附机理(图3),过程如下:
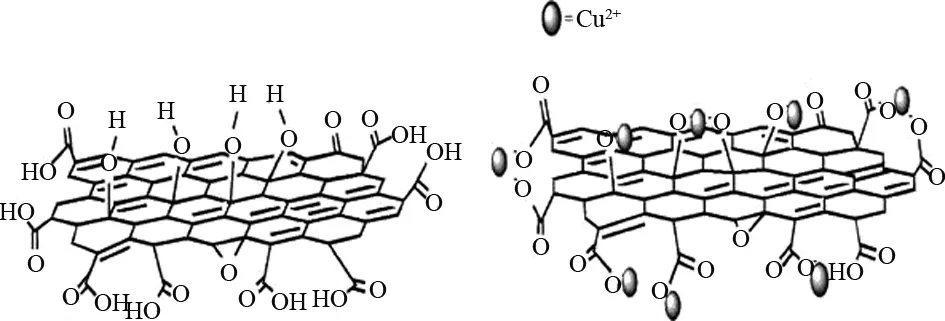
图3 GO对Cu2+的吸附机理图Fig.3 Mechanism diagram of the removal of Cu2+by GO
GO- COOH + Cu2+→GO-COO-Cu2++ H+
(1)
(GO-COOH)2+ Cu2+→(GO-COO )2
- Cu2++ 2H+
(2)
GO-OH + Cu2+→GO-O-Cu2++2H+
(3)
(GO-OH)2+ Cu2+→(GO-O-)2-Cu2++ 2H+
(4)

3 纳米非金属氧化物
纳米级的二氧化硅是一种多功能材料,具有活性位点多、环境无毒无害以及成本低廉等优点被广泛应用[89-90]。
刘纯等[91]合成了二氧化硅纳米空心微球,对Pb2+、Cu2+及Cr3+进行了吸附测试,研究发现金属离子与氧原子形成了具有共价键性质的化学键,对目标离子的吸附是有选择的单层吸附,属于化学吸附。但是纯二氧化硅中的氧原子键合趋近饱和,不易与被吸附离子结合,因此吸附能力并不理想,多是对其进行改性引入活性基团[92-93]。LIAN等[94]采用化学表面接枝法,在氧化硅表面接枝MPTS引入活性基团-SH,土壤中的Pb2+和Cd2+会与巯基形成配位键-S-M-S(M:Pb2+、Cd2+,图4)。

图4 活性纳米二氧化硅固定土壤中Pb2+ 和Cd2+机理Fig.4 Mechanism of the immobilization on Pb and Cd in contaminated soils by the reactive nanosilica
此外,加入3-氨基丙基三甲氧基硅烷[95]、羧基乙基硅烷三醇钠盐[96]等都能引入-NH2、-COOH等,未成键孤对电子的N、O等原子,以一对孤对电子与金属离子形成稳定的配位键,选择性更专一,与金属离子的结合力更强,大大的提高了纳米氧化硅的钝化性能。
4 纳米金属氧化物材料
4.1 纳米氧化铁
纳米铁氧化物具有磁性可分离、合成简单稳定、比表面积大、多孔结构等优点,对环境友好,在重金属吸附等方面具有潜在的应用前景[97-99]。
当溶液中的pH比较大时,纳米Fe3O4对Fe2+、Pb2+、Zn2+、Ni2+、Cd2+、Cu2+等金属阳离子的吸附主要利用Fe3O4表面的负电荷通过静电作用实现吸附[100],而对于以阴离子形式存在的重金属则主要是化学吸附。汪婷[101]合成了球形纳米Fe3O4Mag-1,探究了该材料对Pb(Ⅱ)和Cr(Ⅲ)的吸附过程,首先通过静电吸引机制吸附的表面材料,然后在表面发生络合,此外Cr(III)还可以发生离子交换。为了提高Fe3O4的反应活性,在其表面可以修饰一些活性基团例如氨基[102-103]、巯基[104-105]、羧基[106-107]等,利用这些活性基团与重金属离子的螯合作用,可以高效的吸收重金属离子。NTIM等[108]将铁的氧化物和多壁纳米管复合,能将水中的As(Ⅲ)和As(V)高效去除,依靠的是与氧化铁表面形成的氢氧化物络合。
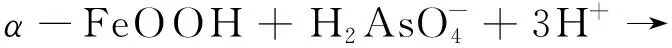
FeH2AsO4+ 2H2O
(5)
α-FeOOH + H3AsO3+ 2H+→ FeH2AsO3+ 2H2O
(6)
4.2 纳米二氧化锰
二氧化锰是自然界广泛存在的一种两性金属氧化物。晶体类型多样,比表面积大,离子交换能力强,具有较强的氧化能力[109-110],因此被广泛应用于重金属修复。
张海鹏[111]较为系统地研究了α-MnO2、β-MnO2、γ-MnO2、δ-MnO2和λ-MnO2五种二氧化锰对Pb2+的吸附作用机理,该过程主要通过离子交换和静电作用两种机制。在pH小于二氧化锰等电点(PI)时,吸附主要通过离子交换机制进行;当pH大于PI时,氧化锰表面脱去水合质子而具有负电位,此时主要通过静电吸引作用吸附。由于氧化锰具有较强的氧化能力,因此常常可以应用于变价重金属元素的修复过程中,姚利娜[112]通过水热合成了δ-MnO2和α-MnO2,发现其对As(III)的吸附主要是化学吸附和氧化还原吸附的协同过程。周莉[113]采用浸泡沉淀法制备了生物炭-纳米二氧化锰复合材料,对Cu2+和Cd2+吸附主要机理是表面的含氧基团,如COO-和-OH,与Cu2+和Cd2+络合,同时也发生离子交换和静电吸引。
4.3 纳米氧化铝
纳米氧化铝是一种传统的水体重金属修复剂,其表面富含大量-OH,常作为重金属吸附位点。根据晶体类型可将氧化铝划分为不同的种类,目前用于重金属修复主要包括α-Al2O3和γ-Al2O3[114-116]。
纳米氧化铝主要通过静电作用吸附重金属阴离子,在酸性环境中,Al2O3因表面羟基质子化而带有正电荷,可以通过静电引力作用吸附CrO42-[117-118]、AsO43-[119]、AsO32-等一些较难去除的重金属氧酸盐阴离子。
纳米氧化铝也可应用于以阳离子形式存在的重金属元素的修复,SHARMA等[120]探讨了纳米Al2O3对Ni2+吸附机理:
S-OH + Ni2+→ S-O-Ni2++ H+
(7)
Al2O3表面水化产生-OH,形成Al2O3-OH,然后失去质子并与Ni2+形成表面配位吸附,由此可见碱性环境对于氧化铝去除重金属阳离子是较为有利的。此外有研究表明氧化铝对Cu2+、Pb2+、Zn2+的吸附机理也是表面配位吸附[121]。
总结而言,纳米氧化铝可在不同的pH环境下对不同形式的重金属元素表现出截然不同的修复效果,这在一定程度上扩展了纳米氧化铝的应用范围。
4.4 纳米二氧化钛
纳米TiO2是一种环境友好的n-型半导体材料,当小于385 nm的波长照射二氧化钛时,一个电子会由价带激发跃迁到导带,因而在导带产生一个高活性电子(e-),在价带留下一个空穴(h+),形成层氧化还原体系,具有良好的光催化活性。目前有研究表明纳米TiO2可以作为一种优良的重金属离子修复剂,治理环境污染[122-124]。
GAI等[125]合成了纳米空心球TiO2,在300 W Xe弧光灯照射下,发生光生电子-空穴对的分离和界面电荷的转移,能将 Cr(VI) 还原为 Cr(III),大大降低了其毒性。FAUSEY等[126]提出还原石墨烯氧化物(rGO)-二氧化钛(TiO2)-电纺聚合物纳米纤维氧化As(Ⅲ),利用TiO2空穴和溶解氧及水的相互作用,产生高强氧化性的羟基自由基,将As(Ⅲ)氧化为As(Ⅴ),同时rGO也能增强TiO2的抗氧化能力(图5)。

图5 rGO-TiO2@电纺聚合物纳米纤维氧化As(Ⅲ)机理图Fig.5 Mechanism diagram of the oxidation of As(Ⅲ) by rGO-TiO2@fiber nanocomposite
此外,TiO2也可以依靠表面的-OH对重金属离子进行作用[127-128]。在酸性环境中,当溶液pH低于等电点时, TiO2表面的-OH带正电荷, 通过静电作用将溶液中的金属阴离子吸附到TiO2表面;当pH高于等电点时,TiO2表面的-OH会失去质子带负电荷,容易吸附金属阳离子,该修复过程显然容易受到修复环境pH的影响,为了提高TiO2材料的吸附性能,常采取引入有机官能团的办法。李林等[129]利用3-巯基丙基三甲氧基硅烷(MPTMS)对纳米二氧化钛进行巯基化改性,能够自发络合吸附水中的Hg2+。通过有机官能团改性后的纳米TiO2在稳定性和修复性能方面都有较大的提升。
5 纳米金属硫化物
纳米硫化亚铁不仅具备纳米材料比表面积大、活性位点多等特点,而且还是一种还原剂,在重金属修复领域有着重要的应用[130-131]。但是纳米FeS具有易氧化、易团聚等缺点[132]。通常利用含有大量羧基、羟基以及氨基等基团的化合物与硫化亚铁鳌合,增加其稳定性,制备稳定的纳米FeS粒子。
宋世琨等[133]归纳了纳米FeS对于一些二价的金属离子Hg2+、Cd2+、Cu2+、Ni2+等的吸附机理,过程如下:
≡FeS +xM2+→ [≡Fe1-x, Mx]S +xFe2+
(8)
≡FeS + M2+→ ≡FeS- M2+
(9)
FeS+ M2+→ MS + Fe2+
(10)
FeSH+ +xM2+→ Fe1-xMxS +xFe2++ H+
(11)
在这个过程中包括有吸附、沉淀和共沉淀作用。张华夏[134]研究了CMC、Starch、Chitosan稳定化纳米硫化亚铁对砷的吸附机理,过程如下:
在 pH = 1~5时,As 主要形成 FeAsO4和 As2S3沉淀,并有少量的S单质生成。在 pH> 5 时,溶液中出现Fe(OH)3,具有很强的絮凝作用,对溶液中 FeAsO4、As2S3、S 沉淀的生成具有促进作用。因此稳定化纳米硫化亚铁对砷的吸附,主要是化学反应并辅以物理吸附。YAO等[135]利用聚丙烯酸盐(PAA) 和n-FeS为原料合成了一种新型复合胶体,提高了n-FeS的稳定性,采用PAA-n-FeS胶体对水体修复中的Cr(VI)进行了去除,机理主要来源于n-FeS自身的还原性。反应产物主要为Cr(OH)3、Cr(III)-Fe(III)、Cr2O3、Cr2S3。
pH = 1~5
4H++4Fe2++O2=4Fe3++ 2H2O
(12)
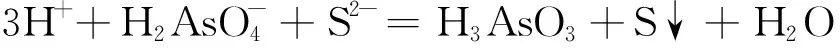
(13)
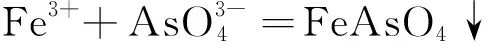
(14)
H3AsO3+ 2S2-+4H+=HAsS2+3 H2O
(15)
2H3AsO3+6H++3S2-=As2S3↓+6 H2O
(16)
pH= 5~10
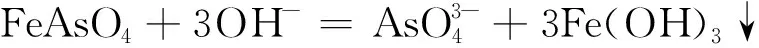
(17)
4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3↓
(18)
Fe(OH)3+ As(Ⅲ) + As(Ⅴ) + S2-= Fe-As-S
(19)
6 纳米聚合物
壳聚糖是甲壳质的衍生物,具有生物相容性、生物降解性和无毒等特点,是一种环境友好型重金属修复材料,该类材料含有大量的-NH2和-OH,对重金属离子具有很强的螯合作用,是一种应用前景十分广阔的重金属修复材料[136-137]。
JIN等[138]通过将壳聚糖和聚乙烯醇(PVA)复合,制备出了壳聚糖/PVA水凝胶珠,并研究了其对Pb2+的吸附机理,结果表明壳聚糖大分子链段中的-NH2以及PVA 中的-OH均对Pb2+都具有螯合能力,但主要是通过与N原子配位作用完成的,这是由于氧原子对核外孤对电子的吸引力比氮原子更强,氮原子的孤对电子更倾向于与金属阳离子螯合。壳聚糖的螯合吸附机制可以对多种重金属阳离吸附[139],如Cu2+、Co2+和Ni2+等。WU等[137]探索了Cu2+与-NH2以1∶1、1∶2、1∶4的物质的量之比结合时,不同的配位方式(图6)。

图6 Cu2+与壳聚糖中的-NH2以1∶1(a)、 1∶2(b)、1∶4(c) 物质的量之比配位Fig.6 Molar ratio of coordination of Cu2+ with the -NH2 groups of chitosan by a of 1∶1(a), 1∶2(b), and 1∶4(c)

7 纳米金属磷酸盐
羟基磷灰石广泛存在于自然界中,是人体的骨骼和牙齿的主要成分,具有良好的生物相容性和化学稳定性。研究发现,纳米羟基磷灰石可通过表面吸附或离子交换与重金属作用,对重金属污染水体及土壤具有优良的修复效果[38, 144-147]。
MAVROPOULOS等[148]探究了羟基磷灰石对Pb2+的吸附机理,认为是分为以下两个阶段:
溶解:
Ca10( PO4)6( OH)2+ 14H+→
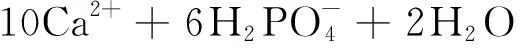
(20)
沉淀:

14H++ Pb10( PO4)6( OH)2
(21)
也有研究认为发生的是离子交换,nHAp晶格中的Ca2+部分被溶液中的Pb2+取代,从而形成更稳定的铅磷灰石,表现为Ca(10x)Pbx(PO4)6(OH)2[149]。对于Cd2+、Cu2+、Zn2+的吸附机理,现主要认为仍是发生溶解-沉淀两阶段理论[150-152]。为提高羟基磷灰石的表面积增大吸附容量,SAOIABI等[153]在羟基磷灰石表面接枝硝基三膦酸(亚甲基)分子,氮和膦酸基团负责络合反应去除重金属Zn2+和Pb2+。
8 结论
纳米材料因其比表面积大、易表面功能化和饱和吸附容量大等特性,在重金属修复应用中有着十分广阔的应用前景。不同种类的纳米材料对重金属的修复机制也不尽相同,而且在修复重金属的过程中,往往存在许多机理相互协同促进的情况。同种纳米材料针对不同重金属也表现出了截然不同的作用机理。因此在未来的重金属修复应用中,我们可以根据重金属的种类选取不同的纳米材料;根据作用机理的不同将多种纳米材料相互结合,取长补短。同时,目前大部分纳米修复剂还处于实验室阶段,需要更多科研工作者探索纳米修复剂小试、中试直至规模化生产的工艺流程、设计方案,这对目前重金属污染现状的改善是当务之急。
