尿酸与水的氢键作用研究
2021-08-19樊星辰吴玉星翟翠萍
樊星辰,吴玉星,宁 攀*,彭 鹏,翟翠萍*
(1. 河南大学 迈阿密学院,河南 开封 475004; 2. 河南大学 化学化工学院,河南 开封 475004)
人体内尿酸是嘌呤的最终代谢产物,一定含量的尿酸可起到保护组织细胞,提高人体抗氧化能力的作用。尿酸的浓度对人类健康至关重要,在医学上可根据其含量进行一些疾病的诊断,如痛风、肾病和高尿酸血症等[1]。鉴于其特殊的医学参考价值,尿酸的检测、分析及各类研究成为人们关注的热点,且与尿酸相关的研究大部分是在水溶液中进行的。因此,其与水的相互作用是研究尿酸与其他混合体系的基础,也引起了人们的关注。如CHANDRA等[2]使用密度泛函理论(DFT),采用B3LYP/6-31++G(d,p)计算得到了二者在气相中相互作用的稳定构型。发现尿酸中的羰基氧原子、亚氨基氢原子可分别与水中的氢、氧原子形成氢键;通过分析单体及复合物中亚氨基(尿酸)和羟基(水)的振动频率及各原子之间电荷的变化,认为其所形成氢键复合物的稳定性与尿酸中亚氨基的酸度及氧原子的质子亲和力有关。SAIGUSA课题组[3]使用不同的计算方法(DFT/B3LYP/6-311++G(d,p)、DFT/M06-2X/6-311++G(d,p)、CCSD(T)/6-311++G(d,p)、CCSD(T)/aug-cc-pVDZ、MP2/6-311++G(d,p)等)对尿酸的两种异构体(酮式和烯醇式)与水在气相中所形成的复合物进行了研究。结果表明其酮式结构与水所形成的复合物相对稳定;他们进一步使用紫外-红外双共振光谱技术测试了尿酸及尿酸水合物的红外光谱,并通过理论计算得到了尿酸-水复合物的红外光谱,研究发现尿酸与水之间存在弱氢键作用。虽然人们对尿酸与水之间的相互作用已有一定的了解,但多是理论计算方面,相关的实验研究相对较少。此外,上述理论研究关注的是二者在气相中的作用,而对其液相中的相关计算及其氢键性质还有待进一步研究。
在弱相互作用研究中,DFT中的ωB97XD方法也常用来研究分子间氢键。鉴于以上分析,本文使用实验(紫外-可见光谱、电化学循环伏安法)与量子化学计算(ωB97XD/6-311++G(d,p))相结合,深入研究水溶液中尿酸与水的相互作用及其作用的主要位点。并通过分子间原子理论(QTAIM)及自然键轨道分析(NBO)进一步探讨其相互作用的本质。为尿酸与其他物质混合体系在水溶液中的研究提供理论参考。
1 实验仪器试剂与理论计算方法
尿酸(生化试剂,99.9%,阿拉丁公司);二次蒸馏水(实验室重蒸,使用前用高纯氮气除氧15分钟);UV-540紫外-可见分光光度计(Thermo Electron,美国);CHI660E电化学工作站(上海辰华有限公司)。电化学测试使用三电极系统:玻碳电极(工作电极,使用前进行预处理[4]),饱和甘汞电极(SCE,参比电极),铂丝电极(对电极)。实验温度为室温。
量子化学计算使用Gaussian 09[5]程序。在ωB97XD/6-311++G(d,p)水平上,优化了尿酸、水及其复合物在气相中的几何结构。在此基础上,使用SMD 模型计算液相中尿酸-水的稳定构型。经完全均衡校正法校正基组重叠误差得到其相互作用能(ΔE)[6];使用Multiwfn 3.3.9程序[7]进行QTAIM分析;使用与DFT相同的方法和基组进行NBO计算。
2 结果和讨论
2.1 紫外吸收光谱图
由于具有简便、快速的优点,紫外-可见吸收光谱在分子间相互作用研究方面应用广泛[8]。图1是尿酸在不同浓度尿酸水溶液中的紫外吸收光谱图。图1中出现了两个紫外吸收峰[9],且二者强度均随溶液浓度的增大而发生蓝移。根据文献可知,287 nm处为尿酸六元环上与C=C相连C=O的n→π*跃迁吸收峰;233 nm处对应的是六元环和五元环中两个NH之间C=O的n→π*跃迁吸收峰。上述吸收峰发生蓝移应是两个环上的羰基都可与水发生作用形成了氢键,阻碍了其电子跃迁所致[10]。
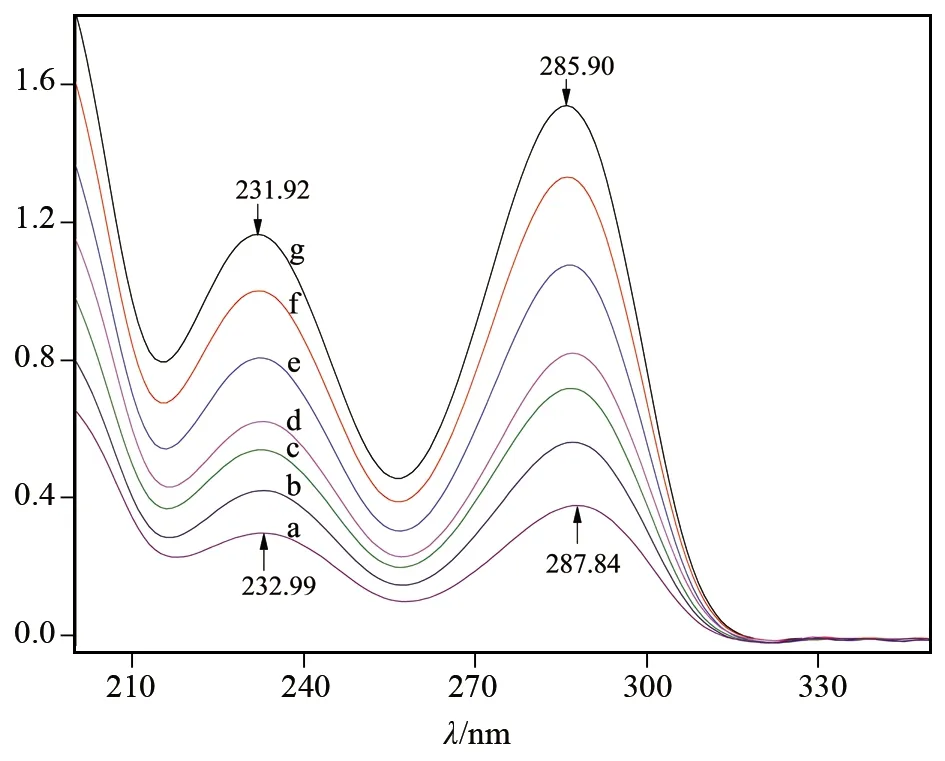
图1 尿酸在水溶液中的紫外吸收光谱图Fig.1 UV spectra of uric acid in H2O
2.2 循环伏安曲线
尿酸具有很好的电化学活性,因此,对该混合体系进行了电化学测试,图2为尿酸在不同浓度尿酸水溶液中的循环伏安(CV)曲线。从图2可以看出,尿酸在水溶液中仅出现了一个氧化峰,对应于尿酸五元环中NH的氧化过程[11]。此外,氧化峰的电位和电流均随溶液浓度增大而变大。根据尿酸的结构、电化学机理、紫外及CV结果,导致这一变化的原因应为:水分子中的O与尿酸五元环中NH上的H形成了氢键,对它们(H16、H18,各原子的标号见图3)起到了保护作用,使其难以失去,即难以被氧化;同时,尿酸中C=O的O与水中的H也可形成氢键,导致C=O对相邻NH中N的吸电子能力减弱,因而N-H键作用增强,N-H上的H难以离去。两种作用共同导致尿酸的电氧化过程变得困难,氧化电位变大。

图2 尿酸在水溶液中的循环伏安图Fig.2 Cyclic voltammograms of uric acid in H2O
2.3 量子化学计算
量子化学计算常用来研究分子间氢键。本文进一步采用DFT计算得到了尿酸与水在液相中稳定的复合物构型(图3),图3中仅给出了O…H键长小于2.72 Å(二者范德华半径之和,H:1.20 Å;O:1.52 Å)[12]的数据。从图3可以看出:尿酸中的H(H10、H14、H16、H18)、O(O11、O12、O19)可分别与水中的O、H形成氢键。与气相中的尿酸-水复合物相比[2-3],虽然液相中的作用位点与其相同,但二者构型有所不同;且在气相中,复合物d最稳定,而在液相中,复合物a的ΔE最低,为最稳定构型。此外,构型a中尿酸的两个作用位点分别是O11和H18,与紫外吸收光谱和电化学结果相吻合。同时说明O11和H18应为尿酸与水在液相中的主要作用位点,而气相中的主要作用位点则是H14和H16[2-3]。从图3还可以看出,构型e的ΔE次之,是相对稳定的构型,且构型e中N13-H14…O1的键长最短,说明在尿酸与水所形成的氢键中,其氢键作用最强[13]。

图3 尿酸-水复合物的优化结构图Fig.3 Optimized geometry of uric acid-H2O complexes
QTAIM也常用来研究分子间氢键,并可进一步分析氢键的强弱。在上述量化计算的基础上,进一步通过QTAIM对液相中的尿酸-水复合物构型进行了电子密度拓扑分析,其拓扑参数(ρ、2ρ和H)及氢键结合能EHB值(EHB≈ -223.08×ρBCP+0.742 3)[14]见表1。

表1 尿酸-水复合物中氢键的拓扑参数和结合能
从表1可以看出,除构型e中的N13-H14…O1外,其他键的ρ及2ρ值均在KOCH等[15]提出的氢键范围(ρ:0.002~0.035 a.u.,2ρ:0.024~0.139 a.u.),且H>0,说明所形成的氢键较弱[16-17]。而构型e中N13-H14…O1的H< 0,且ρ值最大,表明其作用相对较强,与DFT结果一致。此外,所有氢键的结合能EHB均处于-2.5~-14.0 kcal/mol之间,证明混合体系中的氢键在本质上都是弱氢键到中等强度氢键[14]。
本文进一步对尿酸-水体系进行了NBO分析。表2为六种复合物中电子的供体轨道、受体轨道及其相应的二阶稳定化能(E(2),kcal/mol)。分析表2中的E(2)值不难发现,O原子的孤对电子轨道与N-H或O-H的反键轨道之间存在相互作用,即氢键作用[18],如:构型a中O11的孤对电子轨道与O1-H3的反键轨道、O1的孤对电子轨道与N17-H18的反键轨道。众所周知,E(2)值的大小与相互作用的强度有关,从表2还可以看出,构型e中LP(2)O1→σ*N13-H14的E(2)值最大,说明其作用最强,这也与前面的DFT和QTAIM结果一致。
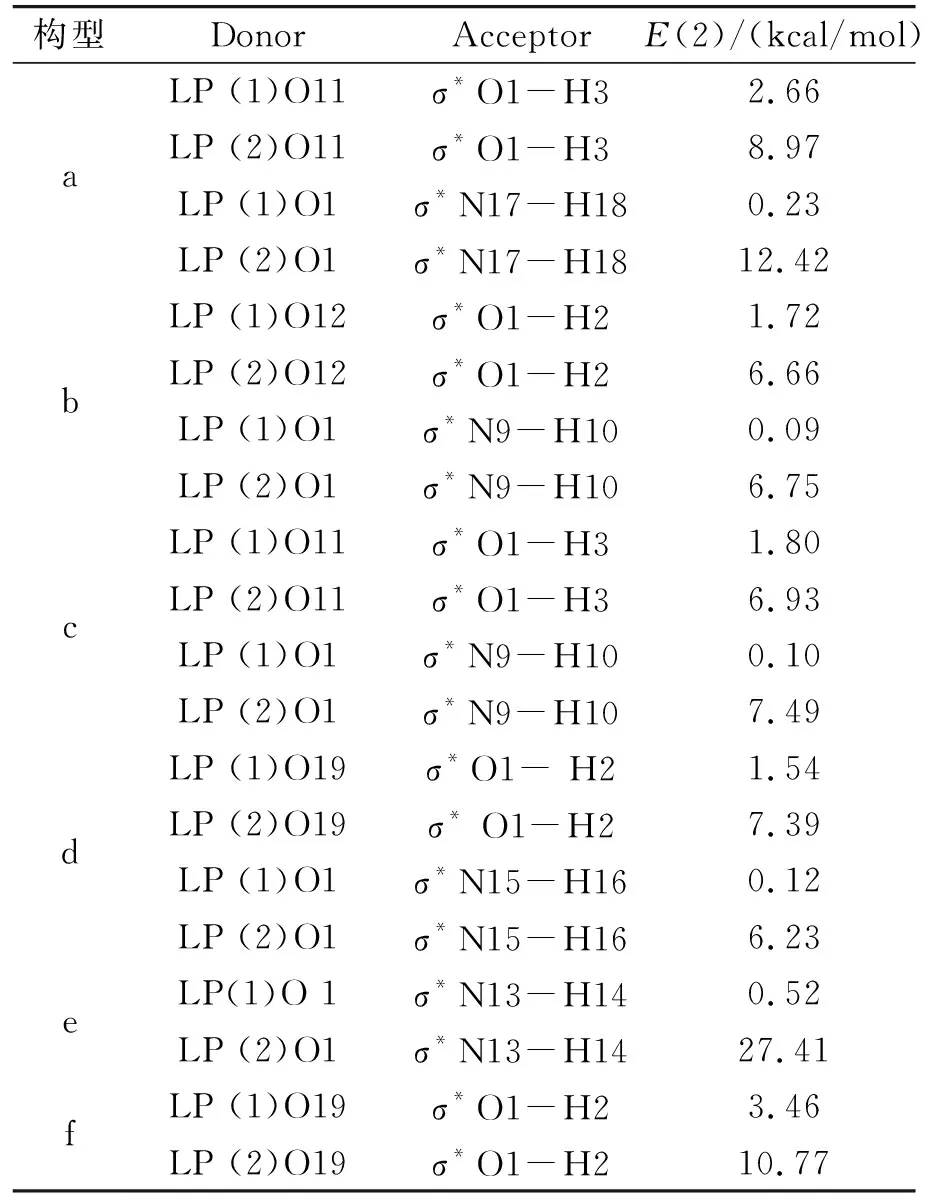
表2 尿酸-水复合物中的供电子轨道、 受电子轨道及二阶稳定化能
3 结论
利用实验与理论相结合研究了尿酸与水的相互作用。紫外光谱和循环伏安曲线结果表明二者之间存在分子间氢键,量子化学计算进一步证明了氢键作用的存在及其作用位点。本研究可为研究尿酸与其他物质的相互作用提供依据,也可为尿酸在水溶液中的检测及其他研究提供基础。
