多壁碳纳米管和重金属镉的细菌毒性及影响机制
2020-04-22裴建川王鹏程王洁洁
付 勇,裴建川,李 梅,王鹏程,王洁洁
(浙江农林大学 环境与资源学院,浙江 杭州 311300)
随着纳米技术的快速发展,碳纳米管在材料、催化、光学器件、分子开关、生物医学、环境修复等各领域都有了广泛的研究和应用[1],同时碳纳米管对人类健康和生态环境的潜在风险也引起了世界范围内的广泛关注[2-6]。进入环境中的碳纳米管将不可避免地与其他化学物质共存,碳纳米管对共存污染物毒性的影响及复合毒性也越来越多地受到了研究者的关注。碳纳米管可以通过吸附共存污染物,降低或增强共存污染物对生物的毒性。如刘信勇等[7]发现实验用多壁碳纳米管本身对斑马鱼Danio rerio没有毒性,但却由于吸附了铅(Pb)和锌(Zn),导致重金属在斑马鱼体内的积累,毒性剧增。YU等[8]发现表面未处理的单壁和多壁碳纳米管抑制了大型蚤Daphnia magna对重金属的吸收,但由于单壁和多壁碳纳米管表面富有含氧官能团,能吸附大量重金属,因此大型蚤内重金属积累增强。WANG等[9]发现铜(Cu)和铬(Cr)增强了碳纳米管对微生物种群的影响,以羧基化和羟基化碳纳米管毒性更强。碳纳米管与重金属的复合毒性是协同、叠加还是拮抗,不仅取决于碳纳米管和重金属的相互作用,还取决两者与生物体的相互作用。具有不同表面官能团的多壁碳纳米管性质差异较大,影响其与重金属和生物体的相互作用,从而影响复合毒性;开展不同官能团多壁碳纳米管对重金属的吸附及生物效应的研究十分必要。细菌是单细胞原核微生物,结构简单,与其他生物相比,对污染物的毒性更敏感。大肠埃希菌Escherichia coli在自然界中普遍存在,常被用作毒性实验模型微生物;重金属镉(Cd)毒性较大,在污染水体中常见。因此,本研究以大肠埃希菌为模型细菌,研究3种多壁碳纳米管(短、短羟基和短羧基多壁碳纳米管)和Cd的复合细菌毒性,从多壁碳纳米管、重金属、细菌相互作用的角度阐述了复合毒性机制,试图为水体中多壁碳纳米管和重金属的复合毒性效应评价提供依据。
1 材料与方法
1.1 实验材料
短多壁碳纳米管(无基团、羧基和羟基)购自上海阿拉丁生化科技股份有限公司。具体参数为:纯度>95%,内径为5.0~10.0 nm,外径为8.0~15.0 nm,长度为0.5~2.0 μm。称量相应的多壁碳纳米管颗粒,用超纯水进行配制,使用前超声20 min。称取 0.274 4 g Cd(NO3)2·4H2O,用超纯水溶解并定容至1 000 mL,配制成100 mg·L-1的Cd2+储备液。所用化学物质均购买自上海国药集团。
实验室大肠埃希菌(登录号:MG388227)为从生活污水中筛选分离得到[10]。菌种接种于LB固体平板,保存于4℃冰箱中。使用前接种于LB液体培养基(pH 7.0)培养过夜,为避免生理盐水中盐度对实验的影响,细菌悬液用超纯水洗涤2次后悬浮于超纯水中,调节吸光度D(600)至1.0备用。
1.2 实验方法
1.2.1 毒性实验 调节多壁碳纳米管至0、20、50、100、200 mg·L-1,调节Cd2+至0、1、2、4、8、10 mg·L-1,分别测定对大肠埃希菌的单独毒性,作为混合物细菌毒性的对照组;并比较该复合细菌毒性(即联合或混合毒性)和叠加毒性(单独毒性的叠加),判断复合细菌毒性性质(加和、协同或拮抗)。为进一步明确多壁碳纳米管对低浓度Cd2+细菌毒性的影响,固定Cd2+质量浓度(1 mg·L-1),由于多壁碳纳米管质量浓度过高,团聚现象严重,质量浓度过低则与重金属相互作用不明显,因此固定多壁碳纳米管质量浓度为 100 mg·L-1, 与不同质量浓度(0、 1、 2、 4、 8、 10 mg·L-1)Cd2+混合, 测定多壁碳纳米管-Cd2+混合物的细菌毒性; 固定 Cd2+质量浓度(1 mg·L-1), 与不同质量浓度(10、 20、 50、 100、 200 mg·L-1)多壁碳纳米管混合,测定Cd2+-多壁碳纳米管混合物的细菌毒性。毒性实验分为3 h毒性暴露实验和细菌生长抑制实验,均在恒温摇床中进行,具体方法参照文献[10]。细菌存活率(SB)按以下公式计算:SB=(Dst-Dso)/(Dct-Dco)×100%。其中,Dst和Dso分别代表样品在t时刻和初始时刻的吸光度,Dct和Dco分别代表相应对照组在t时刻和初始时刻的吸光度。根据每次实验对照组迟滞期长短,本研究t取2或3 h(对数生长期初期)。
1.2.2 多壁碳纳米管zeta电位测定 多壁碳纳米管的团聚状态与大肠埃希菌的相互作用均与多壁碳纳米管的表面电荷有关。不同暴露介质中多壁碳纳米管的zeta电位用纳米粒度电位仪(Nano-ZS90,马尔文公司,英国)测定。为能较准确测量zeta电位,选择多壁碳纳米管质量浓度为100 mg·L-1,Cd2+质量浓度为10 mg·L-1。
1.2.3 沉降实验 多壁碳纳米管的悬浮稳定性可通过沉降实验表征,与细菌接触的程度也可通过细菌悬液的沉降特征间接得出。沉降实验振荡条件与1.2.1相同。其中待测多壁碳纳米管质量浓度为100 mg·L-1,Cd2+质量浓度为10 mg·L-1。不同时间测定波长600 nm处多壁碳纳米管悬液吸光度(D),隔30 min测定1次,共6次。共沉降率(%)用D/Do表示,其中Do表示初始吸光度。
1.2.4 吸附实验 碳纳米管对重金属具吸附作用。分别量取1 g·L-1的3种多壁碳纳米管与不同质量浓度(1、 2、 4、 8、 10 mg·L-1)Cd2+混合, 配置混合溶液 10 mL, 于(25±1) ℃、 150 r·min-1的恒温摇床中吸附3 h;待吸附平衡后,将样品转移至4 000 r·min-1下离心15 min,取上清液经0.22 μm滤膜过滤;用电感耦合等离子体发射光谱仪(Prodigy7,利曼-徕伯斯公司,美国)测定滤液中溶解Cd2+的质量浓度。计算平衡吸附量 Qe(mg·g-1)=被吸附的 Cd2+的质量(mg)/多壁碳纳米管的质量(g)。
2 结果与分析
2.1 不同多壁碳纳米管对大肠埃希菌的毒性效应
如图1所示:随多壁碳纳米管质量浓度升高,大肠埃希菌存活率下降,即多壁碳纳米管的细菌毒性增强。毒性从强到弱依次为短多壁碳纳米管、短羧基多壁碳纳米管、短羟基多壁碳纳米管。当多壁碳纳米管质量浓度达200 mg·L-1时,大肠埃希菌存活率分别降至70%、80%和90%。

图1 不同多壁碳纳米管对大肠埃希菌的毒性Figure 1 Toxicity of different MWCNTs toward E.coli
2.2 多壁碳纳米管及其Cd2+混合物的细菌毒性
由图2A可知:Cd2+的细菌毒性(对照)随着质量浓度增加而增强,当Cd2+质量浓度达10 mg·L-1时,大肠埃希菌的存活率为45%。100 mg·L-1的多壁碳纳米管与不同质量浓度Cd2+混合,大肠埃希菌的存活率随Cd2+质量浓度增加而降低;3种多壁碳纳米管-Cd2+混合物的复合细菌毒性从强到弱依次为短多壁碳纳米管-Cd2+、短羧基多壁碳纳米管-Cd2+、短羟基多壁碳纳米管-Cd2+。就短羧基多壁碳纳米管而言,当Cd2+质量浓度低于4 mg·L-1时,混合物的细菌毒性与Cd2+的单独毒性几乎一样;随Cd2+质量浓度升高,复合细菌毒性明显低于Cd2+的细菌毒性。而短羟基多壁碳纳米管-Cd2+的复合细菌毒性明显低于Cd2+的细菌毒性。比较多壁碳纳米管-Cd2+的复合细菌毒性和叠加毒性可知:复合细菌毒性小于两者叠加毒性,即复合细菌毒性是拮抗效应(图2A)。实际水体环境中,Cd2+质量浓度可能较小,为了进一步明确多壁碳纳米管吸附低质量浓度Cd2+后的细菌毒性,固定Cd2+质量浓度至1 mg·L-1。从图2B可以看出:随多壁碳纳米管质量浓度上升,Cd2+-多壁碳纳米管混合物细菌毒性逐渐减弱的,短多壁碳纳米管-Cd2+、短羧基多壁碳纳米管-Cd2+和短羟基多壁碳纳米管-Cd2+的细菌存活率分别从50%、55%和60%变化为70%、80%和85%。相同条件下,复合细菌毒性由大到小依次为短多壁碳纳米管-Cd2+、短羧基多壁碳纳米管-Cd2+、短羟基多壁碳纳米管-Cd2+。多壁碳纳米管本身细菌毒性较弱,因此认为多壁碳纳米管吸附低质量浓度Cd2+能明显降低细菌毒性。
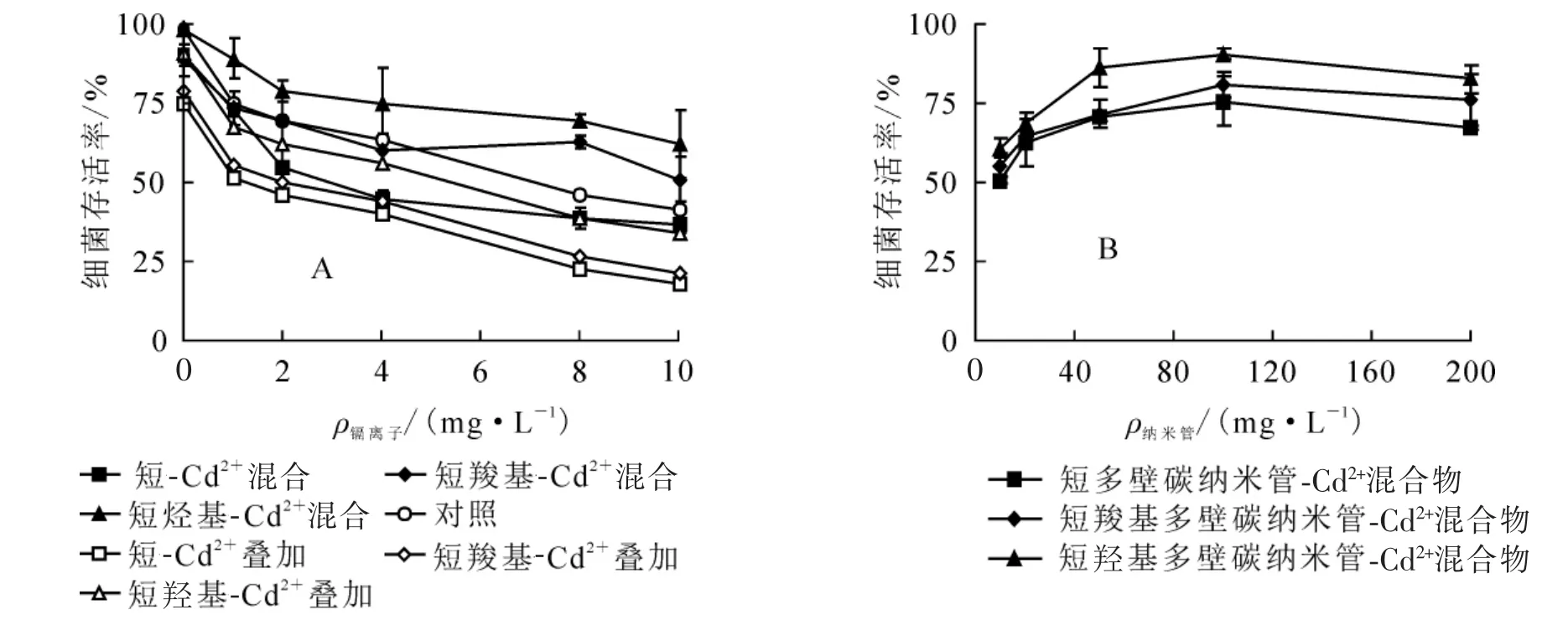
图2 多壁碳纳米管吸附Cd2+后混合物细菌毒性变化Figure 2 Toxicity variation of MWCNTs-Cd2+toward E.coli
2.3 多壁碳纳米管及其Cd2+混合物的zeta电位
从表1可以看出:3种多壁碳纳米管的zeta电位相差不多,在超纯水中均带负电荷;而加入Cd2+后,3种多壁碳纳米管的负电荷部分被中和,以短多壁碳纳米管表面的负电荷降低最多。

表1 多壁碳纳米管颗粒及多壁碳纳米管吸附Cd2+后混合物的zeta电位Table 1 Zeta potentials of MWCNTs and its compounds
2.4 多壁碳纳米管及其Cd2+混合物与大肠埃希菌的共沉降
如图3A所示:多壁碳纳米管在前30 min沉降速度较快,1 h后沉降基本稳定,悬浮浓度基本保持不变。相比之下,短多壁碳纳米管稳定性最差,3 h沉降率约90%,短羟基和短羧基多壁碳纳米管稳定性较好,3 h沉降率分别达45%和20%。吸附Cd2+后,短羧基多壁碳纳米管-Cd2+混合物的3 h沉降率达50%,略高于短羧基多壁碳纳米管。短羧基多壁碳纳米管-Cd2+和短羟基多壁碳纳米管-Cd2+的沉降率与纳米管溶液沉降率几乎一样。大肠埃希菌悬液本身不沉降,当在大肠埃希菌悬液中混入多壁碳纳米管及其吸附混合物后(图3B),混合悬液前30 min共沉降速度较快,1 h后沉降基本稳定。3种多壁碳纳米管与大肠埃希菌3 h共沉降率分别约40%(短多壁碳纳米管)、45%(短羟基多壁碳纳米管)和20%(短羧基多壁碳纳米管);3种吸附Cd2+的多壁碳纳米管与大肠埃希菌3 h共沉降率分别约45%(短多壁碳纳米管)、60%(短羟基多壁碳纳米管)和40%(短羧基多壁碳纳米管)。

图3 多壁碳纳米管及其Cd2+混合物与大肠埃希菌共沉降Figure 3 Settling properties of MWCNTs and its compounds toward E.coli
2.5 多壁碳纳米管对Cd2+的吸附实验
如图4所示:当Cd2+质量浓度低于4 mg·L-1时,短多壁碳纳米管对Cd2+的吸附量随着Cd2+的质量浓度增加而增多。当Cd2+的质量浓度大于4 mg·L-1时,吸附量几乎不变。短羧基和短羟基多壁碳纳米管对Cd2+的吸附量随着Cd2+的质量浓度增加而增多。相同条件下,3种多壁碳纳米管对Cd2+的吸附量从大到小依次为短羧基多壁碳纳米管、短羟基多壁碳纳米管、短多壁碳纳米管。
3 讨论
3.1 多壁碳纳米管细菌毒性的影响机制
多壁碳纳米管对大肠埃希菌的毒性主要来自2个方面,一是多壁碳纳米管与细菌直接接触,可能造成刺穿等物理损伤,从而导致细菌死亡;二是多壁碳纳米管产生的活性氧自由基对细菌有氧化损伤[11-13]。本研究在黑暗条件下进行,因此排除了活性氧自由基对大肠埃希菌的损伤,多壁碳纳米管对大肠埃希菌的细菌毒性主要为直接接触;受两者表面电荷影响,多壁碳纳米管颗粒与细菌接触碰撞,可能造成细菌损伤。从zeta电位测定结果可知:多壁碳纳米管与大肠埃希菌之间存在静电斥力,直接接触能力较弱;短羧基多壁碳纳米管和短羟基多壁碳纳米管与细菌的共沉降率与颗粒单独沉降率几乎一样,说明此2种多壁碳纳米管与大肠埃希菌接触较少,细菌毒性因而较小。相比之下,短多壁碳纳米管与大肠埃希菌的共沉降率最高(60%),说明与细菌接触的程度最高,因而细菌毒性也最强。

图4 多壁碳纳米管对于Cd2+的吸附Figure 4 Adsorption of MWCNTs to Cd2+
3.2 不同多壁碳纳米管及其Cd2+混合物细菌毒性的影响机制
本研究发现:不同官能团多壁碳纳米管吸附Cd2+的状况不同。受溶液pH值[14]、多壁碳纳米管的比表面积、表面基团和表面电荷等影响[15-16],多壁碳纳米管对Cd2+的吸附性能不同,吸附方式主要有物理吸附、静电作用、离子交换和表面络合,一般以离子交换和表面络合为主[17]。相同吸附实验条件下,3种多壁碳纳米管管径和长度一致,对于Cd2+的物理吸附相差不大;吸附性能主要由表面基团决定。羧基和羟基中的氢离子(H+)均可与Cd2+发生离子交换,与羟基相比,羧基与Cd2+的化学键能更强,因此短羧基碳纳米管吸附Cd2+性能优于短羟基多壁碳纳米管[18]及短多壁碳纳米管。溶液中被吸附的Cd2+量越大,毒性越弱。因此使得相同条件下,多壁碳纳米管及其Cd2+混合物的细菌毒性从高到低为短羧基多壁碳纳米管、短羟基多壁碳纳米管、短多壁碳纳米管。由溶液与细菌的共沉降结果可知:Cd2+可能影响了多壁碳纳米管和细菌的共沉降,原因可能是Cd2+降低了短羧基多壁碳纳米管和短羟基多壁碳纳米管的分散性,减少了两者与细菌的接触机会,Cd2+与此2种多壁碳纳米管混合物和细菌的共沉降率减小,而Cd2+与短多壁碳纳米管的细菌共沉降率略微增大,可能与zeta电位值有关。本研究发现:Cd2+降低了多壁碳纳米管表面的负电荷,Cd2+存在条件下多壁碳纳米管与大肠埃希菌之间的静电斥力降低,即多壁碳纳米管与大肠埃希菌直接接触机会增加,从而使得细菌毒性增强。
4 结论
相同条件下,3种多壁碳纳米管的细菌毒性从强到弱依次为短多壁碳纳米管、短羧基多壁碳纳米管、短羟基多壁碳纳米管。多壁碳纳米管和Cd2+混合后,纳米管表面负电荷被降低,与细菌间静电斥力降低,直接接触毒性增强;同时Cd2+被纳米管吸附,自身毒性降低。3种多壁碳纳米管与Cd2+混合物的细菌毒性均低于纳米管和重金属的毒性,其中短羟基多壁碳纳米管-Cd2+混合物的细菌毒性最低,其次为短羧基多壁碳纳米管。短多壁碳纳米管对Cd2+的吸附能力最弱,因此短多壁碳纳米管-Cd2+的细菌毒性要高于其他2种混合物。
