基于光敏剂的纳米诊疗载体构建的研究进展
2021-08-19杨舜禹田雪莹彭黔荣
杨舜禹,田雪莹,杨 敏*, 彭黔荣
(1.贵州大学 药学院,贵州 贵阳 550025; 2.贵州中烟工业有限责任公司技术中心,贵州 贵阳 550009)
癌症是导致死亡的主要原因之一。癌细胞会使正常细胞失去功能并破坏它们,或者转移到身体的其他健康器官进而影响器官功能。因此,癌症的早期发现、正确诊断和治疗一直是一个关键问题[1]。
光敏剂(Photosensitizer,PS)是一种能被特定波长的光照射激发的物质,同时也是光动力疗法(Photodynamic therapy,PDT)的核心药物,被激发光照射后产生具有细胞毒性的活性氧,诱导细胞凋亡以杀死癌细胞[2]。光敏剂被激发光照射时,核外电子由基态跃迁到激发单线态再恢复到基态,此过程释放的能量会以光(荧光)的形式释放,因此光敏剂具有荧光成像诊断的潜力[3-4]。与常规的癌症诊断手段如计算机断层扫描、磁共振成像、内腔镜相比,光敏剂作为癌症的新型诊疗手段具有低耐药性和微创性等优点,因此在肿瘤诊疗中备受关注[5-6]。
1 纳米载体的优势
光敏剂多是芳香共轭结构的疏水分子,存在易聚集、荧光内淬灭和溶解度差的问题[7]。为了改善光敏剂的上述缺陷,研究者们提出了构建负载光敏剂的纳米诊疗载体的思路,这主要归因于肿瘤组织的血管系统与正常组织的差异[8]。正常组织中的血管内皮间隙致密、结构完整;肿瘤血管内皮细胞形状不规则、结构出现渗漏或缺损,血管壁间隙较宽(通常在200 nm到1.2 μm之间)[8]。这造成了大分子类物质和脂质颗粒具有高选择性、高通透性和滞留性,也为粒径小于200 nm的物质进入肿瘤组织提供了可能性[9]。这种现象被称作高渗透长滞留效应(Enhanced permeability and retention effect,EPR)。
纳米载体在血液循环系统中停留时间较长,能有效地递送被负载药物到达目标位置,以减少不良影响,同时因EPR效应,促进了目标细胞对纳米载体摄取[10]。光敏剂被负载在纳米载体后,不仅能改善光敏剂的缺陷,而且促使光敏剂更好地进入肿瘤细胞,延长了体内滞留时间,提高了治疗效果[11]。
2 纳米诊疗载体的类型
2.1 微环境响应型载体
肿瘤细胞在生长和转移的过程中,周围血管组织无法承担肿瘤生长所需氧气和营养物质的供应[12],同时缺氧诱导因子产生低氧反应,导致肿瘤组织呈现低氧状态[13];不仅如此,缺氧诱导因子还诱导了肿瘤细胞代谢从氧化磷酸化到有氧糖酵解的改变[14],这种代谢转换导致乳酸向血管外部分泌,呈现微酸性[15]。这一特性被称作肿瘤微环境。利用肿瘤组织的这一特性,研究人员开展了微环境响应型载体的研究和开发。
2019年PAN等[16]制备了pH响应型纳米胶束。首先,研究人员合成了光敏剂BODIPY衍生物NHS-BODIPY-Br2,如图1所示,通过连接重原子来改善了系间窜越能力[17],并提高活性氧的产率,且在近红外激发光的照射下产生荧光。光敏剂与酸敏多肽偶联,之后自组装得到了用于近红外激发的纳米胶束。自组装的胶束被肿瘤组织摄取,受酸性环境去胶束化形成单分子链,这在一定程度上避免了光敏剂的聚集。细胞实验结果显示,光敏剂的荧光信号在癌细胞内显著增强,说明该纳米胶束具有良好的细胞摄取率,有效地避免药物在血液循环中的渗漏。因而,为了最大程度发挥光敏剂的诊疗特性,合成偶联酸敏感多肽的光敏剂这一思路,是改善光敏剂的荧光自淬灭缺陷的极佳选择。

图1 纳米胶束的合成制备和机制示意图Fig.1 Schematic diagram of the synthesis and mechanism of nanomicelles
为了改善传统癌症诊断手段的局限性,2017年FENG等[18]开发了一种的具有微环境响应和磁共振成像功能的纳米诊疗载体。该课题组合成了两亲嵌段聚合物PCL45-b-PAEP35-Cya/DTPA,如图2所示,将光敏剂二氢卟吩e6 (Chlorin e6,Ce6)和磁共振成像金属Gd3+包封于内。随后,通过静电相互作用,将合成的酸响应型嵌段聚合物PPC-DA(如图2所示)引入到载体表面,完成了制备。纳米诊疗载体作为一个“开关结构”,只对肿瘤的酸性环境做出响应,因此Ce6可以稳定存在正常组织血液系统中。结果显示,载体在肿瘤组织中聚集后,因响应肿瘤酸性环境导致纳米载体分解,Ce6和Gd3+释放。随着细胞对Ce6和Gd3+摄取量增加,MR信号强度增大,荧光强度和PDT效果增强。该课题组的研究结合了传统磁共振成像诊断,使得传统诊断方法更为准确。因此,PDT与传统癌症诊断结合的思路在癌症诊疗中有着巨大潜力。

图2 (A)响应纳米颗粒制备示意图(B)纳米颗粒治疗原理图;化合物1为PCL45-b-PAEP35-Cya/DTPA化合物2为PPC-DAFig.2 (A)Schematic diagram of response nanoparticle preparation(B)Schematic diagram of nanoparticle therapy;Compound 1 is PCL45-b-PAEP35-Cya/DTPA,compound 2 is PPC-DA
研究表明,癌症与炎症有着密不可分的关系[19]。针对这一特性,SADEGHI等[20]制备了可对肿瘤组织中过氧化氢成像纳米脂质体,利用脂质体的亲脂性提高药物的生物利用度[21]。如图3所示,纳米脂质载体由双(2,4,6-三氯苯基)草酸盐(Bis (2, 4, 6-trichlorophenyl)oxalate,TCPO)和疏水性光敏剂姜黄素组成。TCPO与H2O2反应形成高能中间体,中间体分解后释放能量激发姜黄素使其发出荧光。细胞实验表明,纳米脂质体对癌细胞中H2O2作出响应,产生荧光,同时说明脂质体具有较高的细胞摄取率和较高的生物利用度。通过活性氧指示剂,证实了姜黄素被激发产生了对细胞具有杀伤力的活性氧。总的来说,该研究在改善光敏剂PDT效能上做出了创新,使得氧依赖型PDT的光敏剂疗效得到了较大的提高,因此对治疗氧化应激下产生的疾病[22-23]和肿瘤的诊疗具有重要意义。
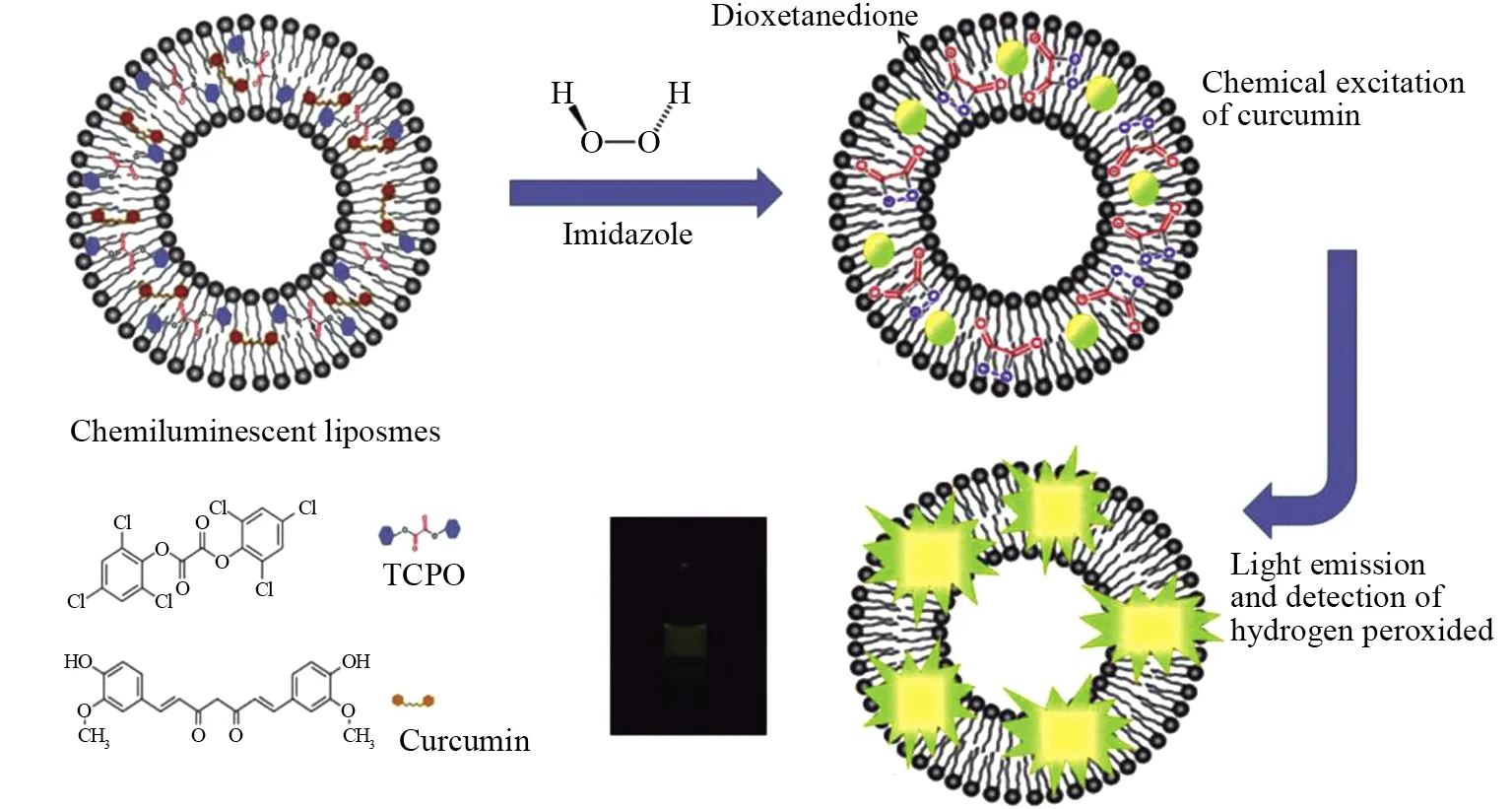
图3 过氧草酸盐-姜黄素化学发光脂质体的示意图Fig.3 Schematic diagram of peroxyoxalate-curcumin chemiluminescent liposomes
2.2 靶向型载体
癌细胞或肿瘤上皮细胞表达了多种特异性分子,包括肽(例如精氨酸-甘氨酸-天冬氨酸肽和表皮生长因子)[24-25]、蛋白质(例如转铁蛋白和抗体)[26-27]、维生素(例如叶酸和生物素)[28-29]等。这些特异性分子与肿瘤细胞的生命活动(如营养物质的摄取)密切相关。利用这一特殊性质,研究人员开展了靶向型载体的研究和开发。
醌氧化还原酶NQO1是许多类型的肿瘤中所表达的酶之一。针对这一特异性酶,2020年YAO等[30]报道了NQO1酶响应囊泡的制备。NQO1响应聚合物囊泡是通过两亲性共聚物的自组装制备的,如图4所示,两亲性在疏水区有香豆素、尼罗蓝光敏剂。由于光敏剂聚集引起的淬灭和光致电子转移淬灭效应,光敏剂的荧光发射处于被抑制状态。囊泡被癌细胞内化后,在NQO1酶的作用下,触发疏水区化学键的断裂同时光敏剂释放。经近红外激发光照射后激活光敏剂,产生荧光和PDT效应。为了探究酶响应囊泡在体内外的激活情况,将钆修饰在囊泡中。结果显示,钆的核磁信号由进入机体和细胞前的微弱到进入后的增强,说明了囊泡完成了分解释药的这一过程。总的来说,NQO1酶响应囊泡是一个优秀的载体,负载光敏剂的NQO1酶响应囊泡具有近红外光动力治疗和成像的潜力。
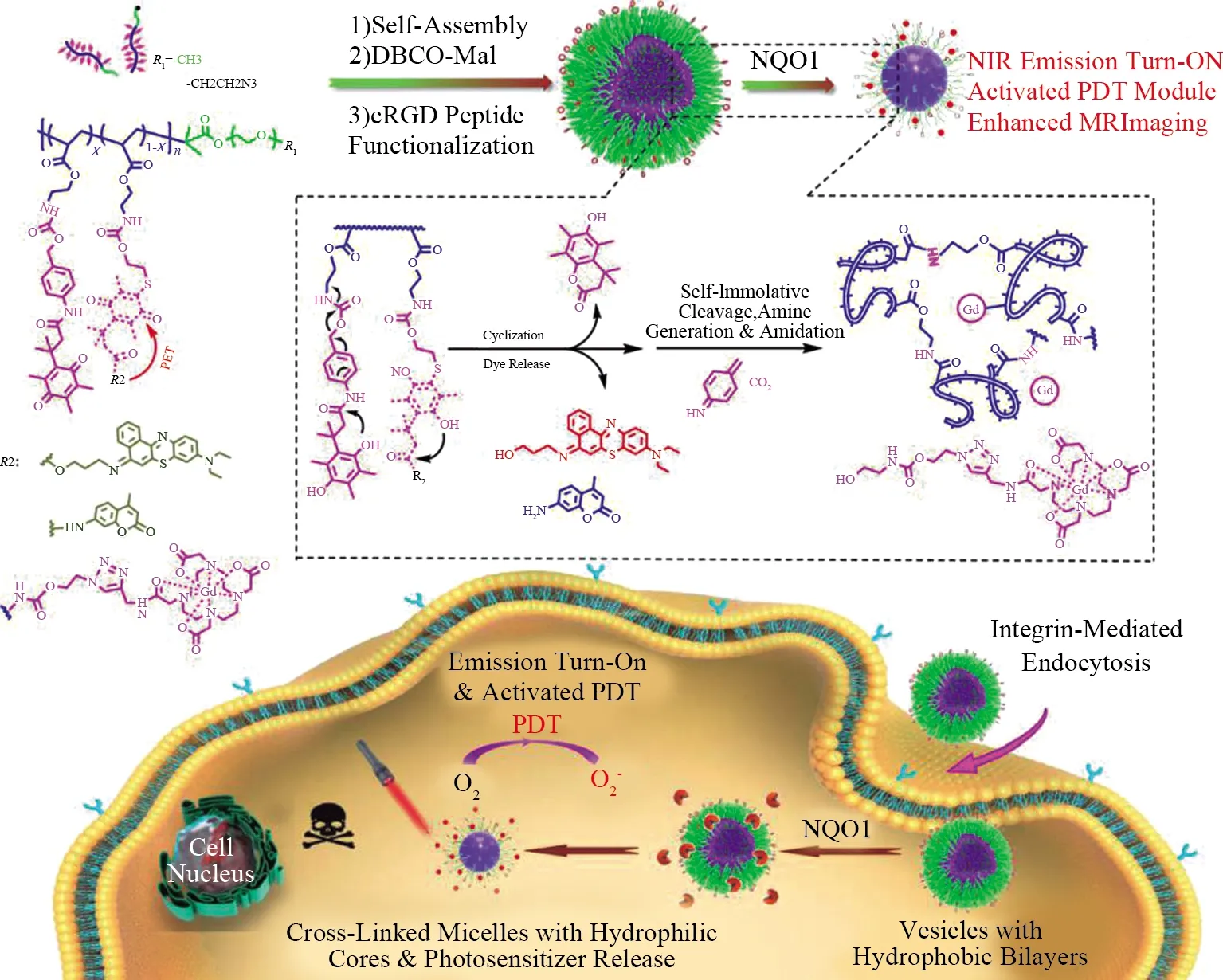
图4 NQO1酶响应型聚合物囊泡的制备示意图和治疗,成像原理图Fig.4 Schematic diagram of preparation and treatment of NQO1 enzyme-responsive polymer vesicles, imaging schematic diagram
KE108肽作为神经内分泌肿瘤靶向配体,可以有效结合肿瘤细胞的生长抑素受体。为此,CHEN等[31]开发了光敏剂与生长抑素受体相结合的肿瘤诊疗载体。如图5所示,纳米载体是由对光敏感的两亲性嵌段共聚物PNBMA-PEG组成,包封了光敏剂Rose Bengal和抗癌药物组蛋白去乙酰化酶抑制剂,之后引入KE108肽和上转换纳米粒子,完成了制备。通过KE108肽纳米载体内化到肿瘤细胞后,上转换材料利用“Anti-Stokes”原理[32],将近红外激发光转换成激发光敏剂的激发光,光敏剂被激发产生荧光和PDT效应,同时经上转换纳米粒子转换后的激发光还可光降解胶束的疏水段PNBMA,从而使药物释放,实现了药物的可控释放。结果显示,引入KE108肽能够显着增强肿瘤细胞摄取。近红外光诱导药物在肿瘤部位的快速释放,并产生了PDT效应;并且与单一化疗药物的对比实验说明了该纳米诊疗载体降低了药物的全身毒性。因此,这种独特的纳米释药载体系统有望成为近红外肿瘤诊疗的优异手段。

图5 (A)UCNPs胶束的治疗示意图和荧光成像(B)近红外引导疏水到亲水的转变 (C)近红外控制的联合疗法示意图和荧光成像Fig.5 (A) Schematic diagram of treatment and fluorescence imaging of UCNPs micelles (B) Near infrared guides the transition from hydrophobic to hydrophilic (C) Schematic diagram of near-infrared controlled combination therapy and fluorescence imaging
病毒粒子(病毒体)是平均直径约为150 nm的球形单层囊泡。它们由重组的病毒包膜组成,没有源病毒的遗传物质,可以作为靶蛋白的天然靶向载体[33]。具有中性磷脂双分子层的病毒体可用作为药物载体,它们通过血凝素附着于靶细胞[34],随后,病毒体被细胞内吞吸收。为此,LOW等[35]制备了一种基于病毒体的诊疗载体用于包载光敏剂Ce6。该载体上有表皮生长因子受体(Epidermal growth factor receptor,EGFR)的配体,因此可特异性识别口咽部鳞状细胞癌(Oral squamous cell carcinoma,OSCC)表达的EGFR受体。该研究进行了体内外实验,评估了OSCC细胞中的细胞摄取率、荧光成像效果和光动力效应。结果显示,与游离Ce6相比,被载体包封后的Ce6能更好地被OSCC细胞摄取,说明了该载体的肿瘤特异性;OSCC细胞中Ce6高于正常细胞,表明载体可成功靶向OSCC细胞,正常细胞与癌细胞的荧光成像对比结果突显了其优秀的成像诊断潜力。这项研究展示了病毒粒子作为载体的优越性,为Ce6相关纳米制剂的研究做出了贡献。
2.3 改善荧光淬灭型载体
光敏剂存在易聚集性,导致了荧光内淬灭的问题。如何改善这一问题,提高光敏剂荧光量子产率,是一个值得去思考的问题。为此,研究人员开展了改善荧光淬灭型载体的研究和开发。
2020年LIN等[36]提出了脂质体可改善光敏剂荧光内淬灭的理论。课题组制备了叶酸偶联的脂质载体,该脂质体用于包封光敏剂锌酞菁衍生物PcN。如图6所示,以二棕榈酰磷脂酰胆碱,胆固醇,叶酸修饰的二硬脂酰基磷脂酰乙醇胺-聚乙二醇为材料,采用薄膜分散法制备了脂质载体并负载PcN,对包封率载药量、光学性质等进行了考察。体外荧光成像实验结果显示,制备的叶酸偶联脂质载体具有对肿瘤细胞的靶向性;同时,光学性质实验结果证明了脂质体可改善光敏剂的聚集性,不仅提高了光敏剂的荧光强度和荧光量子产率,也保证了在水溶液中的光活性,进而提高了光敏剂荧光成像诊断的效果。小鼠实验结果显示,对肿瘤抑制率高达98%。因此,该研究不仅证实了脂质体可改善光敏剂内淬灭的缺陷,且有望成为肿瘤诊断和靶向PDT重要手段。

图6 PcN@lip-FA的制备Fig.6 Preparation of PcN@lip-FA
金属-有机骨架(Metal Organic Framework,MOF)是由金属离子或金属氧化物与有机配体在合适的溶剂中配位而成。它们具有许多优点,如高比表面积、易于修饰等[37]。为此,DING等[38]报道了以2-甲基咪唑,乙酸锌为MOF原料,细胞色素C(Cytochrome C)作为过氧化氢催化剂,和透明质酸共同制备了MOF纳米诊疗载体,并负载Ce6。通过对光学性质,体内外实验等的探究,来证实载体的诊疗效果。光学性质结果显示MOF的包封使得Ce6聚集问题得到了良好改善,并且在酸性水介质中荧光强度比中性环境要强,说明该MOF载体是一种酸性响应释药的载体。体内外实验结果显示,该MOF响应酸性微环境后解体释放Ce6,并且细胞色素C通过分解过氧化氢产生氧气,改善了肿瘤缺氧环境,提高了Ce6的PDT的效应。因而可以看出,利用pH响应MOF负载药物思路,为改善光敏剂缺陷,是一种具有前途的治疗策略,为制备高效PDT纳米诊疗载体提供了参考。
2017年DUO等[39]提出了聚集诱导发光(Aggregation-Induced Emission, AIE) 与化学发光相结合的诊疗理念,规避了常规光敏剂的聚集淬灭问题。首先,合成了聚集诱导发光的光敏剂TBD,如图7所示,以泊洛沙姆407为纳米胶束材料,Soybean oil为化学发光延迟剂,制备了包封TBD的化学发光胶束,并进行化学发光性能和体内外PDT的考察。光学性质实验结果显示,该TBD具有优秀的化学发光性能,能被过氧化氢-草酸酯体系所激发。体内外实验结果表明,该纳米胶束具有优秀的肿瘤抑制效果,并且小鼠肿瘤转移模型的实验结果说明了该化学发光胶束能够精准定位转移后的肿瘤细胞和组织。综上所述,该课题组研究成果不仅改善了常规光敏剂的聚集荧光淬灭问题,并且在肿瘤转移诊断上做出了巨大突破,为影像引导肿瘤治疗提供了一种新的策略。
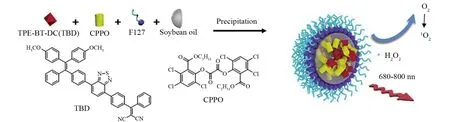
图7 C-TBD纳米粒的制备Fig.7 The preparation of C-TBD NPs
3 总结与展望
本文介绍了近5年基于光敏剂的肿瘤微环境响应型、靶向型、改善荧光淬灭型的纳米诊疗载体的研究成果。它们的优点为:1) 通过纳米载体的包封负载或合成新的光敏剂,改善了光敏剂疏水性、易聚集性、荧光淬灭的缺点;2) 响应肿瘤微环境并释放药物,达到提高PDT和成像诊断效果的目的;3) 可靶向肿瘤细胞,通过与靶点结合将光敏剂内化到细胞,达到精准成像诊断和治疗的目的。这些纳米诊疗载体优势促使光敏剂具备了优秀的诊疗潜力,但目前仍然缺少临床实验数据给予证明。坚信随着光敏剂和纳米材料等其他学科的融合与发展,光敏剂或将承担癌症诊疗的重要角色。
