NLR、PLR和LMR在急性肺栓塞住院期间预后的价值
2021-08-19闫丹丹史家欣李家树
闫丹丹 史家欣 李家树
肺栓塞的最常见形式就是肺血栓栓塞,通常是由于在腿部深部血管中形成的血凝块分离后进入静脉循环所致[1]。肺栓塞年发生率为39~115例/10万,纵向研究中年发生率有上升的趋势,短期病死率高达16%[2,3]。对急性肺栓塞(acute pulmonary embolism, APE)患者进行预后评估,能及早发现预后不良的高风险患者,从而降低死亡风险。近年来中性粒细胞淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)、血小板淋巴细胞比值(platelet-lymphocyte ratio, PLR)和淋巴细胞单核细胞比值(lymphocyte-monocyte ratio, LMR)被认为是新的全身炎性标志物,是各种急性心血管疾病早期不良预后的预测因子[4,5]。本研究探讨炎性指标及其联合对评估APE住院期间预后的价值,以期探寻能在基层普及使用的指标。
对象与方法
1.研究对象:电子病历检索2013年1月~2020年6月在徐州医科大学附属连云港医院出院诊断为肺栓塞或肺血栓栓塞症的患者共998例。符合入组的APE患者共101例。已通过徐州医科大学附属连云港医院医学伦理学委员会的审查(伦理号:LW-20210719001-01)。
2.纳入与排除标准:APE的诊断符合2018年中华医学会呼吸学分会《肺血栓栓塞诊治与预防指南》[6]。纳入标准:①经CT肺动脉造影确诊为APE;②临床资料完整。排除标准:①慢性肺栓塞或复发性肺栓塞;②合并血液系统疾病或入院前1周有输血治疗;③长期接受抗凝或抗血小板聚集治疗(≥1个月);④长期使用免疫抑制剂;⑤合并晚期肝脏、肾脏疾病;⑥1个月内发生急性冠状动脉综合征、充血性心力衰竭。
3.分组:根据住院期间有无不良事件发生,将患者分为预后良好组和预后不良组。满足下列状况之一为临床不良事件:①机械通气;②心脏突发停搏等需心肺复苏;③需要溶栓药物;④需要儿茶酚胺等血管活性药物维持血压;⑤出现临床死亡[7]。
4.数据收集:收集患者的性别、年龄、治疗前白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板计数、单核细胞计数、血小板分布宽度、红细胞分布宽度、嗜酸性粒细胞、D-二聚体、肌钙蛋白I、白蛋白、谷丙转氨酶、谷草转氨酶、肌酐、活化部分凝血活酶时间、高密度脂蛋白、胆固醇、甘油三酯、右心室扩大情况、肺动脉收缩压和栓塞部位,计算NLR、PLR和LMR值。栓塞分型:根据CT肺动脉造影,栓子位于左/右肺动脉及以上为中央型肺栓塞,位于肺叶、叶间、段及亚段肺动脉为周围型肺栓塞。

结 果
1.不同住院期间预后患者临床特征比较:住院期间预后良好组70例,预后不良组31例。预后不良组患者年龄>60岁、肌钙蛋白I升高、中央型肺栓塞、右心室扩大人数所占比例显著高于预后良好组,白细胞计数、中性粒细胞计数、血小板计数、NLR、PLR、红细胞分布宽度、D-二聚体、甘油三酯和肺动脉收缩压水平明显高于预后良好组,差异均有统计学意义(P<0.05)。其余指标在两组间比较差异无统计学意义(P>0.05,表1)。

表1 不同住院期间预后患者临床特征比较[n(%), M(Q1,Q3)]
2.影响住院期间预后不良的多因素Logistic回归分析:以住院期间预后不良(预后良好=0,预后不良=1)为因变量,以年龄>60岁、白细胞计数、红细胞分布宽度、NLR、PLR、D-二聚体、肌钙蛋白I升高、甘油三酯、右心室扩大、肺动脉收缩压、栓塞分型为自变量,采用条件向前法分别建立二元Logistic回归方程。结果显示,白细胞计数、NLR、PLR、右心室扩大和中央型肺栓塞在模型中比较,差异均有统计学意义(P<0.05),为预后不良的危险因素(OR>1,P<0.05,表2)。
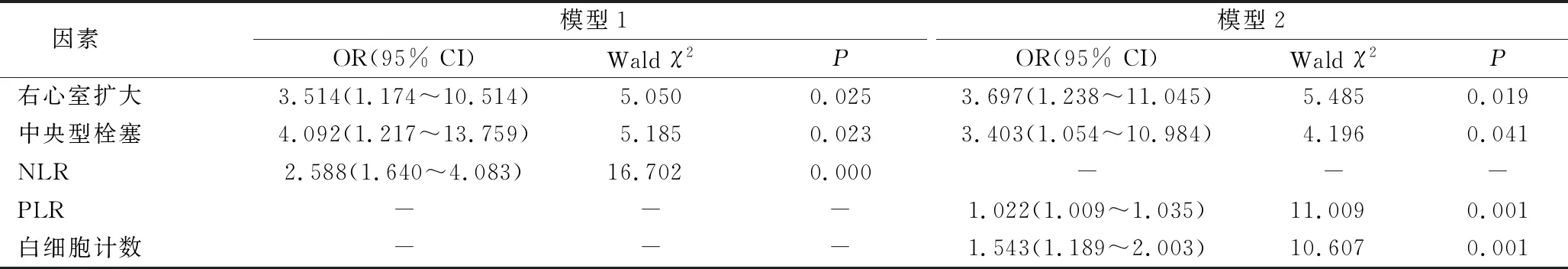
表2 影响住院期间预后不良的Logistic回归分析
3.NLR、PLR预测住院期间预后不良的ROC曲线分析:NLR、PLR、NLR联合PLR(NLR+PLR)对住院期间预后不良的ROC下面积分别为0.825、0.758和0.833(P<0.05,表3)。其中,NLR联合PLR预测预后不良的面积最大(图1)。

图1 NLR、PLR预测患者住院期间预后不良的ROC曲线分析
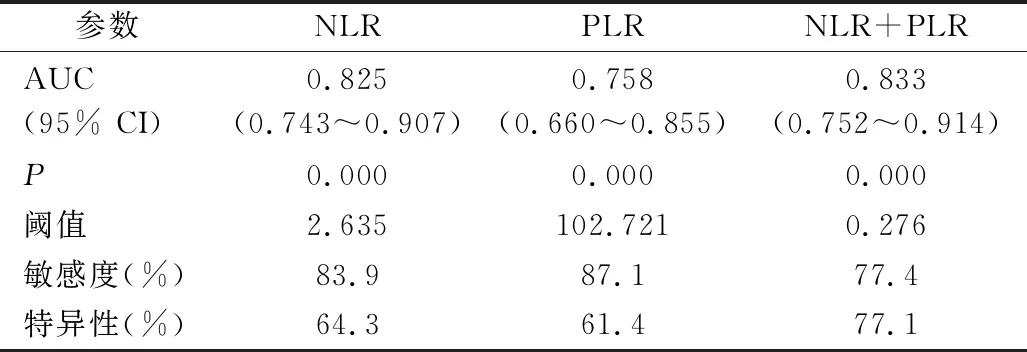
表3 NLR、PLR预测患者住院期间预后不良的ROC曲线
讨 论
APE病死率约为15%~20%,及时评估和治疗是APE患者成功转归的关键[8]。但基层医院中受到各种条件的限制,传统参数在日常实践中的适用性较差,可能导致治疗延迟。因此,研究者不断寻找新的评估病情及预后的指标。
血栓进入肺动脉后即刻触发APE,增加促凝因子的释放,抑制自然抗凝途径和纤溶活性,还触发炎性细胞因子的释放。APE还可能引起再灌注损伤,增加氧化应激、肺组织中髓过氧化物酶和活性氧。肺动脉阻塞引起的严重缺氧可能会增加神经激素和肾上腺能系统的活性,诱导炎性细胞因子释放[9]。上述结果提示炎症在APE的发病中起重要作用。活化的炎性细胞(如白细胞、中性粒细胞、淋巴细胞和单核细胞)、促炎性细胞因子和血小板是重要的参与者[10]。
模型1纳入年龄>60岁、红细胞分布宽度、白细胞计数、D-二聚体、甘油三酯、肌钙蛋白I升高、右心室扩大、肺动脉收缩压、栓塞分型和NLR;模型2纳入年龄>60岁、红细胞分布宽度、白细胞计数、D-二聚体、甘油三酯、肌钙蛋白I升高、右心室扩大、肺动脉收缩压、栓塞分型和PLR当肺动脉血流受限的时候,白细胞迅速滚动并黏附于内皮细胞,白细胞与活化的内皮细胞相互作用是APE的主要事件[11]。Venetz等[12]对14228例肺栓塞的患者行回顾性研究发现,白细胞增加是短期预后不良的预测因子。笔者的结果同上述一致。白细胞的升高提示血液的高凝状态,血液的高凝状态与局部炎性反应相互作用,产生级联放大作用,促进血栓的形成发展[13]。
近年来白细胞亚型间的比值被认为是一种新的炎性指标。当血栓阻塞静脉血管时,中性粒细胞是最早被吸引到血栓中的一个亚型。淋巴细胞在栓塞过程中起调节作用,淋巴细胞计数的减少可导致白细胞介导的高凝状态增强。国外一项研究发现,NLR水平升高与APE患者预后不良相关,排除合并症后进行亚组分析,发现NLR是不伴合并症APE患者预后的独立危险因素[14]。Ma等[15]进行的研究中NLR也是APE预后的独立预测因子。本研究结果也支持这一结论,NLR对住院期间预后不良的ROC下面积为0.825。NLR较单一的白细胞更适合预测心血管疾病的预后,因为它稳定性高,且两个亚型来自互补的两个调控系统[16]。中性粒细胞在血栓病灶释放中性粒细胞外陷阱,其是高度促炎和促进血栓形成的纤维,能诱捕白细胞并传播血栓的形成。相反,淋巴细胞作为适应性免疫系统的组成部分,能够抑制和限制炎性反应[17]。
肺动脉栓塞时,肺局部缺血引起活性氧产生,促进血小板的活化并引起黏附分子P-选择素在血小板和内皮细胞迅速表达,强化了血小板的活化和对血管壁的黏附。黏附于缺血后血管内皮的血小板通过释放自由基和炎性介质引起肺组织损伤,这些物质参与缺血后白细胞的募集[18]。Wang等[19]开展的研究发现,高水平PLR和短期病死率显著相关。Yazici等[20]研究显示,高PLR组预测总病死率的敏感度为60.6%,特异性为83.2%。本研究中PLR对住院期间预后不良有中等程度预测价值,敏感度为87.1%,特异性为61.4%。Ertem等[21]研究发现PLR不能用于患者的预后评估。推测与各研究设计方案的差异存在一定关联。此外,考虑到血小板和淋巴细胞的活化受到并发症的影响,推测与NLR比较,PLR或许不是判断APE患者预后的良好指标。但是NLR联合PLR检测住院期间预后不良的面积最大,为0.833,较单纯的NLR和PLR具有更高的临床价值。
综上所述,NLR和PLR可用于APE患者住院期间预后评估,NLR和PLR两者的联合应用能提高预测短期预后的特异性,但这个结论需要前瞻性、大型多中心队列研究来进一步证实。本研究的不足之处在于为回顾性的研究,样本量少,且没有动态地随访观察上述指标对APE患者疾病进展及疾病管理的影响,这为接下来的研究提供了方向。此外,本研究为探寻APE患者的抗炎靶向治疗研究开辟了新思路。
