血清淀粉样蛋白A通过LOX-1促进系膜细胞摄取脂质
2021-08-19郝怡然陈逸歌刘梦妤
郝怡然 陈逸歌 李 彧 刘梦妤 刘 华
临床研究发现各种肾脏疾病常伴有炎性反应,而炎症促进肾小球硬化的发生、发展[1]。血清淀粉样蛋白A(serum amyloid A,SAA)作为强效炎性因子,在炎症和脂质代谢中起关键作用[2]。SAA检测有助于多种疾病的诊断和预后评估,如类风湿关节炎、动脉粥样硬化、肥胖、糖尿病肾病(diabetic kidney disease,DKD)[3~6]。最近的证据显示SAA是炎症通路的中枢介质,SAA水平在DKD早期升高,促进肾小球硬化和肾间质纤维化[7]。高脂血症常伴发于多种肾脏疾病,如肾病综合征,是促进肾小球硬化的危险因素[8]。炎性因子可能与脂质失衡共同参与了肾小球硬化的进展,观察炎性因子对细胞脂质稳态的影响是探讨脂质介导肾损伤的关键[9]。氧化低密度脂蛋白(oxidised low-density lipoprotein, Ox-LDL)植物血凝素样受体1(lectin-like oxidised low-density lipoprotein receptor 1, LOX-1)在炎症和脂质代谢紊乱相关性疾病的发生、进展中发挥重要作用[10~12]。炎性因子SAA对人肾小球系膜细胞(human mesangial cells,HMCs)LOX-1受体及脂质代谢的相关研究较少。本研究通过观察SAA对HMCs摄取脂质及LOX-1受体表达的变化,探讨炎症在细胞水平影响HMCs脂质稳态的病理、生理机制。
材料与方法
1.材料:RPMI1640培养液及胎牛血清(Foetal calf serum,FCS)(美国Gibco Life Technologies 公司),人肾小球系膜细胞由英国皇家医学院肾脏病中心阮雄中教授惠赠,SAA(美国Peprotech Technologies公司)、Ox-LDL(中国医学科学院基础研究所)、油红“O”(美国Sigma-Aldrich公司),荧光Dil-Ox-LDL (美国Biomed Technologies公司)、LOX-1抗体(美国R&D Systems公司)。PCR反应体系、反转录酶缓冲液(美国Promega Corporation公司)、dNTP、Oligo(dT)、引物(上海生物工程有限公司)合成,LOX-1引物序列:上游引物:5′-ACAGAGGCCATTCCGAAATCA-3′,下游引物:5′-GGTAGAGTCTGGAGATGGACCACA-3′。GAPDH 引物序列:上游引物:5′-GCACCGTCAAGGCTGAGAAC -3′,下游引物:5′-ATGGTGGTGAAGACGCCAGT -3′。
2.HMCs的培养:用10%FCS的RPMI1640培养液在5%CO2培养箱37℃培养HMCs,0.01mol/L PBS冲洗,0.25%胰蛋白酶/0.025 EDTA消化,10%FCS的RPMI1640培养液悬浮细胞传代培养。
3.油红“O”染色:培养HMCs (5×104个/毫升)至亚融合状态,静止后将细胞随机分组,对照组(0.2% RPMI1640)和SAA处理组(5ng/ml SAA+0.2% RPMI1640),加入Ox-LDL(40mg/L)继续培养24h,油红“O”染色后观察摄片。
4.流式细胞计数:培养HMCs至亚融合状态,静止后将细胞随机分组,对照组、SAA组(5ng/ml SAA)和LOX-1受体阻断+SAA组(2ng/ml 抗LOX-1抗体+5ng/ml SAA,抗LOX-1抗体提前2h应用),孵育12h各组加入10mg/L的荧光Dil-Ox-LDL,继续培养5h。PBS重复冲洗、消化、离心,制成细胞悬液,流式细胞仪计数6000个细胞,计算各组细胞内平均荧光值。
5.实时定量PCR测定:培养HMCs至亚融合状态,静止后随机分为3组,分别用含0、5、10ng/ml SAA的培养基,培养12h后收获细胞,提取总RNA,合成cDNA,25μl反应体系进行PCR扩增,95℃10s,95℃15s,60℃30s,共扩增45~50个循环。
6.Western blot法检测:培养HMCs至亚融合状态,静止后随机分为3组,分别用含0、5、10ng/ml SAA的培养基,培养12h后收获细胞,提取总蛋白。上样100μg蛋白质电泳,转膜1h,封闭缓冲液过夜,0.2ng/L一抗与膜孵育,室温缓慢振荡2h,洗膜,1∶5000二抗室温缓慢振荡1h,洗膜,ECL显影。

结 果
1.SAA促进HMCs对Ox-LDL的摄取:油红“O”染色发现HMCs摄取Ox-LDL,SAA组较对照组细胞内红染颗粒明显粗大、增多,提示SAA增强HMCs对Ox-LDL的摄取(图1)。
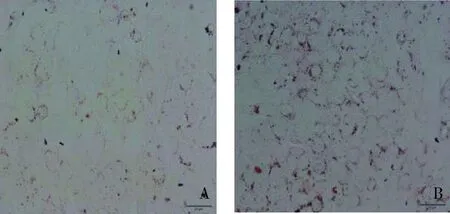
图1 SAA(5ng/ml)促进HMCs对Ox-LDL的摄取(油红“O”染色,×200)A.对照组;B.SAA刺激组
2.流式细胞仪计数:HMCs摄取Dil-Ox-LDL,对照组HMCs平均荧光值为8.6,SAA组细胞内平均荧光值为51.9,为对照组的6.03倍,提示SAA促进HMCs摄取Dil-Ox-LDL,应用抗LOX-1共孵育2h,阻断组细胞内平均荧光值为41.2,为对照组的4.79倍,降低为单纯SAA刺激组的79.3%(图2)。
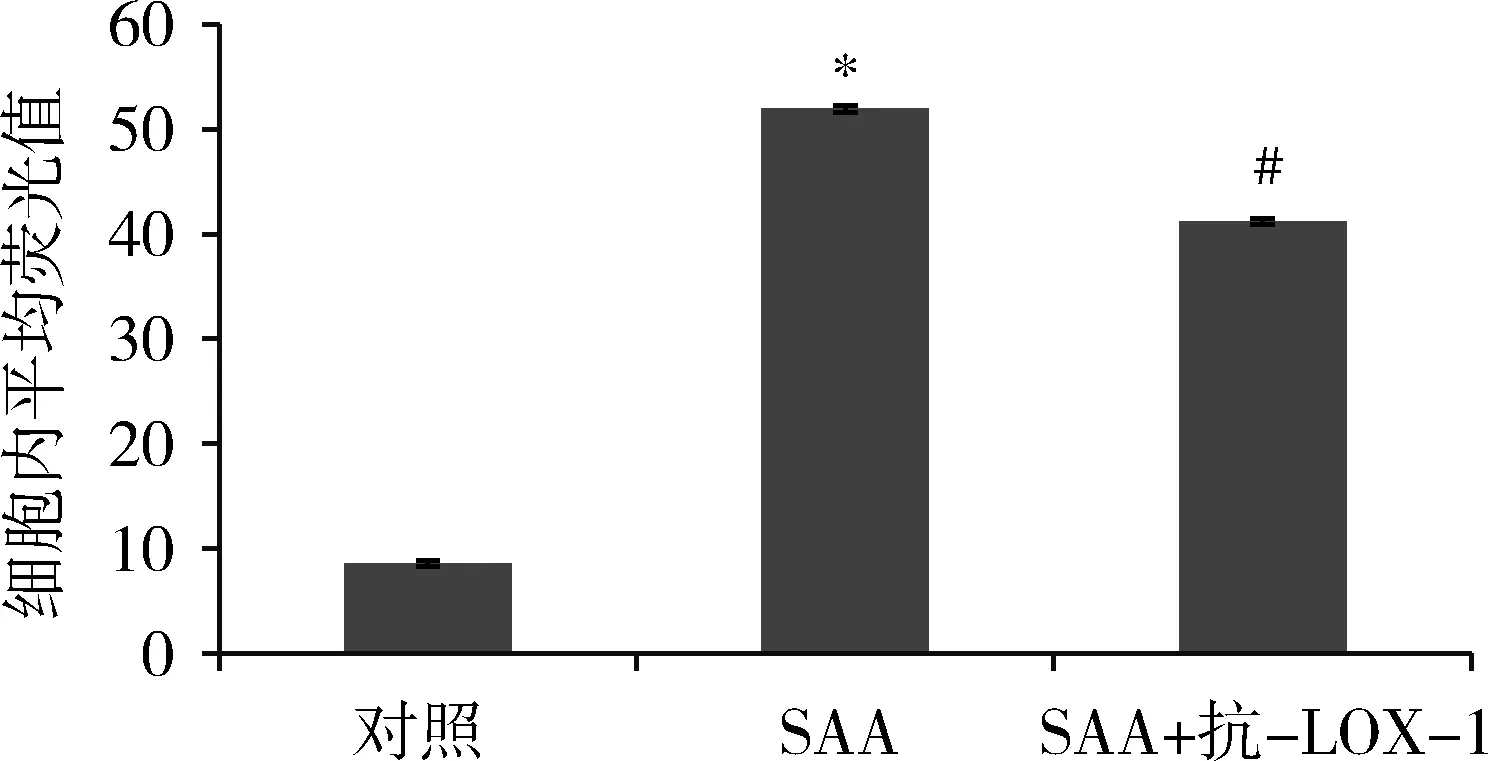
图2 SAA刺激及抗LOX-1抗体对HMCs摄入Dil-Ox-LDL的影响与对照组比较,*P<0.05;与SAA组比较,#P<0.05
3.SAA对LOX-1 mRNA表达的影响:SAA促进LOX-1 mRNA的表达。用0、5、10ng/ml SAA刺激HMCs 12h,5ng/ml SAA组LOX-1 mRNA水平升高为对照组的5.12倍,10ng/ml SAA组LOX-1 mRNA水平达高峰,为对照组的6.97倍(图3)。

图3 不同浓度SAA作用12h对LOX-1 mRNA表达的影响与0ng/ml比较,*P<0.05
4.SAA对LOX-1 蛋白表达的影响:SAA促进LOX-1蛋白的表达。用0、5和10ng/ml SAA刺激HMCs 12h,5ng/ml SAA组LOX-1蛋白水平升高为对照组的2.61倍,10ng/ml SAA组LOX-1蛋白水平达高峰,为对照组的3.15倍(图4)。

图4 不同浓度SAA作用12h对LOX-1蛋白表达的影响与0ng/ml比较 *P<0.05
讨 论
研究表明,原发和继发性肾脏疾病常伴发炎性状态,如IgA肾病、狼疮性肾炎,抗炎治疗是有效的治疗措施[13]。SAA作为急性时相反应蛋白,在炎性反应中迅速升高,并参与慢性炎性疾病的发展。流行病学研究发现,类风湿关节炎、代谢综合征、冠状动脉粥样硬化和DKD患者中SAA水平显著升高[14~17]。近年来研究发现SAA诱导巨噬细胞形成泡沫细胞,抑制胆固醇的逆向运输,导致细胞内脂质失衡,促进动脉粥样硬化的形成[18]。因此炎性因子SAA与高脂血症共同参与了动脉粥样硬化的发病机制。肾脏疾病常表现为炎性状态,高脂血症是肾脏疾病的独立致病因素,因此研究炎症导致细胞脂质失衡的机制是阐明脂质介导肾损伤的关键路径,目前炎性因子SAA是否影响HMCs脂质稳态尚不明确。
SAA可能通过LOX-1途径促进HMCs摄取Ox-LDL影响细胞内脂质稳态。既往研究表明肾小球硬化与动脉粥样硬化类似,是多种细胞因子参与的慢性炎症过程。HMCs在生理条件下摄取Ox-LDL,通过自我调节与脂质代谢相关受体的表达,维持细胞内脂质平衡。炎性因子可以打破脂质水平介导的负反馈调节,导致大量摄入脂质,最终超过其清除能力形成泡沫细胞[19]。高脂血症的程度与肾小球硬化的程度不平行,近期研究显示炎症是加重脂质异常导致肾损害的关键[20]。本研究表明,炎性因子SAA促进HMCs摄取大量Ox-LDL,脂质过度积聚导致泡沫细胞形成,HMCs来源的泡沫细胞可进一步释放细胞因子导致肾小球硬化,提示炎性因子SAA在细胞水平影响脂质稳态[21]。LOX-1作为Ox-LDL的重要受体,能特异性结合Ox-LDL,在内皮细胞、巨噬细胞、血管平滑肌细胞、成纤维细胞和其他细胞中广泛表达。既往研究已经证实,Ox-LDL可以正反馈刺激自身LOX-1受体,炎性因子进一步促进LOX-1表达,LOX-1-Ox-LDL通路可激活核因子-κB(NF-κB)等细胞因子,引发瀑布级联样炎性反应[22]。本研究表明,SAA促进HMCs摄取Ox-LDL,而抗LOX-1抗体可部分阻断对Ox-LDL摄取,提示SAA可通过LOX-1受体途径刺激HMCs摄取大量Ox-LDL。因此,SAA促进HMCs通过LOX-1途径摄取过度脂质,诱导转化生长因子-β等细胞因子表达,促进肾小球细胞增殖,提示LOX-1在肾小球硬化进展中发挥关键作用[23]。
LOX-1是Ox-LDL的重要受体和关键炎性因子,SAA作为强有力的炎性介质促进LOX-1表达。研究发现SAA作为炎性因子在多种组织和细胞发挥促炎作用,导致代谢紊乱和动脉粥样硬化的形成。通过对肥胖患者的观察发现,SAA水平可间接反映胰岛素抵抗的程度。SAA可以抑制胆固醇的逆向运输升高血浆胆固醇浓度,进一步促进动脉粥样硬化的形成。因此,SAA作为代谢综合征和炎症相关疾病的危险因素得到广泛重视。越来越多的证据表明,炎症是DKD发生、发展的关键环节,SAA与DKD患者组织学严重程度相关,显著参与DKD的进展。SAA在高糖条件培养的足细胞和系膜细胞表达上调,进一步诱导炎性反应促进DKD特征性损害。因此,SAA介导的炎症信号通路成为DKD新的生物学标志物和潜在的治疗靶点。SAA结合高密度脂蛋白通过NF-κB途径刺激低密度脂蛋白受体缺陷小鼠肾脏LOX-1表达,促进肾脏纤维化。高糖通过磷酸化丝裂原活化蛋白酶P38途径诱导LOX-1的表达,增强Ox-LDL诱导的肾小管间质细胞凋亡,为DKD的分子机制研究提供了新思路。抗LOX-1治疗可能是逆转血脂异常和DKD致病因素的有效方法,因此LOX-1在糖尿病和慢性肾脏病进展中发挥关键作用[23]。本研究提示SAA可能通过LOX-1途径增强Ox-LDL摄取,促进LOX-1表达,导致HMCs脂质失衡转化为泡沫细胞,表明与动脉粥样硬化发病机制类似,SAA水平升高是肾小球硬化的危险因素,阻断或拮抗SAA和LOX-1相关炎症通路可能延缓DKD进展。
综上所述,炎性因子SAA通过LOX-1受体途径促进Ox-LDL摄取,而抗LOX-1抗体可降低对Ox-LDL摄取,SAA进一步促进LOX-1 mRNA和蛋白的表达。因此,炎性因子SAA通过增强LOX-1受体表达促进脂质的摄取,影响细胞内脂质稳态,进一步可激活多种细胞因子,促进炎性反应加重脂质肾损害。SAA水平升高可能是DKD发展的危险因素和生物学标志物,然而仍需进一步研究阐明具体致病机制,阻断相关炎症通路及脂质代谢紊乱将是治疗肾小球硬化的新靶点。
