西洋参茎叶总皂苷对多囊卵巢综合征伴胰岛素抵抗大鼠的作用效应及机制研究
2021-08-19王景尚尹晓丹辛明蔚李宪锐何军琴
王景尚 尹晓丹 辛明蔚 武 颖 李宪锐 何军琴
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄女性常见的一种生殖功能障碍与糖代谢异常并存的内分泌紊乱性疾病。据统计,我国育龄女性的发生率为5%~10%,是严重威胁我国女性生殖健康的重要原因之一,其中高达50%~70%的患者伴有胰岛素抵抗(insulin resistance,IR)[1]。由于具有高发性、异质性、终身性、难治性等特点,多囊卵巢综合征伴胰岛素抵抗(polycystic ovary syndrome rats with insulin resistance, PCOS-IR)患者已成为临床和基础研究的热点及难点[2,3]。目前,临床上多采用胰岛素增敏剂治疗PCOS-IR患者,尽管可有效改善患者IR、降低雄激素水平并在一定程度上恢复排卵,但也存在不良反应较多、不能长期应用且停药后复发率高等不足[4]。近年来,中药及其有效成分在治疗PCOS、糖尿病及改善IR等方面的作用逐渐受到关注,为PCOS-IR治疗药物的开发提供了新的思路[5]。
西洋参茎叶总皂苷(panax quinquefolius saponin of stem and leaf,PQS)是西洋参的主要有效部位,广泛应用于糖代谢异常及其心血管疾病的治疗。笔者课题组前期研究显示,PQS对糖代谢异常及其并发症有很好的疗效,不仅可以降糖,还可显著增加胰岛素敏感度、改善IR、抗细胞凋亡[6]。那么,PQS对于PCOS-IR是否具有相似治疗效应?其机制如何?目前尚不清楚。为此,笔者开展了本研究,结果证实PQS能够显著纠正PCOS-IR模型大鼠的IR状态、改善卵巢多囊样改变,其机制可能与激活PI3K/Akt通路,调控Bcl-2、Bax表达有关。
材料与方法
1.材料:40只21~23日龄SPF级雌性SD大鼠,体质量60±10g,购自北京大学实验动物中心。高糖高脂饲料购自北京科澳协力饲料有限公司,含猪油20%、蔗糖10%、胆固醇1.25%、胆酸盐0.25%,普通饲料68.5%。PQS购自吉林省集安益盛药业股份有限公司,来曲唑购自大连美仑生物技术有限公司;血清促卵泡生成素(follicle-stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)、睾酮(testosteroneT)、空腹胰岛素(fasting insulin,FINS)ELISA试剂盒均购自上海酶联生物科技有限公司;Akt、p-Akt、PI3K、p-PI3K、Tubulin抗体均购自Abcam;大鼠Bax、Bcl-2免疫组化试剂盒购自上海彩佑实业有限公司。
2.PCOS-IR模型构建及给药:大鼠普通饲料适应性喂养1周后,随机选取10只作为正常对照组,其余30只作为PCOS-IR模型组。对照组给予普通饲料,模型组给予高糖高脂饲料喂养28天。于喂养第8天,模型组大鼠开始每日用0.4ml溶于1%羧甲基纤维素溶液的来曲唑液[1mg/(kg·d)]灌胃,对照组灌服0.4ml 1%羧甲基纤维素溶液。自灌胃第7天开始每天早晨行阴道涂片,观察阴道脱落细胞的周期变化,判断动情周期。连续观察至第21天,模型组大鼠均丧失完整动情周期。将造模成功大鼠随机分为模型组、PQS高剂量组和PQS低剂量组,其中PQS低剂量组和PQS高剂量组分别进行PQS 30mg/kg、PQS 60mg/kg灌胃治疗,对照组和模型组进行等剂量蒸馏水灌胃,连续干预4周。
3.样本收集:模型组、PQS高剂量、PQS低剂量组大鼠灌胃结束后,在取材前一晚20:00时开始禁食禁水,次日用1%水合氯醛麻醉,尾静脉采血,用罗氏血糖仪测定空腹血糖(fasting blood glucose,FBG)水平并记录。随后经腹主动脉取血,收集血清标本置-80℃保存备用。摘取双侧卵巢,一侧放入4%多聚甲醛液固定,另一侧放入冻存管中,置于液氮罐储存,12h后转移至-80℃冰箱保存。对照组待大鼠均处于动情前期时,结束喂食,依照前法进行取血取材,以观察基础卵泡及性激素水平变化。
4.大鼠血清性激素水平测定:取大鼠血清,采用ELISA法测定大鼠血清卵泡刺激素(FSH)、促黄体生成素(LH)、睾酮(T)水平,具体操作严格按试剂盒说明书进行。
5.胰岛素水平测定及胰岛素抵抗程度评估:ELISA法测定空腹胰岛素(FINS)水平。采用HOMA-IR指数评估IR程度,HOMA-IR指数计算方法:空腹血糖水平(FPG,mmol/L)×空腹胰岛素水平(FINS,mU/L)/22.5。
6.HE染色法观察大鼠卵巢组织学形态:取出经4%多聚甲醛固定的卵巢组织,常规组织脱水,石蜡包埋;将卵巢组织切成5μm厚切片,常规脱蜡、水化后经苏木精-伊红(HE)染色,光学显微镜下观察各组大鼠卵巢组织病理学变化。
7.大鼠卵巢组织 Bax及Bcl-2的表达测定:免疫组织化学染色法测定大鼠卵巢组织中Bax及Bcl-2的表达,具体操作严格按照说明书进行。
8.Western blot法检测卵巢组织中PI3K、p-PI3K、Akt、P-Akt表达:提取卵巢组织总蛋白,采用SDS PAGE凝胶电泳,然后将蛋白转至PVDF膜,将PVDF膜放入封闭液(TBST /5% 脱脂奶粉)中,室温封闭0.5h。分别加入一抗tubulin、PI3K、p-PI3K、Akt、p-Akt孵育液4℃过夜,再与相应二抗室温孵育1h;再用TBST漂洗,ECL显影。使用Quantity one软件对其进行吸光度分析,以第1个孔的数值/tubulin的比值做为1。

结 果
1.PQS对PCOS-IR模型大鼠胰岛素功能的影响:与正常组比较,模型组大鼠血清FINS水平及HOMA-IR指数均显著升高(P<0.01);与模型组比较,PQS高、低剂量组大鼠血清FINS水平及HOMA-IR指数均显著降低(P<0.01,图1)。

图1 各组大鼠FBG、FINS及HOMA-IR指数比较(n=10)与正常组比较,*P<0.01;与模型组比较,#P<0.01
2.PQS对PCOS模型大鼠血清性激素水平的影响:与正常组比较,模型组大鼠血清T、LH水平及LH/FSH比值均显著升高(P<0.01),FSH水平显著降低(P<0.01);与模型组比较,PQS高、低剂量组大鼠血清T、LH水平及LH/FSH比值均显著降低(P<0.01,图2)。

图2 各组大鼠血清性激素水平比较(n=10)与正常组比较,*P<0.01;与模型组比较,#P<0.01
3.PQS对PCOS-IR模型大鼠卵巢组织形态学的影响:HE染色结果显示,对照组大鼠镜下可见多个不同发育时期的卵泡和黄体,极少见到囊性扩张卵泡,卵泡内颗粒细胞层较厚,排列整齐,卵泡膜细胞8~9层(图3A);模型组大鼠的卵巢呈现出了典型的多囊样改变,各级发育卵泡数量减少、有囊性扩张的卵泡、闭锁卵泡、黄体组织比例减少、卵泡内颗粒细胞层减少至2~3层,卵泡膜细胞增生(图3B);PQS低剂量组卵巢组织也可见到不同时期的卵泡和黄体,囊性扩张卵泡的数量较模型组明显减少,卵泡内颗粒细胞层较模型组增加(图3C);PQS高剂量组卵巢组织可见到不同时期的卵泡和黄体,囊性扩张卵泡的数量较模型组显著减少,卵泡内颗粒细胞层均有增加(图3D)。

图3 各组大鼠卵巢组织(HE,×100)A.对照组卵巢组织;B.模型组卵巢组织;C.PQS低剂量组卵巢组织;D.PQS高剂量组卵巢组织
4.PQS对PCOS模型大鼠卵巢颗粒细胞中Bcl-2和Bax表达的影响:与正常组比较,模型组大鼠卵巢组织中抗凋亡因子Bcl-2表达水平显著降低,促凋亡因子Bax表达水平显著升高(P<0.01),Bcl-2/Bax比值显著降低,模型组卵巢组织存在明显损伤、凋亡显著增加;与模型组比较,PQS高剂量组大鼠卵巢组织Bcl-2表达水平均显著升高,Bax表达水平及Bcl-2/Bax比值均显著降低(P<0.01),PQS低剂量组变化比较差异无统计学意义(图4)。
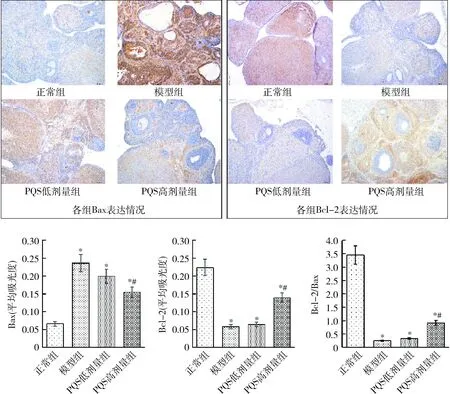
图4 各组大鼠卵巢颗粒细胞中Bcl-2和Bax表达情况比较(n=10)与正常组比较,*P<0.01;与模型组比较,#P<0.01
5.PQS对PCOS模型大鼠卵巢组织PI3K/Akt信号通路的影响:与正常组比较,模型组大鼠卵巢组织中p-PI3K、p-Akt表达水平显著减少;与模型组比较,PQS低、高剂量组p-PI3K、p-Akt表达水平均显著增加(图5)。

图5 各组大鼠卵巢组织PI3K/Akt信号通路蛋白表达情况比较(n=3)与正常组比较,*P<0.01;与模型组比较,#P<0.01,##P<0.01
讨 论
PCOS以卵泡发育异常、持续无排卵、胰岛素抵抗、雄激素过多及卵巢多囊样改变为其主要特征。IR是PCOS病因研究中公认的主要发病原因之一,高胰岛素血症己明确可引起高雄激素血症,高雄激素和高胰岛素相互作用,促使大量卵泡发育而无优势卵泡形成[7,8]。本研究通过高糖高脂饮食联合灌胃的方法,成功构建了具有显著IR、高雄激素血症及卵巢多囊样改变特征的PCOS-IR大鼠。研究结果显示,PQS治疗后大鼠血清T、FINS、LH水平及LH/FSH比值、HOMA-IR指数均显著降低,卵巢组织多囊样改变得到显著改善,提示PQS能够显著改善PCOS-IR模型大鼠高胰岛素血症、胰岛素抵抗、性激素水平异常,可使卵巢多囊样改变得到显著减轻,显示出了很好的治疗效应。
卵泡发育异常是 PCOS患者持续不排卵和临床内分泌改变的主要病理基础之一。大量研究显示PCOS患者卵泡发育的异常与卵巢颗粒细胞的凋亡相关[9,10]。颗粒细胞的凋亡途径主要有两种,死亡受体途径及线粒体凋亡途径,在线粒体凋亡途径的调控中,Bcl-2 家族起着关键作用。线粒体Bcl-2家族中促凋亡与抗凋亡蛋白的相互作用决定了线粒体凋亡途径的激活与抑制。已有研究显示PCOS大鼠卵巢颗粒细胞凋亡增加与Bcl-2家族蛋白表达失调相关[11]。本研究发现,模型组大鼠卵巢组织中抗凋亡因子Bcl-2表达水平显著降低,促凋亡因子Bax表达水平显著升高,Bcl-2/Bax比值显著降低,这与上述研究结果一致。PQS干预后Bcl-2表达水平显著升高,Bax表达水平显著降低,Bcl-2/Bax比值显著提高,提示PQS可通过调控Bcl-2家族中促凋亡与抗凋亡蛋白,发挥改善PCOS-IR大鼠卵泡发育的作用。
PI3K/Akt 信号通路是体内两条重要的胰岛素信号通路之一,不仅与胰岛素抵抗密切相关,同时也对细胞的生长、凋亡具有显著的调控效应[12,13]。近年来研究发现,PI3K/Akt信号通路的调控异常与PCOS患者胰岛素抵抗的发生密切相关,PI3K/Akt通路的内在缺陷及后天因素导致的该通路活性下降是导致PCOS出现高胰岛素血症和高雄激素血症的重要原因[14]。此外,研究发现PI3K/Akt 信号通路在始基卵泡的激活、卵泡的募集、卵母细胞的减数分裂、早期胚胎的发育以及颗粒细胞增殖过程中均起着非常重要的作用[15]。本研究发现,PQS能够显著升高PCOS-IR模型大鼠卵巢组织中PI3K、Akt蛋白磷酸化水平,提示PQS具有促进卵巢组织PI3K/Akt通路激活的效应,这可能是其治疗PCOS-IR的作用机制之一。
综上所述,本研究证实PQS可以显著改善PCOS-IR大鼠的胰岛素抵抗、纠正性激素异常及卵巢多囊样改变,机制可能与其抑制PI3k/Akt信号通路的过度激活,调控Bcl-2与Bax分子表达相关。本研究初步证实了PQS对PCOS-IR的治疗效应与机制,将为开发新的PCOS-IR治疗药物提供实验参考。
