RNA氧化及其在2型糖尿病中的研究进展
2021-08-19王晚霞王安奇
王晚霞 王安奇
活性氧簇(reactive oxygen species, ROS)修饰生物分子是疾病发生的重要机制,RNA氧化是其中重要一环。RNA氧化见于多种疾病发病早期,是神经变性疾病的重要致病机制,在预测衰老相关疾病风险、评估疾病疗效方面具有良好的应用前景[1~4]。氧化应激增强诱发胰岛素抵抗和β细胞功能障碍,是2型糖尿病发生、发展的主要因素,具体机制尚未完全阐明。近年来,大量人群研究发现,2型糖尿病患者尿8-氧化鸟嘌呤(8-oxoguanine,8-oxoG)升高,RNA氧化是影响2型糖尿病死亡的危险因素,也可能诱发胰岛素抵抗和2型糖尿病,提示RNA氧化可能是影响2型糖尿病发生、发展的重要机制[2, 5]。
一、RNA氧化的形成
RNA中的碱基易受ROS、紫外线和烷基化剂诱导的化学修饰。RNA氧化由细胞内ROS修饰核糖核酸碱基形成。线粒体功能障碍及抗氧化机制失活导致细胞内ROS增加,是RNA氧化累积产生病理效应的主要原因。RNA氧化可经ROS修饰RNA链上碱基直接氧化形成,也可由RNA聚合酶掺入细胞质中氧化的核糖核苷酸形成。目前研究发现, RNA中氧化碱基有20多种,包括8-氧化鸟嘌呤(8-oxoguanine, 8-oxoG)、8-氧化腺嘌呤(8-oxo-7,8-dihydroadenosine, 8-oxoA)、5-羟基尿嘧啶(5-hydroxyuridine,5-OHU)和5-羟基胞嘧啶(5-hydroxycytidine,5-OHC)等(图1A),其中8-oxoG在哺乳动物细胞中含量最高,是RNA氧化代表性碱基。RNA氧化对内、外源性刺激敏感。生理条件RNA中8-oxoG的频率约每105G出现一次,氧化应激轻度增强(如炎症)可致8-oxoG出现的频率增加10倍。除了内源性因素,凡造成氧化应激增强的多种外源因素如电离辐射、紫外线辐射和环境中苯、吸烟、二氧化钛、焊工吸入空气中重金属如铬、短期高浓度空气污染等均会促使RNA氧化增强。
细胞内不同类型的RNA均会受氧化修饰的影响。早期研究发现,mRNA最易受氧化应激的影响。mRNA中8-oxoG的含量是以rRNA为主的总RNA的5倍,而Fenton反应在rRNA形成的8-oxoG是tRNA的13倍。研究发现,8-oxoG 在miRNA中累积(处理后增加3.2倍)高于其他RNA(>200nt)(处理后增加1.8倍),证实miRNA更易受氧化修饰的影响[1]。
RNA氧化导致其功能缺失或改变。RNA中被氧化修饰的碱基配对能力会发生显著改变。例如8-oxoG以同样的速率与腺嘌呤和胞嘧啶配对,诱发鸟嘌呤-胸腺嘧啶(G> T)突变(图1B)。除了形成氧化碱基,RNA氧化也造成脱嘌呤及脱碱基位点、RNA交联、断裂[6~8]。mRNA氧化影响mRNA代谢的多个环节,包括mRNA稳定性和翻译。mRNA氧化抑制肽键形成,导致错误转码、核糖体漂移或mRNA降解,rRNA氧化可导致核糖体装配缺陷或与核糖体蛋白发生交联,tRNA损伤可能导致氨基酰化缺陷,影响细胞内蛋白质合成。MicroRNA氧化可改变其调节靶标,影响基因表达[1,9]。
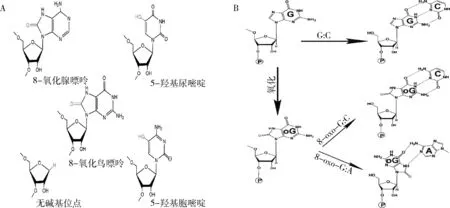
图1 RNA氧化修饰碱基,改变其配对能力A. RNA氧化产物的结构:8-氧化腺嘌呤(8-oxoA),8-氧化鸟嘌呤(8-oxoG),5-羟基尿嘧啶(5-OHU),5-羟基胞嘧啶(5-OHC)和无碱基位点(aba);B. RNA氧化影响碱基配对:氧化后鸟苷仍可与胞嘧啶配对,但更可能采用顺式构象并与腺苷配对
二、细胞对氧化RNA的调控
机体氧化RNA调控机制尚未完全阐明,尚未发现RNA氧化特异性修复机制的报道。清除细胞核酸池中氧化核糖核苷酸、防止掺入、特异性降解和诱导细胞死亡是细胞控制氧化RNA的主要途径[10]。细胞内存在特定清理氧化核苷酸、防止氧化核苷酸在转录过程中掺入RNA的酶。mutT同源蛋白(mutT homolog 1,MTH1)可将8-oxoGTP水解为8-oxoGMP,而NUDT5(nudix type 5, NUDT5)可将8-oxoGTP水解为8-oxoGDP。RNA合成过程中,鸟苷酸激酶(guanylate kinase,GK)无法将8-oxoGMP转换为GDP,核糖核苷酸还原酶(ribonucleotide reductase, RNR)无法识别8-oxoGDP,RNA聚合酶(RNA polymerase)掺入8-oxoGTP的速率远低于GTP,这有效阻止RNA合成时8-oxoGTP掺入形成氧化RNA。特异性降解和诱导细胞死亡是细胞清除氧化RNA主要方法。含8-oxoG的RNA被RNA结合蛋白识别后特异性降解。
参与特异性识别氧化RNA的蛋白有Y盒结合蛋白1(y-box binding protein 1,YB-1)、AU结合因子1(au-binding factor 1,AUF1)和聚(C)结合蛋白1[poly(C)-binding protein1,PCBP1]。YB-1与含有8-oxoG的RNA帽结构特异性结合,稳定mRNA防止脱帽,启动mRNA的降解。AUF1可识别含有8-oxoG的RNA,与氧化RNA结合能力最强。AUF1特异性结合氧化RNA,将其募集到外泌体中由核酸酶降解,维持正常基因表达。PCBP1蛋白可特异性结合含2个以上8-oxoG的RNA,激活caspase-3,使PARP-1裂解,通过诱导细胞凋亡清除氧化RNA[10]。
三、RNA氧化对细胞的影响及分子机制
1.RNA氧化导致蛋白质合成异常:RNA氧化影响转录和翻译,导致短链多肽或变异蛋白质合成(图2)。Dai等[11]研究发现,8-oxoGTP掺入mRNA改变基因表达,带有8-oxoG-mRNA的CHO细胞除了分泌大量已知致病性Aβ外,还可分泌28种未知的Aβ衍生肽,明确RNA氧化增加可造成基因转录或翻译错误,产生异常蛋白质。干扰RNA之间的相互作用是RNA氧化致蛋白合成异常的主要原因。mRNA中8-oxoG干扰核糖体对tRNA的选择,肽键形成速率降低3~4个数量级。Thomas等[12]研究证实,mRNA中 8-oxoG在A位采用syn构象,该构象与腺苷的配对能力,不足以促进解码中心tRNA选择所必需的结构改变,蛋白翻译停滞。Willi等[6]研究发现,rRNA氧化碱基聚集于已知功能区域。肽酰转移酶中心8-oxoA2451抑制肽键形成,5-OHU2585干扰A位tRNA的聚集,均降低肽段合成。tRNA氧化诱导其CCA尾部失活,干扰密码子-反密码子配对,导致不完全氨基酰化或错酰化tRNA累积,导致错误或截短蛋白质产生。
RNA氧化可调控基因表达影响蛋白质合成,miRNA氧化是调控基因表达的表观转录机制。Wang等[9]首次发现,氧化修饰改变miR-184调节靶标,使其靶向Bcl-xL和Bcl-w的3·UTR结合位点,下调Bcl-xL和Bcl-w的mRNA及蛋白表达。研究发现,miR-1种子区域位置特异8-oxoG修饰,可通过8-oxoG·A碱基配对调控新的mRNA,诱导心肌肥厚,miRNA的位置特异性氧化是调控基因表达的表观转录机制[1]。
2.RNA氧化促进细胞凋亡:RNA氧化见于神经元变性凋亡早期,可能是神经元凋亡的主要原因,具体机制尚未阐明。有研究发现RNA氧化可促进线粒体介导的细胞凋亡。RNA氧化形成脱嘌呤鸟苷、脱碱基位点或RNA交联,可产生RNA-Cyt C交联复合物,促进Cyt C从脂质体上的解离,Cyt C从线粒体释放,直接诱发线粒体介导的细胞凋亡。Ishii等[13]研究发现,当RNA氧化严重时,PCBP1蛋白特异性结合含2个以上8-oxoG的RNA,激活caspase-3,使PARP-1裂解,启动细胞凋亡[10, 13](图2)。RNA氧化可经ROS修饰RNA链上碱基直接氧化形成,也可由RNA聚合酶掺入细胞质中氧化的核糖核苷酸形成。清除核酸池中氧化核糖核苷酸、防止掺入、特异性降解和诱导细胞死亡是细胞控制氧化RNA主要途径。不同类型RNA氧化(包括mRNA、rRNA、tRNA 和microRNA)均会影响蛋白质合成,导致蛋白质合成异常或细胞凋亡,影响神经变性疾病和2型糖尿病及其并发症的发生、发展。

图2 RNA氧化的形成及病理效应
四、RNA氧化与2型糖尿病
1.RNA氧化是影响2型糖尿病血管并发症发展的重要因素:RNA氧化是2型糖尿病并发症的危险因素。Broedbaek等[5]通过1381例未经治疗的人群队列随访发现,从确诊到随访6年,尿8-oxoG升高死亡风险增加,尿8-oxoG是2型糖尿病死亡的独立预测指标。2型糖尿病鼠模型血浆和尿液中8-oxoG水平明显升高,肾脏、心脏、脑等脏器RNA氧化升高,并随着高血糖状态而持续增高,提示RNA氧化与糖尿病并发症密切相关[14, 15]。RNA氧化与糖尿病微血管并发症的研究主要集中于糖尿病肾病。Mao等[16]研究发现,RNA氧化可见于糖尿病性肾病早期疾病。Kjaer等[17]研究发现,糖尿病肾病患者强化治疗后8-oxoG低的患者死亡风险最低,尿8-oxoG可用于监测疗效及预测糖尿病晚期并发症的后续风险。RNA氧化水平升高与2型糖尿病心血管死亡风险密切相关。Liu等[18]研究发现,血糖和血脂未出现差异时,2型糖尿病心血管并发症患者尿8-oxoG水平显著高于无并发症患者,8-oxoG水平升高可能是2型糖尿病心血管并发症的危险因素。近年来研究发现,RNA氧化与2型糖尿病患者心血管事件所致死亡密切相关,尿8-oxoG是评估2型糖尿病氧化应激水平和预测大血管并发症的良好标志物[19, 20]。
2.RNA氧化与2型糖尿病的发展密切相关:RNA氧化是诱发2型糖尿病危险因素。Cejvanovic等[21]通过对3567例丹麦人群横断面调查发现,成年男性肥胖者、2型糖尿病患者尿8-oxoG升高,RNA氧化增高与糖尿病发生率升高有关。Schöttker等[2]基于7828例个体14年随访的队列研究发现,8-oxoG的水平与2型糖尿病的发生率存在关联;高龄组(65~75岁)人群8-oxoG与2型糖尿病发生率的相关性最强,8-oxoG水平每增加1个标准差的HR为1.14(1.05~1.23),表明老年人细胞修复能力降低时RNA氧化增高更为明显,是RNA氧化是促进2型糖尿病发生或发展的重要因素。Kloppenborg等[22]研究发现,葡萄糖耐量受损的肥胖儿童尿8-oxoG和葡萄糖耐量之间存在相关性。Jørs等[23]研究证实8-oxoG与胰岛素抵抗显著相关,与单纯肥胖的患儿比较,肥胖伴胰岛素抵抗的患儿尿液8-oxoG明显升高,表明RNA氧化与2型糖尿病发病联系密切。
五、展 望
RNA氧化影响2型糖尿病血管并发症发展,其代谢标志物尿8-oxoG是预测糖尿病血管并发症发生、发展的良好标志物,在2型糖尿病血管并发症的预警及防治中有良好的应用前景。RNA与衰老关系密切,尿8-oxoG的水平呈现增龄性增长。因此,建立基于大规模人群研究的尿8-oxoG的参考值范围和医学决定水平,是将尿8-oxoG用于2型糖尿病血管并发症临床诊断的基础。尿8-oxoG定量方法的标准方法是高效液相色谱-串联质谱法(LC-MS/MS)法。由于LC-MS/MS对设备和技术人员要求,尿8-oxoG的监测及临床应用受限。随着质谱技术在临床实验室诊断中的推广,尿8-oxoG必将成为2型糖尿病血管并发症防控的可靠生物学标志物。
RNA可能是诱发2型糖尿病发生的危险因素之一。虽然目前RNA氧化对细胞功能及活性的影响及作用机制尚处于前期探索阶段,RNA氧化已被视为诱发神经元凋亡的早期事件和主要原因。基于糖尿病模型鼠和空腹糖耐量受损患者尿8-oxoG的评估,笔者发现RNA氧化升高见于2型糖尿病早期。进一步用8-oxoGTP 干预INS-1细胞模型发现,RNA氧化增加可抑制INS-1细胞增殖(数据尚未发表),可见RNA氧化与2型糖尿病的发生关系密切。目前RNA氧化与胰岛素抵抗的因果关系尚未证实,在2型糖尿病发生、发展中的作用机制研究匮乏。针对RNA氧化在2型糖尿病中作用的机制研究必将为其防治提供新策略。
