miR-194对乳腺癌细胞增殖、侵袭迁移和Wnt/β-catenin信号通路的影响①
2020-09-29宿世琼
宿世琼 倪 青 侯 净 王 舒 陈 欢
(贵州省人民医院乳腺外科,贵阳 550002)
miRNA为非编码小RNA,长度约19~22 nt,可结合靶基因mRNA 3′端非编码区调控靶基因表达,为转录后调节基因,在肿瘤形成及细胞增殖、分化、凋亡、侵袭、迁移等过程中发挥重要作用,在恶性肿瘤的发生发展中发挥癌基因或抑癌基因作用。乳腺癌细胞中多种miRNA存在异常表达,参与乳腺癌细胞生长和侵袭迁移[1]。miR-194为miRNA家族成员,参与多种恶性肿瘤细胞的增殖和转移[2,3]。Wnt/β-catenin通路参与细胞分化、增殖,乳腺癌细胞中存在Wnt/β-catenin通路异常,参与乳腺癌细胞增殖、侵袭迁移[4]。本文对乳腺癌细胞MCF-7中miR-194水平及其对乳腺癌细胞增殖、侵袭迁移和Wnt/β-catenin信号的影响进行研究,探讨miR-194对乳腺癌的作用机制。
1 材料与方法
1.1材料 人乳腺癌MCF-7细胞、人正常乳腺Hs578Bst细胞(中国科学院上海细胞库),兔抗人GSK-3β单克隆抗体、兔抗人p-GSK-3β单克隆抗体、兔抗人β-catenin单克隆抗体、兔抗人cyclin-D1单克隆抗体、兔抗人C-Myc单克隆抗体、兔抗人MMP-7单克隆抗体(美国Santa Cruz公司),ECL化学发光试剂盒、RT-PCR试剂盒、Trizol试剂、反转录试剂盒(美国BPB公司),脂质体Lipofectamine 2000、MTT试剂、胰蛋白酶、DMEM培养基(美国Sigma公司),miR-194 mimic和阴性对照(上海生工生物工程有限公司)。
1.2方法
1.2.1细胞培养 将MCF-7细胞和Hs578Bst细胞置于RPMI1640(胎牛血清和青霉素-链霉素)培养基中培养,细胞融合达90%、呈对数生长时进行传代。
1.2.2RT-PCR测定miR-194水平 将MCF-7细胞和Hs578Bst细胞加入Trizol裂解5 min,提取总RNA,分光光度计测定RNA浓度和纯度。将RNA逆转录为cDNA,RT-PCR测定MCF-7细胞和Hs578Bst细胞中miR-194水平,反应条件为95℃ 30 s;95℃ 5 s,60℃ 30 s,共42个循环。以U6为内参。miR-194水平以2-ΔΔCt表示。
1.2.3MCF-7细胞分组及转染 MCF-7细胞分为空白对照组(Blank组)、阴性对照组(NC组)和miR-194组。将miR-125b mimic及相应的NC置于EP管,加入NBase-free water 1 000 μl,分装备用。将各组MCF-7细胞接种于24孔板(1×105个/孔),每组设置7个复孔,无抗生素培养基培养24 h,miR-194组加入miR-125b mimic,NC组加入NC存储液,Blank组不转染,培养24 h,RT-PCR测定各组MCF-7细胞中miR-194水平,方法同1.2.2。
1.2.4MTT法测定MCF-7细胞增殖活性 取各组对数生长期的MCF-7细胞加入胰蛋白酶消化细胞,调整各组细胞浓度为5×104个/ml,接种于96孔板,每组设置7个复孔,24、48、72 h在每孔中加入20 μl MTT,孵育4 h,取上清,加入DMSO溶液混匀,酶标仪测定吸光度(OD)值。
1.2.5Transwell小室测定MCF-7细胞侵袭能力 将Matrigel基质胶用DMEM培养基(无血清、无双抗)按1∶8比例稀释,均匀包被Transwell小室底部培养1 h,将对数生长的MCF-7细胞饥饿培养2 h取出,上室中加入不含胎牛血清的DMEM培养液,下室加入含FBS的DMEM培养基孵育1 h。收集MCF-7细胞,调整浓度为2×105个/ml,取100 μl加入Transwell小室上室,将含FBS的培养液加入下室,孵育4 h,PBS洗涤小室上层膜,甲醛固定,结晶紫染色,棉签擦去附着细胞,观察MCF-7细胞侵袭情况。
1.2.6划痕实验测定MCF-7细胞迁移能力 取各组对数生长MCF-7细胞接种于6孔板,4×105个/孔,待细胞贴壁生长至覆盖培养瓶底时,用消毒枪头(10 ml)垂直孔板底面、沿中轴划3条平行线,PBS冲洗加入不含胎牛血清的培养基培养,24 h后显微镜下拍照观察24 h划痕愈合照片,Visio软件分析细胞迁移距离。
1.2.7Western blot检测MCF-7细胞中GSK-3β、p-GSK-3β、β-catenin、cyclin-D1、C-Myc、MMP-7蛋白水平 取各组转染48 h的MCF-7细胞,每组设置7个复孔,加入裂解液裂解30 min,提取总蛋白,取50 μl蛋白样品上样,电泳、转膜、封闭,加入一抗(兔抗人GSK-3β单克隆抗体、兔抗人p-GSK-3β单克隆抗体、兔抗人β-catenin单克隆抗体、兔抗人cyclin-D1单克隆抗体、兔抗人C-Myc单克隆抗体、兔抗人MMP-7单克隆抗体)孵育过夜,加入二抗封闭1 h,以β-actin为内参,ECL化学发光显影,BIO-RAD凝胶成像系统扫描拍照,Image J软件分析条带灰度值,蛋白表达量以蛋白灰度值/β-actin灰度值表示。

2 结果
2.1乳腺癌MCF-7细胞与正常乳腺Hs578Bst细胞miR-194水平比较 乳腺癌MCF-7细胞miR-194水平显著低于正常乳腺Hs578Bst细胞(0.24±0.05 vs 1.00±0.07,P<0.01)。
2.2各组MCF-7细胞miR-194水平比较 与Blank组和NC组相比,miR-194组miR-194水平升高(P<0.05),Blank组和NC组miR-194水平差异无统计学意义(P>0.05)。见表1。
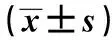
表1 各组MCF-7细胞中miR-194水平比较
2.3各组MCF-7细胞增殖能力比较 24 h时,各组MCF-7细胞OD值差异无统计学意义(P>0.05);48 h和72 h时,与Blank组和NC组相比,miR-194组MCF-7细胞OD值降低(P<0.05),Blank组和NC组MCF-7细胞OD值差异无统计学意义(P>0.05)。见表2。
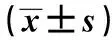
表2 各组MCF-7细胞OD值比较
2.4各组MCF-7细胞侵袭能力 与Blank组和NC组相比,miR-194组MCF-7细胞侵袭细胞数降低(P<0.05),Blank组和NC组MCF-7细胞侵袭细胞数差异无统计学意义(P>0.05)。见表3、图1。

图1 Transwell测定MCF-7细胞侵袭能力(×400)Fig.1 Transwell to determine invasive ability of MCF-7 cells (×400)
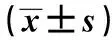
表3 各组MCF-7细胞侵袭细胞数比较
2.5各组MCF-7细胞迁移能力比较 与Blank组和NC组相比,miR-194组MCF-7细胞迁移距离降低(P<0.05),Blank组和NC组MCF-7细胞迁移距离差异无统计学意义(P>0.05)。见表4、图2。
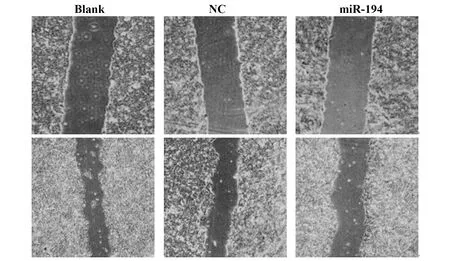
图2 划痕实验测定MCF-7细胞迁移能力(×100)Fig.2 Scratch test to determine migration ability of MCF-7 cells (×100)
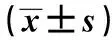
表4 各组MCF-7细胞迁移距离比较
2.6各组MCF-7细胞GSK-3β、p-GSK-3β、β-catenin蛋白水平相比 各组MCF-7细胞GSK-3β蛋白水平相比差异无统计学意义(P>0.05);与Blank组和NC组相比,miR-194组MCF-7细胞p-GSK-3β、β-catenin蛋白水平降低(P<0.05),Blank组和NC组MCF-7细胞p-GSK-3β、β-catenin蛋白水平差异无统计学意义(P>0.05)。见表5、图3。
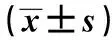
表5 各组MCF-7细胞GSK-3β、p-GSK-3β、β-catenin蛋白水平比较

图3 Western blot检测各组MCF-7细胞GSK-3β、p-GSK-3β、β-catenin蛋白水平Fig.3 Western blot detected GSK-3β,p-GSK-3β and β-catenin proteins levels of MCF-7 cells in each group
2.7各组MCF-7细胞cyclin-D1、C-Myc、MMP-7蛋白水平 与Blank组和NC组相比,miR-194组MCF-7细胞cyclin-D1、C-Myc、MMP-7蛋白水平降低(P<0.05),Blank组和NC组MCF-7细胞cyclin-D1、C-Myc、MMP-7蛋白水平差异无统计学意义(P>0.05)。见表6、图4。

图4 Western blot检测各组MCF-7细胞cyclin-D1、C-Myc、MMP-7蛋白水平电泳图Fig.4 Western blot detected cyclin-D1,C-Myc and MMP-7 proteins levels of MCF-7 cells in each group
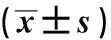
表6 各组MCF-7细胞cyclin-D1、C-Myc、MMP-7蛋白水平比较
3 讨论
miRNA为信号分子,具有广泛的调节功能,在乳腺癌的发生发展中起重要作用[5]。miRNA可作为癌基因或抑癌基因,作为促癌基因在恶性肿瘤中表达上调,可通过阻止恶性肿瘤细胞分化、抑制恶性肿瘤细胞凋亡、解除抑癌基因的调控等途径促进恶性肿瘤发生发展;作为抑癌基因在恶性肿瘤中表达下调或缺失,促进恶性肿瘤细胞增殖作用下降,抑制恶性肿瘤细胞无限增殖[6-8]。miR-194在多种恶性肿瘤中表达异常,参与多种恶性肿瘤发生发展,如miR-194对裸鼠体内骨肉瘤的增殖及肺部转移具有明显抑制作用,在裸鼠骨肉瘤中发挥抑癌基因作用,可通过靶向KDM5B抑制胃癌细胞增殖,在胃癌中发挥抑癌基因作用,通过调节BMP1和p27(kip1)表达抑制非小细胞肺癌转移,因此miR-194在骨肉瘤、胃癌、非小细胞肺癌的恶性肿瘤中发挥抑癌基因作用[9-12]。本研究对乳腺癌MCF-7细胞miR-194水平进行实验,发现MCF-7细胞miR194水平降低,过表达miR-194可抑制乳腺癌MCF-7细胞增殖、侵袭和迁移。本研究表明miR-194在乳腺癌MCF-7细胞中发挥抑癌基因作用。在恶性肿瘤的发生发展中,Wnt/β-catenin信号通路参与恶性肿瘤增殖、侵袭和迁移,该通路中任何信号分子异常均可引起β-catenin聚集于细胞质和细胞核,促使下游靶基因转录活性增强,引起细胞异常增殖[13]。β-catenin是Wnt/β-catenin通路的关键分子,在乳腺癌中异常表达,与转移及不良预后有关;GSK-3β在真核细胞中普遍存在,为保守的丝氨酸、苏氨酸激酶,GSK-3β磷酸化为p-GSK-3β可调节细胞增殖、分化及凋亡,可避免β-catenin磷酸化,在细胞质中堆积,导致Wnt/β-catenin信号通路活化,促进β-catenin进入细胞核,激活下游靶基因转录,从而调控细胞分化、周期、生长及迁移[14-16]。cyclin-D1、C-Myc和MMP-7为Wnt/β-catenin下游靶基因,在乳腺癌中过表达,cyclin-D1过表达可促进乳腺癌侵袭转移,C-Myc过表达可促进细胞增殖、抑制细胞凋亡,MMP-7过表达可促进肿瘤生长,增强细胞侵袭能力[17-19]。
miR-194可通过Wnt/β-catenin信号通路参与恶性肿瘤发生发展,Peng等[20]研究发现miR-194通过Wnt/β-catenin信号通路参与胃癌发生发展,张杨等[21]研究发现miR-194通过Wnt/β-catenin信号通路参与肝癌细胞增殖和侵袭。Wnt/β-catenin信号通路在乳腺癌发生发展中发挥重要作用,miR-194可通过Wnt/β-catenin信号参与恶性肿瘤发生发展,因此推测miR-194可能通过Wnt/β-catenin信号通路参与乳腺癌细胞增殖、侵袭迁移。本研究发现过表达miR-194可下调p-GSK-3β、β-catenin、cyclin-D1、C-Myc、MMP-7蛋白水平,表明miR-194可通过抑制Wnt/β-catenin信号通路激活、下调其下游基因发挥抑制乳腺癌细胞增殖、侵袭和迁移。
综上所述,miR-194可通过抑制Wnt/β-catenin信号通路抑制乳腺癌发生发展,但本研究仅对人乳腺癌MCF-7细胞进行研究,miR-194在其他乳腺癌细胞株中的表达情况及其在动物实验中的表达情况有待进一步研究。