4-羟基-3,5-二硝基吡唑含能离子化合物的合成、晶体结构及性能
2021-08-16蒋绣俄杜慧英刘芮楷高瞻宇
伍 波,蒋绣俄,胡 平,杜慧英,刘芮楷,高瞻宇
(1.西南科技大学环境友好能源材料国家重点实验室,四川 绵阳621010;2.西南科技大学材料科学与工程学院,四川 绵阳621010)
1 引言
含能材料是武器装备的能量源泉,深刻影响武器系统的作战效能,因其重要的战略地位而受到世界各国的高度重视。含能化合物是含能材料的核心,其性能决定了含能材料的性能上限。传统含能化合物如黑索今(RDX)和奥克托今(HMX)等随着能量的提高,其机械感度也不断增加、安全性下降。近年来,设计与合成具有良好能量水平和低感度的化合物是含能材料领域的重要研究内容[1-2]。芳香性富氮乃至全氮杂环因其结构中包含大量N─N 和C─N 键、具有高的正生成焓和能量密度,而成为创制新型含能化合物极具潜力的母环骨架。其结构含有大量供氢键作用位点,有益于分子结构中形成氢键作用,能降低含能化合物的感度、提升其热稳定性,这些独特的优势使其含能衍生物成为含能材料领域内的研究热点[3-5]。吡唑是一类具有正生成焓的芳香性五元氮杂环,易于被功能性基团,如硝基、氨基、偶氮以及重氮基团等修饰,而形成应用方向多的新型含能化合物[6-9]。其中,二硝基吡唑类衍生物在熔铸炸药、不敏感弹药等方面展现出较大应用潜力[10-11]。为进一步提升二硝基吡唑含能化合物的爆轰性能,可通过增加含能化合物中氧含量来提升密度以及氧平衡。除了引入硝基、N─O 等常见致爆基团外,C─O 结构既可以增加化合物的氧含量,又可强化共轭作用和氢键作用,提升含能化合物的稳定性、降低感度[12-15]。典型的含C─O 官能团富氮含能化合物 包 括:四 唑 酮 离 子 化 合 物[12]、3-硝 基-1,2,4 三唑-5-酮[13]以 及5-甲 基-4-硝 基-吡 唑-3-酮 及 其 含 能 离子化合物[14]等。这些含能离子化合物的机械感度比传统单质炸药钝感,但是其氧平衡和能量性能仍需进一步提高。
鉴于硝基吡唑骨架和C─O 结构的独特优势,以高氧含量的4-羟基-3,5-二硝基吡唑(H-DNOP)为基本骨架单元,设计了其新型合成路线,并得到了三种新型DNOP 含能离子化合物。所合成含能离子化合物通过X-射线单晶衍射分析、傅里叶变换红外光谱(FT-IR)、核磁共振谱(1H NMR、13C NMR)、元素分析、差示扫描量热仪-热失重(DSC-TG)联用等手段进行了结构表征和理化性质测试,并利用Kamlet-Jacobs 方程预测了其爆轰性能。
2 实验部分
2.1 试剂与仪器
试剂:3,5-二硝基-4-溴吡唑,实验室自制(纯度为99%);草酰肼和4-氨基-1,2,4-三唑为分析纯;萨恩化学技术(上海)有限公司;水合肼、发烟硝酸、浓硫酸、氢氧化钾、乙酸乙酯以及甲醇均为分析纯,成都科龙化工试剂公司。
仪器:DZF-20 型真空干燥箱,北京中兴伟业仪器有限公司;Tensor 27 型红外光谱仪,德国Bruker 公司;AVANCE 600 型超导核磁共振波谱仪,德国Bruker 公司;Netzsch STA449F5 型DSC-TG 同步热分析仪,德国耐驰仪器公司;BFH PEx 型轻落锤撞击感度测试仪和FSKM 10L 型轻摩擦感度测试仪,美国爱迪赛恩公司;Accupyc Ⅱ-1340 型真密度仪,美国Micromeritics公司。
2.2 合成路线
以自制4-溴-3,5-二硝基吡唑(1)为原料[16-17],经取代、中和反应得到4-羟基-3,5-二硝基吡唑(2),再与碱性化合物反应得到4-羟基-3,5-二硝基吡唑含能离子化合物3~5,合成路线见Scheme 1。

Scheme 1 Synthetic route of ionic energetic compounds 3-5 based on 3,5-dinitro-4-oxylpyrazolate anion
2.3 合成过程
2.3.1 4-羟基-3,5-二硝基吡唑(2)的合成
室温下,将3,5-二硝基-4-溴吡唑(2.37 g,10.00 mmol)溶解于60 mL 水中,随后加入氢氧化钠。随后升温至90 ℃反应8 h,反应结束后降温至室温,用稀盐酸将反应液的pH 调至2。经乙酸乙酯萃取3 次后,有机相经洗涤、干燥、浓缩得到黄色晶体1.60 g,收率为92%。IR(ATR,ν/cm-1):3582,3497,1623,1497,1448,1330,1217,833,675;1H NMR(600 MHz,DMSO-d6,25 ℃)δ:6.15(br);13C NMR(150 MHz,DMSO-d6,25 ℃)δ:139.75,135.24。
2.3.2 4-羟基-3,5-二硝基吡唑肼盐一水合物(3)的合成
称取4-羟基-3,5-二硝基吡唑(0.348 g,2 mmol)溶于20 mL 水中,搅拌下升温至80 ℃全部溶解,随后滴加定量水合肼。加料完毕后,继续搅拌反应0.5 h,随后降温、结晶、抽滤、洗涤、干燥得到0.28 g 橙红色晶体,产率为68%。DSC(5 ℃·min-1):210.3 ℃(dec.);IR(ATR,ν/cm-1):3450,3402,3335,3310,3271,3044,2987,1664,1560,1471,1383,1355,1315,1247,1208,1138,904,870,835;1H NMR(600 MHz,DMSO-d6,25 ℃)δ:6.64(br);13C NMR(150 MHz,DMSO-d6,25 ℃)δ:143.39,142.58;Anal. calcd for C3H6N6O5:C 17.48,H 2.93,N 40.77;found:C 17.52,H 2.90,N 41.12。
2.3.3 4-羟基-3,5-二硝基吡唑草酰肼盐二水合物(4)的合成
合成方法与化合物3 相似,产物为黄色晶体,产率为93%。DSC(5 ℃·min=1):203.7 ℃(dec.);IR(ATR,ν/cm=1):3592,1718,1653,1503,1396,1276,1215,977,828,734,505;1H NMR(600 MHz,DMSO-d6,25 ℃)δ:7.25(br);13C NMR(150 MHz,DMSO-d6,25 ℃)δ:157.95,141.30,139.13,139.04;Anal.calcd for C8H10N12O12:C 20.61;H 2.16;N 36.05;found:C 20.69,H 2.21,N 36.11。
2.3.4 4-羟基-3,5-二硝基吡唑4-氨基-1,2,4-三唑盐一水合物(5)的合成
合成方法与化合物3 相似,产物为黄色晶体,产率为82%。DSC(5 ℃·min-1):191.5 ℃(dec.);IR(ATR,ν/cm-1):3310,3130,1599,1477,1393,1275,1108,1058,972,870,829,731,893,617;1H NMR(600 MHz,DMSO-d6,25 ℃)δ:8.81(s,2H),6.71(s);13C NMR(150 MHz,DMSO-d6,25 ℃)δ:144.52,140.68,137.68;Anal. calcd for C5H6N8O5:C 23.26;H 2.34;N 43.41;found:C 23.30,H 2.28,N 43.57。
2.4 单晶培养及结构测定
将合成出的离子型化合物3~5 分别溶解在水溶液中,趁热过滤,滤液于25 ℃静置12 h,溶剂降温后可得到透明的晶体。
对于化合物3,选取了尺寸0.25 mm×0.23 mm×0.14 mm 单晶进行X 射线衍射实验;用μ(Mo Kα)射线(λ=0.71073 nm),石墨单色器,在173 K时,以ω方式扫描,扫描范围:3.266°≤θ≤26.376°,-7≤h≤7,-9≤k≤9,-11≤l≤11,共收集衍射点5486 个,其中独立衍射点1718 个(Rint=0.0250),选取I>2σ(I)的1415 个点用于结构的测定和修正。晶体结构由程序SHELXS97 和SHELXL97 直接法解出,经多轮Fourier 合成获得全部非氢原子。全部非氢原子的坐标及各向异性热参数经全矩阵最小二乘法修正及收敛。
对于化合物4,选取了尺寸0.23 mm×0.19 mm×0.1 mm 单晶进行X 射线衍射实验;用μ(Mo Kα)射线(λ=0.71073 nm),石墨单色器,在173 K时,以ω方式扫描,扫描范围:2.692°≤θ≤25.366°,-9≤h≤9,-10≤k≤10,-18≤l≤18,共收集衍射点6878 个,其中独立衍射点3281 个(Rint=0.0392),选取I>2σ(I)的2407 个点用于结构的测定和修正。晶体结构由程序SHELXS97 和SHELXL97 直接法解出,经多轮Fourier 合成获得全部非氢原子。全部非氢原子的坐标及各向异性热参数经全矩阵最小二乘法修正及收敛。
对于化合物5,选取了尺寸0.25 mm×0.15 mm×0.10 mm 单晶进行X 射线衍射实验;用μ(Mo Kα)射线(λ=0.071073 nm),石墨单色器,在173 K时,以ω方式扫描,扫描范围:3.455°≤θ≤25.412°,-14≤h≤14,-6≤k≤5,-21≤l≤21,共收集衍射点5382 个,其中独立衍射点1885 个(Rint=0.0494),选取I>2σ(I)的1427 个点用于结构的测定和修正。晶体结构由程序SHELXS97 和SHELXL97 直接法解出,经多轮Fourier 合成获得全部非氢原子。全部非氢原子的坐标及各向异性热参数经全矩阵最小二乘法修正及收敛。
2.5 性能测试
在氮气流量为50 mL·min-1、升温速率为5 ℃·min-1以及温度区间为50~450 ℃的条件下利用DSC-TG 实测离子型化合物3-5 的热稳定性。
按照BAM 测试规定,在相应测试条件:药量(30±1)mg,落锤质量2 kg,环境温度10~35 ℃,相对湿度φ≤80%RH,研究了其撞击感度和摩擦感度。
3 结果与讨论
3.1 晶体结构分析
所得三个晶体的CCDC 号分别为:2079325(3),2079326(4),2079327(5)。表1 为化合物3~5 的部分晶体学数据,表2 为该三个化合物的主要键长数据。
图1a 和图1b 分别为4-羟基-3,5-二硝基吡唑肼盐(3)的分子结构和晶体堆积图。如图1a 所示,离子型化合物由一价水合肼阳离子与一价4-羟基-3,5-二硝基吡唑阴离子配对组成。从表2 可以看出,吡唑环上C(1)—N(2)和C(3)—N(1)的键长分别为1.375(3)Å和1.365(3)Å,呈现较好的芳香性。硝基与吡唑的C(1)—N(3)和C(3)—N(4)键长分别为1.389(3)Å和1.411(3)Å,介于正常C—N 双键(键长为1.27 Å)和C—N 单键(键长为1.47 Å)之间,表明硝基与吡唑环能形成共轭体系。C(2)—O(3)的键长为1.262(2)Å,其与吡唑环的二面角(N(2)—C(1)—C(2)—O(3)和O(3)—C(2)—C(3)—N(1)分 别 为179.7(2)°和-179.8(2)°,表明氧原子也可与吡唑环形成平面性的共轭体系,使整个含能阴离子在晶体堆积中易于形成平面堆积结构。如其晶体堆积图(图1b)所示,该离子型化合物的分子排列整齐,呈层状结构堆积,肼离子与阴离子中的硝基与氧代基团存在大量的N—H…O,N氢键作用(表2),呈现出三维网状结构(图1b 和图1c))。
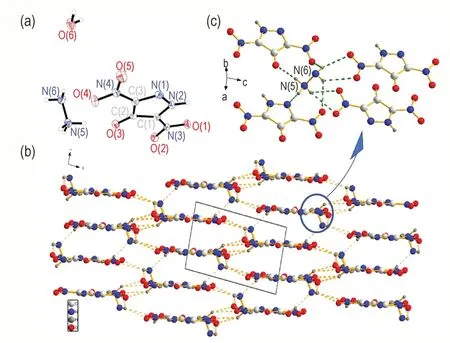
图1 化合物3 的晶体分子结构图(a),晶胞堆积图(b)及肼阳离子氢键作用示意图(c)Fig.1 Crystal molecular structure(a),packing diagram(b)and hydrogen bonding interactions surrounding with hydrazinium cation(c)of compound 3

表2 化合物3~5 的部分键长Table 2 Selected bond lengths of compound 3-5
4-羟基-3,5-二硝基吡唑草酰肼盐(4)的分子结构和分子在晶胞中的堆积分别示于图2a 和图2b。该离子型化合物由二价草酰肼阳离子与一价4-羟基-3,5-二硝基吡唑阴离子配对组成。其中阴离子的结构与肼盐(3)相似,也呈现出良好的平面性。草酰肼阳离子的结构中C(4B)—O(6B)键长为1.215(3)Å,介于C—O 单键和C=O 双键之间;C(4B)—N(5B)的键长为1.340(3)Å,介于C—N 单键和C=N 双键之间(表1)。其 二 面 角O(6B)—C(4B)—N(5B)—N(6B)和C(4B(b))—C(4B)—N(5B)—N(6B)分别为-1.4(4)°和-179.8(2)°,表明草酰肼阳离子存在共轭效应,呈现出良好的平面性。草酰肼盐(4)的晶体堆积图(图2b)显示,二硝基吡唑阴离子呈层状堆积,其结构中的硝基和氧代基团与吡唑环上—NH 和草酰肼上—NH3+结构以典型的N—H…O 氢键作用形成了三维网络结构。

表1 化合物3~5 的部分晶体学数据Table 1 Partial crystallographic data of compounds 3-5

图2 化合物4 的晶体分子结构图(a)和晶胞堆积图(b)Fig.2 Crystal molecular structure(a)and packing diagram(b)of compound 4
4-羟 基-3,5-二 硝 基 吡 唑4-氨 基-1,2,4-三 唑 盐(5)的分子结构和分子在晶胞中的堆积分别示于图3a和图3b。该离子型化合物由质子化的4-氨基-1,2,4-三唑阳离子与4-羟基-3,5-二硝基吡唑阴离子配对组成。其阴离子中的C(2)—O(3)键长为1.268(3)Å,空间结构与肼盐(3)和草酰肼盐(4)相似,也呈现出良好的平面性。其4-氨基-1,2,4-三唑阳离子结构中N(7)—N(8)的键长为1.418(3)Å,且二面角N(6)—C(4)—N(7)—N(8)和N(5)—C(5)—N(7)—N(8)分别为179.5(2)°和-179.6(2)°,表明阳离子中氨基与三唑环呈现良好共平面性,整个阳离子也为平面型结构。该含能离子中存在大量的N—H…O 和O—H…N典型的氢键作用,阳离子三唑环与阴离子中的硝基通过典型氢键N(6)—H(6A)…O(3)和N(6)—H(6A)…O(4)以及非典型的氢键作用C(4)—H(4)…O(5),C(4)— H(4)…O(4),C(5)—H(5)…O(2),C(4)—H(4c)…O(1)和C(5)—H(5)…O(2)氢键作用构建晶体结构中的复杂的三维网状结构(图3b)。
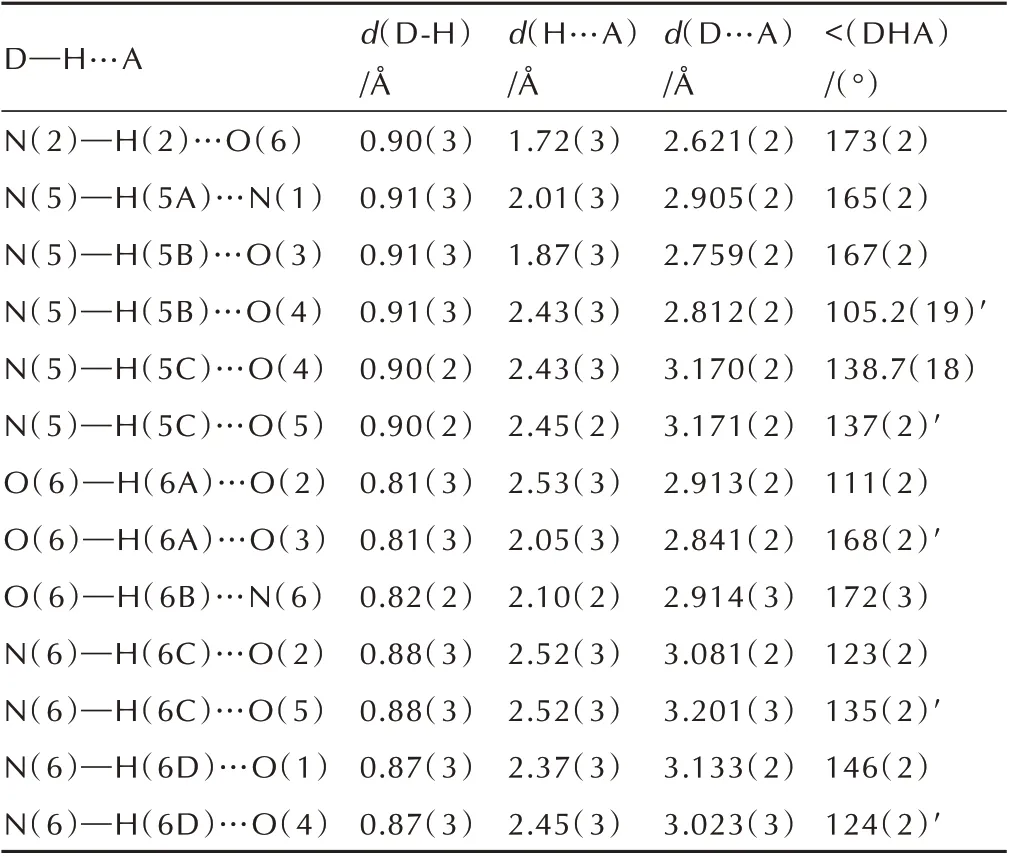
表3 化合物3 中的氢键作用Table 3 Hydrogen bonds of hydrazinium 3,5-dinitro-4-oxylpyrazolate 3

图3 化合物5 的晶体分子结构图(a)和晶胞堆积图(b)Fig.3 Crystal molecular structure(a)and packing diagram(b)of compound 5
3.2 性能表征
3.2.1 热分解性能
在氮气氛下(流量为50 mL·min-1),温度范围50~300 ℃,升温速率5 ℃·min-1,试样量约为0.3~0.5 mg,试样皿为氧化铝坩埚的条件下对合成的含能化合物3~5 的热性能进行研究,其DSC-TG 结果如图4 所示。如图4a 显示,肼盐(3)在热分解过程中在86.4 ℃会脱去结晶水,然后在没有经历吸热熔化的相变过程,而是固相直接分解,且只有一个放热分解峰210.3 ℃。此放热峰峰型尖锐,温度跨度小,表明样品分解速度快,放热量大,失重率达到77.65%。草酰肼盐(4)则在94.7 ℃脱去结晶水,然后在没有经历吸热熔化的相变过程,而是固相直接快速分解,且只有一个放热分解峰203.7 ℃,失重率达到82.65%。4-氨基-1,2,4-三唑盐(5)在受热过程中在100.1 ℃会脱去结晶水,在140.5 ℃熔化,经历相变过程。随后在191.5 ℃直接快速分解,只有一个放热分解峰191.5 ℃,失重率为57.5%。对比三种化合物,可以看出,肼盐(3)的热稳定性最好,主要是因为其晶体结构中呈现较好平面堆积,与三维氢键网络协同为稳定性提供助益。

图4 化合物3~5 的DSC-TG 曲线Fig.4 DSC-TG curves of compounds 3-5
3.2.2 机械感度测定
化合物3~5 的撞击感度和摩擦感度是依据BAM标准测试法测定:药量(30±1)mg,落锤质量2 kg,3~5 的撞击感度和摩擦感度分别为36 J,360 N(3);36 J,360 N(4);36 J,360 N(5)。其感度均优于RDX(撞击感度为7.4 J;摩擦感度为120 N)和TNT(撞击感度为15 J;摩擦感度为353 N)[18]。
3.2.3 爆轰性能模拟
利用Gaussian09 程序[19]和等键方程(Scheme 2),并基于Born-Haber 能量循环机理[20],计算了离子型含能化合物3~5 的生成焓,分别为9.23(3),-392.36(4),213.95(5)kJ·mol-1。进一步依据理论模拟所得的生成焓和化合物的实测密度,利用Kamlet-Jacobs方程预测了其爆轰性能,结果见表4。由表4 可见,化合物3~5 的爆速为7797~8285 m·s-1,爆压为26.46~29.95 GPa,远高于TNT(爆速为6881 m·s-1,爆压为19.5 GPa)。

表4 化合物3~5 的理化学性质和爆轰参数Table 4 Physiochemical properties and detonation parameters of compounds 3-5

Scheme 2 Isodemic reaction for computing the HOF
4 结论
(1)以3,5-二硝基-4-溴吡唑为原料,经碱水解、中和、成盐三步反应合成了三个新型含能离子化合物,即肼盐(3)、草酰肼盐(4)和4-氨基-1,2,4-三唑盐(5)。并利用降温法培养了单晶,3 属于三斜晶系,空间群为P-1,晶体密度为1.752 g·cm-3;4 属于三斜晶系,空间群为P-1,晶体密度为1.829 g·cm-3;5 属于单斜晶系,空间群为P21/n,晶体密度为1.745 g·cm-3。
(2)采用DSC-TG 联用研究了其热稳定性,放热分解温度为191.5~210.3 ℃,其中肼盐的热分解温度为210.3 ℃,展现较好的热稳定性。
(3)按照BAM 测试条件,实测其撞击感度为36 J,摩擦感度为360 N,机械感度均比TNT 和RDX 钝感。
(4)基于计算生成焓和实测密度,利用Kamlet-Jacobs方程预测了它们的爆轰性能,理论爆速为7758~8288 m·s-1、爆压为26.06~29.96 GPa,远高于TNT。
