钼靶和超声引导下导丝定位技术在不可触及乳腺肿块中的应用
2021-08-12陈惟赵德绵金立亭汪铁军邵军冯尧军
陈惟,赵德绵,金立亭,汪铁军,邵军,冯尧军
(华中科技大学同济医学院附属湖北肿瘤医院乳腺外科,湖北武汉 430079)
近年来随着乳腺超声及钼靶筛查的广泛应用以及妇女对乳腺癌认知和健康意识的提高,越来越多体检无法触及的乳腺肿块被检出[1]。发现可疑病灶微钙化或无法触及的病变时,最常用的方法是活检及手术切除。在因病变无法触及而行活检或手术且被诊断为恶性肿瘤的患者中,大部分有较长时间的无病生存期[2]。因此,通过促进恶性乳腺肿块的早期诊断及切除,将大为提高女性患者的生活质量。超声引导下导丝置入定位及钼靶下导丝定位技术是针对不可触及的乳腺肿块早期诊断及治疗的关键,但临床上的接受度并不高。本研究通过比较不同定位方法对乳腺触诊阴性肿块的临床应用效果,旨在探讨超声引导下导丝定位及钼靶下导丝定位技术的应用价值。
1 资料与方法
1.1 一般资料
选取2016年12月至2019年12月我院临床体检无法触及,经彩超或钼靶检查发现单发乳腺病灶,并报告BI-RADS 4级及以上的患者或BI-RADS 3级但强烈要求手术的患者。当超声及钼靶发现同一肿块或钙化灶,进行超声下导丝定位,当彩超提示不明确,钼靶发现肿块或钙化灶进行钼靶下导丝定位。另外纳入同期不可触及的单发乳腺病灶行体表定位的患者作为对照。最终共纳入505例女性患者,其中超声引导下导丝定位患者248例,年龄18~75岁;钼靶引导下导丝定位患者112例,年龄25~72岁;体表定位患者145例,年龄22~72岁。三组患者基本资料见表1,组间年龄、BMI、乳腺肿块位置、大小及BI-BADS分级比较,差异均无统计学意义(P>0.05)。

表1 三组患者一般资料比较
1.2 方法
1.2.1 彩超引导下导丝定位
采用SuperSonic Imagine Aixplorer型弹性成像超声诊断仪,导丝定位使用Philips EPIQ 5超声诊断仪。 定位针为 BARD乳腺导丝定位针,导丝前端有“Y”型倒钩。术前2 h进行定位。采用超声探查患侧乳房,确定肿块的部位、数目、深浅等情况,然后消毒、铺无菌巾,涂无菌耦合剂作导声,探头用无菌塑料膜包裹。在肿块最长径线位置固定探头,定位针依据进针最短原则或手术路径刺入,使其针尖置于肿块中心,将探头横向探查再次进行确认,确保针尖在肿块内部。固定导丝,同时缓慢退出定位针鞘。再次横向、纵向扫查置留钩在肿块内,将定位导丝尾段较长部分用剪刀铰断,无菌纱布覆盖、固定。
1.2.2 钼靶引导下导丝定位
患者于术前2 h在放射科行钼靶引导下导丝定位。使用日本数字化乳腺X线诊断系统(AMULET,FDR MS-1000),采用BARD乳腺定位针定位。所有患者术前均行患侧乳腺X线头尾位(CC)、斜侧位(MLO)成像,计算穿刺进针深度与角度,根据病变位置选择进针方位。常规碘伏消毒后垂直乳腺皮肤表面插入定位针,再进行投照确认定位针位置,若有偏差,及调整进针深度与角度,再次投照进行确认。如此往复,直至确认定位针已在肿块内,固定导丝,拔出针鞘,消毒后包扎固定,转送手术室。
1.2.3 体表定位
患者取仰卧位,患侧上肢外展90°,在超声可视下的病灶表面用标记笔标记,手术时尽量保持与术前超声定位一致的体位,减少因体位改变导致的定位误差。
1.3 手术及术后评估
①超声导丝定位组患者彩超引导下导丝定位后2 h内进入手术室,麻醉成功后沿定位导丝进入病变部位, 手术切除导丝顶端周围直径2 cm范围组织并送病理检查。病理科对切除标本,肿块及切缘距离进行测量。②钼靶导丝定位组患者于钼靶下导丝定位后2 h内行手术活检。患者麻醉成功后,根据导丝的位置和方向设计手术切口,沿导丝引导方向充分暴露导丝所在腺体,达到导丝尖端位置,准确切除导丝定位的病变区。将切除的组织块再行钼靶X线摄片,以检验病灶切除是否完全。病理科对切除标本、肿块及切缘距离进行测量,切缘大于2 mm认定为完整切除。③体表定位组患者于体表定位后2 h内进入手术室进行手术,麻醉后于皮肤标记处切开皮肤,以其为中心,于周围约2 cm处分离切除乳腺组织以期将病灶包含在切除标本的中央。病理科对切除标本、肿块及切缘距离进行测量,切缘大于2 mm认定为完整切除。
三组患者均根据快速病理结果进行相应处理:若切缘干净且快速病理为良性,则逐层缝合腺体、皮下组织,可吸收线缝合皮肤;若切缘不净则扩大切除病灶,再次送病检,直至切缘阴性;若病理结果为恶性,则行乳腺癌改良根治术。
1.4 统计方法
应用SPSS 22.0统计软件进行数据分析。正态分布的计量资料以均数±标准差表示,计数资料用百分数 (%) 表示。两组间计量资料的比较采用独立样本t检验, 多组间计量资料比较采用One-way ANOVA检验。计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 围手术期结果
三组患者术前定位及围术期结果见表2。超声引导下导丝定位组、钼靶下导丝定位组及体表定位组完全切除肿块分别为237例(95.56%),106例(94.64%)及134例(91.41%)。与体表定位组比较,超声引导下导丝定位组和钼靶下导丝定位组定位时间长(t=13.96和t=20.17,P均<0.05),所产生的额外费用多(t=82.81和t=62.85,P均<0.05), 但切除肿块所需时间更少 (t=7.27和t=9.45,P均<0.05), 切除标本量更少 (t=11.52,t=5.14,P均<0.05), 切口长度更小 (t=7.21和t=3.37,P均<0.05)。

表2 三组患者术前定位及围术期结果
2.2 手术并发症
三组患者手术并发症见表3。超声引导下导丝定位组出现并发症33例(13.31%),其中导丝定位所致血肿5例,术中发现导丝移位8例,术后感染11例,术后血肿9例; 钼靶下导丝定位组并发症16例(14.29%),其中导丝定位所致血肿3例,术中发现导丝移位4例,术后感染5例,血肿4例;体表定位组并发症13例(8.97%),其中术后感染7例,血肿6例。术后患者均未发现深静脉血栓。三组患者并发症率比较,差异均无统计学意义(P>0.05)。
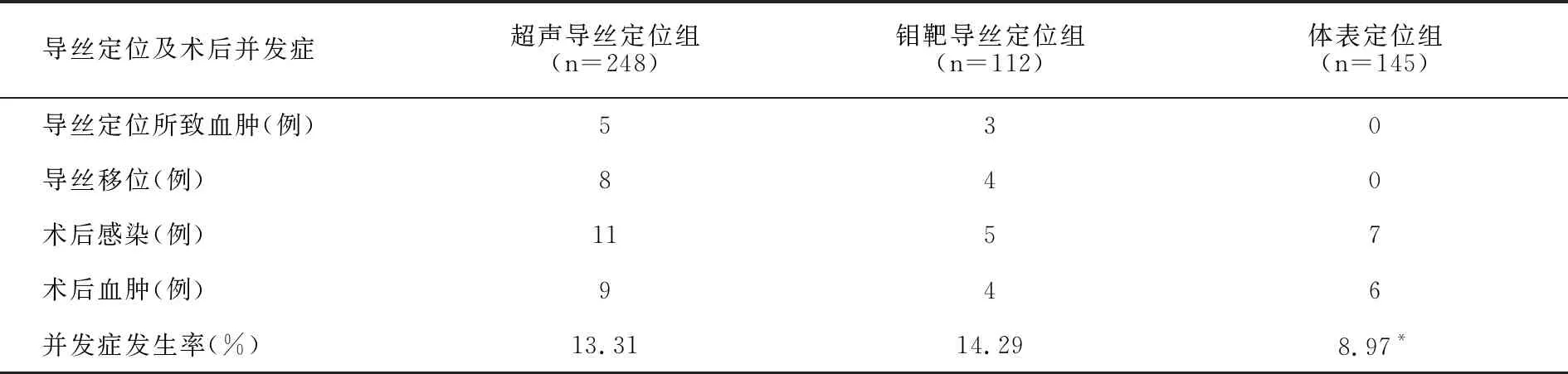
表3 三组患者手术并发症
2.3 病理结果
超声引导下导丝定位组248例患者中, 良性肿块201例(81.05%),恶性47例(18.95%);钼靶下导丝定位组112例患者中,良性肿块96例(85.71%),恶性16例(14.29%);体表定位组145例患者中,良性肿块123例(84.83%),恶性22例(15.17%)。详见表4。
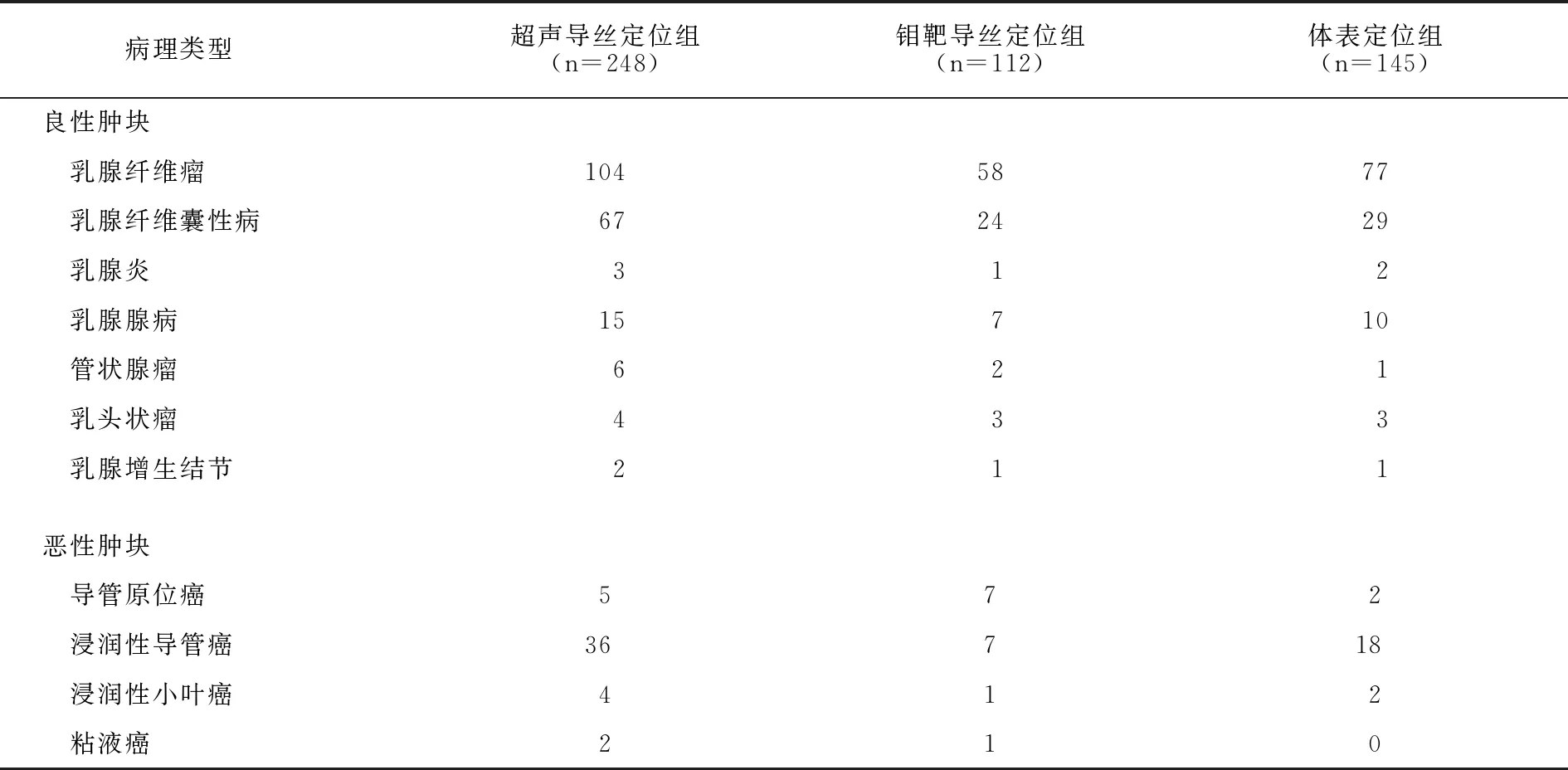
表4 三组患者切除肿块的病理结果(例)
3 讨 论
乳腺癌是目前严重威胁女性健康的临床疾病之一,且近年来其发病率呈逐年上升的趋势,因此提高乳腺癌早期诊断准确率能有效改善患者的生活质量,显著提高其生存率[3]。传统手术对体积小、位置深的乳腺肿块往往难以进行完全切除。随着影像学技术的不断发展及其应用领域的扩大,临床利用超声及钼靶检测出不可触及的乳腺肿块的准确率大大提高,但准确切除临床不可触及的肿块一直是临床医生面临的难题。借助影像学乳腺病灶表面皮肤标记是传统简便易行的定位方法, 但存在标记不准确,手术时间长,创伤大,不美观等缺点。因此,新的定位方法一直被不断探索,但不同的方法各有其优势和缺陷。目前较常用的导丝定位法已被国内外乳腺科临床医师广泛应用,但也存在准确定位困难,术前或术中导丝移位的不足。此外,很多患者在导丝定位时会感觉疼痛,外科医师和病理医师在进行操作时还可能会伤及自己。
相比乳腺肿块体表定位,超声引导下导丝定位可对触诊无法诊断出的肿块进行边界定位,定位时患者体位与术中体位保持一致,因此定位更准确,更利于手术操作,可有效减小切口长度[4]。若患者存在一个以上病灶,超声引导下导丝定位可同时对多处病灶进行定位,确保针尖准确进入肿块内。本研究同样证实,超声引导下导丝定位组患者手术切除肿块平均仅需(15.16±9.76)min,较体表定位手术所需时间(21.77±6.41)min明显缩短(P<0.05)。传统手术中,外科医生术中需要花费大量时间寻找肿块,并且随着手术的进行,手术视野及空间也会随之改变,术者需要及时调整切除方位与范围以求准确切除肿块。而对于导丝定位的患者, 手术医生可以根据导丝定位的方向、 角度, 快速找到肿块并进行切除,大大缩短了手术时间。乳腺组织切除量与术后乳腺外观有着明显关系,切除量过多,会导致乳腺局部塌陷、变形,甚至两侧严重不对称[5-6]。本研究显示,超声引导下导丝定位组患者所切除标本量仅为 (45.38±11.78) g, 明显小于体表定位组的(58.32±13.76) g, 手术切口直径为(1.76±0.66) cm, 亦小于后者的 (2.25±0.83) cm (P均<0.05),提示相较于体表定位,超声引导下导丝定位精确性更高,能减少对正常乳腺组织的切除量,符合目前乳腺外科微创化的要求。对于那些年轻且乳腺较小的病人,避免切除过多正常乳腺组织非常重要,可最大限度降低开放手术切除对乳腺外观的破坏,提升患者的满意度。
乳腺钼靶X线筛检的普及使更多乳腺癌得以早期诊断及治疗[7]。有研究表明,无法触及的乳腺癌较可触及肿块的乳腺癌恶性程度低,并且肿瘤细胞生物学活性、核异质性、转移潜能均降低,因此,早期发现触诊阴性的乳腺可疑病灶是提高乳腺癌早期诊断及治疗的重要措施[8]。来自国外的一项大型研究表明,常规自检并不能降低乳腺癌病死率,而乳腺钼靶X线筛查是能降低乳腺癌病死率的有效方法[6]。利用乳腺X线摄影对不可触及的乳腺可疑病灶进行准确定位及穿刺活检越来越受到外科医师和病理医师的重视,并成为确诊微小乳腺癌,尤其是临床不能扪及的隐匿性乳腺癌的主要手段[9]。本研究结果显示,钼靶下导丝定位患者手术切除所需时间仅为(15.79±3.84)min, 较体表定位手术所需时间(21.77±6.41)min明显缩短, 所切除标本重量平均 (50.89±12.42)g, 少于后者所切除的 (58.32±13.76)g,手术切口长(1.87±0.79)cm,亦小于后者的(2.25±0.83)cm(P均<0.05),进一步说明钼靶下导丝定位能够提升对不可触及肿块手术切除的准确性。
钙化灶是早期发现乳腺病变的重要依据,对临床触诊阴性且缺乏临床症状者尤其如此。钙化往往是早期乳腺癌X线检查最常见的直接征象之一,并且有研究发现钙化可能是乳腺癌预后的独立因素之一[10]。文献报道在病理报告的2 359个钙化病灶中,有404例是乳腺导管癌,乳腺导管癌钙化诊断范围广,生长速度快于良性乳腺疾病。钙化的早发现及其变化率可能有助于鉴别良恶性钙化[11]。本研究中钼靶定位的112例中有76例伴有明显钙化,占67.86%,而超声导丝定位的248例中仅42例肿块伴明显钙化,占16.94%,提示对有明显钙化灶的肿块的早期发现与诊断,钼靶比超声更具优越性。但相较于超声引导下导丝定位组及体表定位组,钼靶定位所用时间及费用更多,分析原因在于钼靶导丝定位一次性成功率低,往往需要多次进针,调整角度才能准确插入肿块内部。并且由于钼靶对于钙化的辨识度高,术前所发现的散在钙化灶在术中难以触及,主刀医生为避免残留钙化灶,往往倾向于扩大手术切除范围而造成手术时间的延长。钼靶导丝定位术中所切除标本需重新在钼靶下检查,以便确认术前发现的钙化或肿块在所切除的组织内,因而导致费用较高。
本研究中, 超声引导下导丝定位组的完整切除率达到95.56%(237/248),病理确定良性肿块201例(81.05%), 恶性肿块47例 (18.95%); 钼靶下导丝定位组完整切除率为94.64%(106/112),其中良性肿块96枚(85.71%),恶性肿块16例(14.29%);两组病灶恶性检出率与其他文献报道相似[12-13]。并发症方面,超声与钼靶导丝定位术前均出现血肿及导丝移位,但发生率较低,术后三组患者均未发现深静脉血栓病例,仅少部分患者出现血肿和感染。三组患者术后并发症发生率无明显差异,提示超声引导下与钼靶下导丝定位方法安全性良好。
综上所述,超声、钼靶引导下导丝定位可有效诊断出微小病灶,对不可触及的乳腺肿块具有较好的诊断价值,有助于临床医师术中准确切除病灶,并且具有操作简单、定位准确等优点,对临床触诊不到的乳腺肿块有着积极意义,值得推广应用。
