膈下逐瘀汤对输卵管炎性不孕模型大鼠的影响*
2021-08-11刘丽袁孟珂李月刘进哲邓楠
刘丽,袁孟珂,李月,刘进哲,邓楠
1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学,黑龙江 哈尔滨 150040
不孕症指婚后未避孕、有正常性生活、同居至少1年而未孕者,属于妇科疑难病,困扰着广大有生育需求的妇女。目前我国不孕症的发病率为3.5%~11.3%[1],其中输卵管的因素约占40%[2]。现代医学认为,由于病原体感染或急性炎症未得到及时治疗引起管壁黏膜破坏,输卵管完全阻塞等而致不孕,所涉及的病原体有支原体、衣原体、淋球菌、金黄色葡萄球菌等[3]。治疗上多用宫腔镜、腹腔镜内镜微创及辅助生殖技术等,但存在成本高、反复发作等问题。中医学认为,不孕症是由于湿、热、瘀、毒相搏结,导致气血运行不畅,胞络不通而不能受孕,病机关键在于“瘀”[4]。刘丽教授基于该病机理论,治疗上以“通”为主,运用膈下逐瘀汤(出自清代王清任的《医林改错》)加减化裁,临床上有很好的治疗效果。本研究通过复制气滞血瘀型输卵管炎性不孕大鼠模型,旨在从抑制免疫反应及抗纤维化的角度去探讨膈下逐瘀汤的治疗机理。
1 材料
1.1 动物SPF级SD雌性大鼠60只,体质量180~220 g;SPF级SD雄性大鼠10只,体质量 250~280 g,购自辽宁长生动物有限公司,合格证号:SCXK(辽)2015-0001,在黑龙江中医药大学实验动物中心饲养,合格证号:SYXK(黑)2016-004,标准化环境(室温18~24 ℃,相对湿度:40%~75%,12 h昼夜交替)饲养。
1.2 药品与试剂膈下逐瘀汤(牡丹皮15 g,枳壳15 g,延胡索20 g,赤芍15 g,鳖甲15 g,地龙15 g,乌药15 g,香附20 g,川芎15 g,桃仁15 g)(黑龙江中医药大学附属第一医院中药饮片药局提供,批号:20180306)。水合氯醛(上海山浦化工有限公司,批号:20160709);金黄色葡萄球菌(北京东方赛瑞生物技术有限公司,货号:FSCC223005);Trizol试剂(北京博奥森生物技术有限公司,货号:C6028);TGF-β1、p38 MAPK及β-actin 的引物由北京博奥森生物技术有限公司合成。
1.3 仪器-80 ℃超低温冰箱(德国Eppendorf公司);电子天平(北京赛多利仪器有限公司);铺片器(中国天津久恒医疗电子仪器有限公司);SDG-1声、光、电刺激仪(中国中医科学院西苑医院基础研究室);实时荧光定量PCR仪(美国Bio-Rad公司)。
2 方法
2.1 药物的制备取膈下逐瘀汤各味中药,第1次以10倍量水,第2次以8倍量水煎煮,每次均加热回流2 h,合并两次药液,浓缩至适当浓度后转移至蒸发皿中,于真空干燥箱中干燥至恒重,得到膈下逐瘀汤水煎液干粉,实验时加蒸馏水配置。
2.2 动物造模、分组与给药将60只雌性大鼠按体质量随机分为空白组、模型组、膈下逐瘀汤(低、中、高剂量)(0.324 g·kg-1、0.648 g·kg-1、1.296 g·kg-1)组,每组12只。除空白组外,其余大鼠均用10%水合氯醛腹腔麻醉,向输卵管注入 4×109CFU·mL-1的金黄色葡萄球菌混悬液 0.1 mL,1周后待大鼠伤口愈合后,行声光电、夹尾、倾斜鼠笼复合刺激,持续3周[5]。造模后第29天开始进行相应药物的灌胃,空白组及模型组给予同体积的蒸馏水,连续给药28 d。
2.3 检测指标
2.3.1 观察大鼠的宏观表征观察大鼠的精神状态、舌象,为方便观察与统计分析,参考临床模式对大鼠的宏观表征进行量化[6],见表1。

表1 大鼠的精神状态、舌象评分表
2.3.2 计算受孕率将10只成熟雄性大鼠随机分为5组,每组2只,分别与各组的6只雌性大鼠进行合笼处理,10 d后计算受孕率。
2.3.3 HE染色观察大鼠输卵管组织形态每组随机取3只大鼠,开腹后肉眼观察输卵管形态、色泽、弹性、管壁厚度、有无积水积脓,管壁有无血管肿胀及与周围组织有无粘连等,取双侧输卵管,进行HE染色观察其病理学变化。
2.3.4 RT-PCR法检测输卵管组织TGF-β1mRNA、p38MAPKmRNA水平每组随机选取3只大鼠,以10%水合氯醛腹腔麻醉后,取双侧输卵管,置入冻存管内,放入液氮中,-80 ℃保存。以Trizol试剂提取总RNA,逆转录合成cDNA,加入下游引物进行扩增。检测TGF-β1mRNA、p38MAPKmRNA水平,具体引物序列见表2。

表2 引物序列

3 结果
3.1 大鼠的宏观表征与空白组相比,模型组大鼠精神状态异常,舌底偏黯,舌静脉增粗,评分升高(P<0.05);与模型组相比,膈下逐瘀汤低、中、高剂量组大鼠精神状态有明显改善(P<0.05),膈下逐瘀汤中、高剂量组大鼠舌质有明显改善(P<0.05)。见表3。

表3 大鼠精神状态及舌象评分情况 分)
3.2 对输卵管炎性不孕模型大鼠受孕率的影响与空白组相比,模型组大鼠的受孕率降低;与模型组相比,膈下逐瘀汤低、中、高剂量组大鼠的受孕率升高,见表4。

表4 对输卵管炎性不孕模型大鼠受孕率的影响
3.3 大鼠输卵管组织的病理变化空白组大鼠输卵管管壁颜色红润,质地光滑,粗细均匀,弹性良好,与周围组织无粘连,未见炎性细胞浸润,结构良好;模型组大鼠输卵管管壁颜色紫暗,增粗积水,弹性差,与周围组织粘连,可见输卵管周围大量炎细胞浸润(淋巴细胞为主),组织肿胀明显,黏膜上皮细胞脱落,输卵管组织结构排列紊乱;膈下逐瘀汤高剂量组大鼠输卵管组织周围见少量炎性细胞,上皮细胞轻度脱落;膈下逐瘀汤中剂量组大鼠可见少许淋巴细胞,少量黏膜上皮细胞脱落,管腔可见少量渗出液;膈下逐瘀汤低剂量组大鼠输卵管渗出液较多,炎性细胞浸润,上皮细胞脱落明显,胞体肿胀。见图1。

图1 大鼠输卵管组织的病理变化(HE,×200)
3.4 对输卵管炎性不孕模型大鼠输卵管组织TGF-β1mRNA、p38MAPKmRNA的影响与空白组相比,模型组大鼠输卵管组织TGF-β1mRNA、p38MAPKmRNA水平均明显升高(P<0.05);与模型组比较,膈下逐瘀汤中、高剂量组大鼠输卵管组织TGF-β1mRNA水平均明显降低(P<0.05),膈下逐瘀汤低、中、高剂量组输卵管组织p38MAPKmRNA表达明显降低(P<0.05)。见图2。
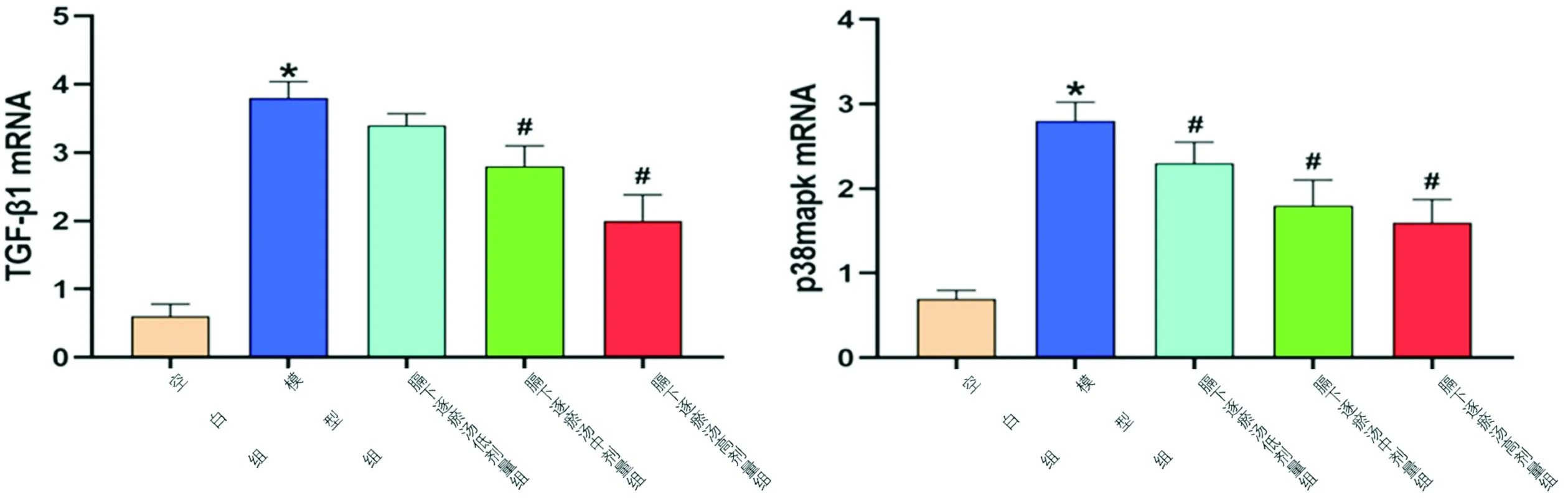
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05图2 大鼠输卵管组织中TGF-β1 mRNA、p38 MAPK mRNA的表达
4 讨论
本研究通过向输卵管注菌及复合刺激大鼠等方式复制气滞血瘀型输卵管炎性不孕病证结合模型。结果显示,膈下逐瘀汤组大鼠宏观表征积分降低、输卵管组织TGF-β1mRNA、p38MAPKmRNA水平降低、受孕率提高。TGF-β1、p38 MAPK均与炎症损伤、纤维化密切相关,纤维化是炎症增生的修复反应,但过表达可使原有组织遭到破坏,影响器官的正常功能[7-8]。
TGF-β1是TGF-β家族中含量最丰富、作用最强的一类相关生长因子,对细胞的生长、分化、迁移、凋亡及细胞外基质的生成均有调节作用,也是目前对多种组织器官纤维化治疗的新靶点[9]。在纤维化进程中,TGF-β1/Smad通路是普遍认为的关键信号通路[10],TGF-β1是上游启动因子,与相应受体结合后,开始发生纤维化,经过一系列复杂的下游信号传导,可启动α-平滑肌肌动蛋白(α-SMA)基因的表达,导致成纤维细胞增生,并转化为大量的肌成纤维细胞,从而导致粘连的发生[11-12]。研究证明,TGF-β1在肝、肺、肾纤维化及肠粘连、腹腔粘连等的发生发展中均起着重要作用[13-18]。输卵管阻塞患者输卵管内膜TGF-β1表达较对照组明显增高[19-20]。同时,TGF-β1的表达和宫腔粘连程度呈正相关性[21]。
p38 MAPK信号通路是MAPK通路家族的一个亚族,参与炎症反应,且在该家族中占有至关重要的作用[22],当被应激(如H2O2、缺氧等)、炎症因子(如肿瘤坏死因子-α、白细胞介素-1等)及病原体成分刺激后发生磷酸化,进一步影响转录因子的表达,启动相关基因,参与对多种细胞因子的调控[23]。研究表明,p38 MAPK在调控细胞因子表达机制中发挥着重要作用,抑制该通路可降低促炎因子水平,缓解炎症[24-26]。p38 MAPK作用广泛,它可同细胞内其他信号通路之间相互联系,作为共同通路或是交汇点参与到多种细胞内信号传导系统中去,并在多因素诱导的疼痛中起着重要作用[27-28],其抑制剂对炎性疼痛模型大鼠发挥良好的镇痛作用[29]。TGF-β1 可激活肾成纤维细胞,作为上游信号,通过激活TGF-β1/p38 MAPK通路发挥其生物学效应[30],也可作为下游信号产物参与肝纤维化过程[31-32]。
研究显示,模型组TGF-β1mRNA、p38MAPKmRNA水平升高而治疗组降低,说明膈下逐瘀汤可能是通过抑制了与该因子相关的纤维化过程。但是在该模型中TGF-β1、p38 MAPK表达升高后,引起通路中各个环节发生的具体改变及变化程度,及所涉及的其他相关通路,有待进一步研究。
