类胡萝卜素肠道吸收及生物利用度研究进展
2021-08-11郑梦熳李文韵刘雨薇
郑梦熳,李文韵,刘雨薇
(复旦大学公共卫生学院,上海 200032)
类胡萝卜素是自然界最重要的天然色素之一,普遍存在于动物、植物、真菌和藻类中。目前已发现的类胡萝卜素约有750种,食品中常见的类胡萝卜素有40多种[1]。在人类血液样本中可检测到30余种类胡萝卜素,其中α-胡萝卜素、β-胡萝卜素、番茄红素、叶黄素、玉米黄质和β-隐黄素在血浆含量最高[2]。类胡萝卜素是四萜类化合物[3],所有类胡萝卜素都具有聚异戊二烯基本结构,其常见的化学特征有共轭双键长链和中心双键的近端对称性[4];通过对基本结构的修饰,如端基环化及引入氧官能团,可衍生出不同类胡萝卜素。大多数类胡萝卜素可以用通式C40H56On(n为0~6)来描述,六种人体内主要类胡萝卜素的结构见图1。

图1 六种人体内主要类胡萝卜素的结构Fig.1 The structures of the six main carotenoids in humans
类胡萝卜素在人类的营养与健康中起着重要的作用,β-胡萝卜素、α-胡萝卜素、γ-胡萝卜素和β-隐黄素等可以在双加氧酶的作用下形成维生素A[5−6],称为维生素A原活性物质,其中β-胡萝卜素具有100%的维生素A原活性,是维生素A的主要来源。作为人体必需的微量营养素,类胡萝卜素还具有抗氧化[7]、抗癌[8]、预防眼底黄斑病变和白内障[9]、预防心血管疾病[10]、加强机体免疫[11]等功能。人体自身无法合成类胡萝卜素,只能从食物中摄取,主要的食物来源为黄色或橘色的水果以及绿叶蔬菜。类胡萝卜素作为亲脂性营养素,需要从食物基质中释放出来,并在消化过程中乳化掺入胶束中,才能被肠道吸收[12]。然而由于类胡萝卜素溶解性差、不稳定,从食物基质中释放不完全以及在消化过程中存在潜在的降解,它们的生物利用度通常很低[13−14]。如何改善类胡萝卜素的生物利用度,充分发挥其生理功能,最大程度地提高类胡萝卜素的促健康效益,已逐渐成为研究的重点。本文以类胡萝卜素转运蛋白为重点,介绍类胡萝卜素在胃肠道的消化吸收过程,并对影响类胡萝卜素生物利用度的因素进行综述。
1 类胡萝卜素的生物利用
1.1 类胡萝卜素的消化过程
食物基质中的类胡萝卜素在加工过程中由于受热或机械作用等初步释放,摄入人体后,在口腔的咀嚼作用和唾液酶的化学作用下进一步释放,而后在胃蠕动和胃酶(胃蛋白酶、脂肪酶、淀粉酶等)的作用下,分散溶解在脂质乳液中并转移到小肠。在胰液和胆汁的双重消化作用下,脂肪被水解,类胡萝卜素从乳液中释放出来,与其他脂质(胆固醇、磷脂)、脂质消化产物(游离脂肪酸、单酰基甘油、溶血磷脂)和胆盐等掺入混合胶束中[15]。胶束是由胆盐外壳围绕疏水性脂质核心组成的圆盘状结构,类胡萝卜素被容纳于胶束核心中,混合胶束的直径约为4~60 nm[16],小于肠粘膜与管腔之间粘蛋白糖蛋白网络的孔直径(100~300 nm)[17],胶束可通过黏蛋白层扩散到排列于胃肠道管腔边界的吸收性上皮细胞表面[18]。
1.2 类胡萝卜素在小肠上皮细胞的吸收
胶束到达上皮细胞表面后,其中的脂肪酸在酸性条件下质子化,从胶束中脱离,胶束解离后,类胡萝卜素释放[15],并通过被动扩散或在刷状缘转运蛋白的作用下,转移到细胞内部,进一步发挥其生理功能。
过去一直认为类胡萝卜素的肠道吸收方式仅为被动扩散[19],但在人群中观察到的个体间吸收差异,在细胞水平的异构体选择性[20],以及和类胡萝卜素间、类胡萝卜素与其他脂溶性微量营养素之间的吸收竞争[21]都表明类胡萝卜素的吸收不是简单的被动扩散,而有肠道转运蛋白参与其中,现有研究主要聚焦于以下三种(图2):
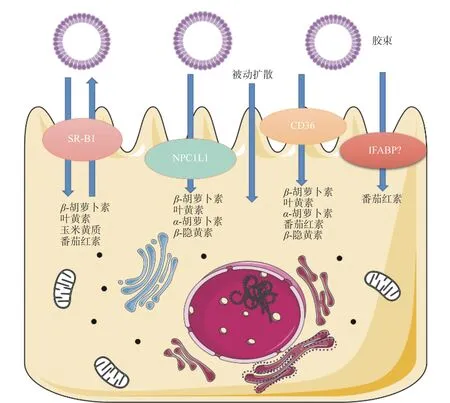
图2 参与肠上皮细胞类胡萝卜素吸收的转运蛋白Fig.2 Transporters involved in the absorption of carotenoids at the apical membrane of the enterocyte
第一种是B类1型清道夫受体(Scavenger Receptor class B type 1,SR-B1)。在肠内,SR-B1主要表达于十二指肠到直肠的肠细胞刷状缘膜(brush border membrane,BBM)[22],作为多配体转运蛋白,除了选择性地摄取游离或酯化的胆固醇、磷脂及三酰甘油水解产物等进入细胞[23],还参与肠道类胡萝卜素的吸收。2005年,研究者利用Caco-2细胞(人克隆结肠腺癌细胞)实验发现SR-B1参与肠道β-胡萝卜素[24]、叶黄素的吸收[25]。SR-B1基因敲除小鼠与COS-7细胞(非洲绿猴经SV40病毒基因转化的肾成纤维细胞)实验也证明SR-B1对于β-胡萝卜素的摄取至关重要[26]。随后的研究证明,SR-B1参与玉米黄质[27]和番茄红素[28]的吸收。
第二种是脂肪酸转运酶(Cluster Determinant 36,CD36),表达于十二指肠与空肠的肠细胞BBM。与SR-B1相似,CD36表现出低的配体特异性,可以与高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)、阴离子磷脂、脂肪酸、游离胆固醇等结合[29]。在转染COS-7细胞和小鼠BBM囊泡实验中,CD36首次被证明参与β-胡萝卜素的摄入[26]。在3T3-L1细胞(小鼠胚胎成纤维细胞(前脂肪))和脂肪组织培养中,CD36被证明参与番茄红素及叶黄素的吸收[30]。此外,Caco-2细胞实验证明, CD36参与其它维生素A前体物质α-胡萝卜素、β-隐黄素的摄取[31]。
第三种是尼曼-匹克C1型类似蛋白1(Niemann-Pick C1-like 1,NPC1L1),它是肠道中主要的胆固醇和植物固醇转运蛋白。有实验表明,NPC1L1参与α-胡萝卜素、β-胡萝卜素、β-隐黄素和叶黄素的肠道摄取[24−25],而不参与番茄红素的摄取[28]。
此外,有研究发现,肠道脂肪结合蛋白(IFABP)的遗传变异可能与人体空腹血浆中番茄红素的浓度有关[32],但仍需更多证据来证明IFABP是类胡萝卜素转运载体。目前,研究者尚未完全明确人类肠道中类胡萝卜素载体蛋白的种类和功能,需要更多针对类胡萝卜素肠道吸收载体的分子生物研究来明确其转运过程及生理机制。
1.3 类胡萝卜素的生物利用度
类胡萝卜素在人体的吸收利用程度常用生物可及性和生物利用度这两个指标进行评估。类胡萝卜素的生物可及性(Bioaccessibility)是指类胡萝卜素在胃肠道消化过程中从食物基质释放出来,可被肠道吸收的部分。类胡萝卜素的生物利用度(Bioavailability)是指摄入的类胡萝卜素参与体循环,用于正常生理功能或在人体中存储的比例。生物可及性是生物利用度的前提,两者共同反映类胡萝卜素的生物利用程度。
类胡萝卜素的化学结构使其具有高度脂溶性,不溶于水,仅部分溶于植物油、动物脂肪和生物膜[5],且类胡萝卜素的结构不稳定,对光、热、金属离子等敏感[33],其生物利用度非常低[7],例如β-胡萝卜素的生物利用度为4%~14%,番茄红素的生物利用度仅为0.1%~1.5%[34]。近年来,研究多采用动物实验、人体实验和体外实验(体外消化模型及Caco-2细胞模型)来研究类胡萝卜素的生物利用度[35]。相较于动物或人体实验,体外消化模型较少涉及伦理问题,具有成本低、试验周期短、结果可重复强等优点,且通常可以更轻松地收集、分析样品,直观地了解消化过程中发生的物理化学变化(例如结构变化、成分变化和释放机制等)[36],现已被广泛地应用于营养与健康研究中。在类胡萝卜素体外消化研究中,多采用胶束化率作为评价其生物利用度的重要指标,即从消化了的食物中转移到胶束相的那部分类胡萝卜素的比例[37]。由于Caco-2细胞与人体小肠上皮细胞的结构功能类似,研究多使用 Caco-2细胞模型来模拟胶束相类胡萝卜素被小肠上皮吸收的过程[38],大多数体外研究通常将体外消化模型与Caco-2细胞模型两者结合使用。
2 影响类胡萝卜素生物利用度的因素
2.1 类胡萝卜素的亲脂性与化学存在形式
类胡萝卜素亲脂性的强弱将影响其生物利用度。类胡萝卜素从食物基质中释放出来,须先在消化道中分散溶解,形成混合胶束才能被吸收。因此胶束的形成是影响类胡萝卜素吸收的重要因素之一,而类胡萝卜素分子的亲脂性强弱是影响胶束形成和转运的关键。一项大鼠实验发现,类胡萝卜素的生物利用度(叶黄素>β-胡萝卜素>番茄红素)与其亲脂性成反比[39],推测原因是亲脂性较弱的叶黄素经消化后在大鼠肠道中更容易形成胶束。然而,Caco-2细胞体外模拟小肠吸收试验的结果与大鼠实验相反,该研究发现β-胡萝卜素的吸收率高于叶黄素。研究者认为可能是因为亲脂性强的β-胡萝卜素形成的胶束更稳定,较易转运到细胞中[40]。亲脂性强弱对类胡萝卜素的生物利用度的影响及机制需要通过更多体内体外实验做进一步确定。
类胡萝卜素主要有4种化学存在形式:全反式类胡萝卜素、全反式酯化类胡萝卜素、顺式类胡萝卜素和顺式酯化类胡萝卜素。自然界中的天然类胡萝卜素以全反式为主,但是在热处理过程中会产生顺式异构体[41]。与相应全反式类胡萝卜素相比,顺式异构体不再是线性的刚性分子,结晶或聚集的趋势减弱,它们在混合胶束中具有更高的溶解度,比全反式类胡萝卜素更容易掺入胶束,从而使生物利用度更高。例如,与全反式β-胡萝卜素相比,顺式β-胡萝卜素异构体在混合胶束中的溶解度更高,生物利用度也更高[42]。顺式番茄红素异构体也呈现出比全反式番茄红素更高的生物利用度[43]
过去认为,类胡萝卜素仅以游离分子的形式被吸收,而被酯化类胡萝卜素不被吸收。但是有临床研究显示,叶黄素酯的生物利用度与游离叶黄素相当[44],玉米黄质二棕榈酸酯的生物利用度甚至高于游离的玉米黄质[45]。这些结果表明被酯化的类胡萝卜素在肠腔中的水解是高效的,且它们同样可以被小肠上皮细胞吸收。
2.2 食物基质
2.2.1 类胡萝卜素的存在位置及存在状态 在绿叶植物中,类胡萝卜素通常作为光合作用的辅助色素在叶绿体亚细胞器类囊体膜上累积[46],协助叶绿体吸收光,提高光合效率。在非光合作用植物中,类胡萝卜素通常存在于色质体中。常见的色质体结构形态有晶体状、球状、纤维状、膜状或管束状等[47],最常见的是球状色质体,类胡萝卜素以脂质形式溶解其中;管束状色质体中的类胡萝卜素通常以液晶体形式存在;晶状体色质体中类胡萝卜素则呈晶体形式[48]。体外消化实验表明,芒果和木瓜中液态和液晶球状的β-胡萝卜素的释放率大于番茄和胡萝卜中晶体β-胡萝卜素的释放率[49]。人群随机交叉实验也证明,木瓜中β-胡萝卜素的生物利用度约为胡萝卜和西红柿的3倍,胡萝卜和番茄中β-胡萝卜素的生物利用度差异不明显[50]。另有研究发现,细胞壁和色质体是类胡萝卜素消化释放过程中最重要的结构性障碍。类胡萝卜素的包封水平越高,生物可及性便越低[51]。由此,非植物来源食物中类胡萝卜素因并未被细胞壁和膳食纤维包封,其生物可及性要高于植物来源食物中的类胡萝卜素。例如,鸡蛋中的叶黄素比菠菜中的叶黄素具有更高的生物可及性[52]。
2.2.2 食物脂肪 类胡萝卜素的非极性结构使其具有高疏水性、低生物可及性。与油脂一起食用,可以改善类胡萝卜素的生物可及性。从食物基质中释放的类胡萝卜素溶解在脂肪中,刺激肠脂肪酶、胆盐和磷脂的分泌,消化脂滴并形成类胡萝卜素混合胶束[53]。同时,脂质会延迟胃排空和消化物通过小肠的速度,从而为胶束中脂肪酸、单酰基甘油酯和溶血磷脂的释放和溶解提供了更多时间[54]。另外,甘油三酯通过促进乳糜分泌,可以促进类胡萝卜素向肠细胞外分泌,防止其在细胞内积累,进而促进吸收[18]。
在消化之前(例如在加工过程中,通过高压均质处理)在食物基质中掺入油相,可得到富含类胡萝卜素的乳化脂质相[55],其属性将影响乳化脂滴在胃肠道的消化过程[56],例如改变脂质与肠道脂肪酶的相互作用,影响油的消化,进而影响胶束的形成及类胡萝卜素的生物可及性。
有研究表明,乳液脂滴的大小将直接影响脂质的消化和类胡萝卜素的生物利用度[57]。脂滴粒径较小的乳液具有较高的活性表面积,有更多肠道脂肪酶吸附结合位点,使脂质消化更快,消化率更高。β-胡萝卜素体外消化模型显示,当乳液通过口、胃和小肠相组成的模拟胃肠道(GIT)时,由于胰脂肪酶暴露的脂质表面积随脂滴粒径的减小而增加,脂质消化的速率和程度也会因此增加,使β-胡萝卜素的生物利用度明显提高[57]。一项类胡萝卜素消化动力学研究也发现,乳液的初始脂滴大小会显著影响脂质的消化动力学,随着脂滴尺寸的减小,胶束形成、类胡萝卜素掺入以及消化的速率都有所增加。平均粒径小于1 μm的亚微米乳液在消化过程中表现出较高的单酰基甘油转化为游离脂肪酸(FFA)的能力,使混合胶束中FFA的浓度更高,类胡萝卜素掺入混合胶束的速度更快。脂滴粒径较大的乳液在消化结束时仍然含有未消化的油,而脂滴粒径较小的乳液则几乎完全水解[58]。近年来,研究者将目光逐渐转移到了粒径更小的纳米乳液。纳米乳液的平均半径仅在10~100 nm之间,这意味着与传统乳液相比,纳米乳液不易聚集或因重力分离[59]。类胡萝卜素纳米乳液不仅可以改善类胡萝卜素的溶解性,加强细胞的有效吸收,提高其生物利用度,还可以控制类胡萝卜素释放的速度,将纳米乳液掺入透明或微浊的产品中,也不会改变其外观[60],因此纳米乳液作为靶向输送生物活性物质的基质,在食品和制药行业中表现出了巨大潜力。
油的类型也会影响类胡萝卜素的生物可及性。其中,甘油三酯的碳链长度是一个重要的因素。分别以长链甘油三酯(LCT)、中链甘油三酯(MCT)及橙油作为载体油制成的β-胡萝卜素纳米乳液体外消化实验显示,肠道中游离脂肪酸产生速率及数量的排序为LCT≈MCT>橙油,β-胡萝卜素在LCT纳米乳液中的生物可及性远高于MCT纳米乳液,这归因于长链FFA形成的混合胶束比中链FFA形成的有更大的疏水性核心,能够容纳更多β-胡萝卜素分子[61]。此外,脂肪酸的饱和程度也会影响类胡萝卜素的生物可及性。Caco-2细胞实验与体外消化模型表明,小肠上皮细胞BBM会更多地吸收不饱和脂肪酸混合胶束中的类胡萝卜素[62]。人群实验也发现,菜籽油(6%饱和脂肪酸:94%不饱和脂肪酸)比黄油(70%饱和脂肪酸:30%不饱和脂肪酸)更能提高叶黄素与α-胡萝卜素的生物可及性[63]。
2.2.3 生物大分子 膳食纤维会通过与参与胶束形成的胆盐和脂肪酶相互作用或增加肠道内容物粘度而阻碍类胡萝卜素胶束向刷状边缘扩散,从而降低类胡萝卜素的生物利用度[64]。乳液中的纤维还会影响乳液的结构特性,例如改变脂滴的大小及其流变特性[65]。此外,特殊的膳食纤维,如果胶,可以在特定的条件下充当乳化剂,影响乳液的消化过程,进而影响脂肪的消化率和脂溶性物质的吸收[66]。在一项膳食纤维对人类血清胡萝卜素含量影响的研究中,当受试者在餐后被给予食用果胶,血浆β-胡萝卜素的含量会降低42%[67]。虽然单独食用果胶会损失类胡萝卜素的生物利用度,但是由于果胶无毒且稳定性高,因此常被作为密封剂用于生物活性物质的封装系统中,用以控制生物活性物质的释放[68]。例如,将甜菜果胶添加到乳清蛋白分离物乳液中,可以控制β-胡萝卜素的释放[69]。近年来,超分子包合物已被广泛使用于药物和食物输送,它可以改善低可溶性药物的溶解度和稳定性,并降低其毒性和副作用[70]。最近,研究致力于类胡萝卜素与天然寡糖/多糖的包合物,认为这些包合物对类胡萝卜素具有保护性并可以降低其疏水性[71]。例如玉米黄质、叶黄素分别与甘草酸及其二钠盐、与阿拉伯半乳聚糖形成的超分子复合物可使玉米黄质及叶黄素的溶解度、稳定性显著增强[72]。天然高分子物质海藻酸盐具有良好的生物相容性,使用壳聚糖-海藻酸酯复合材料制备的β-胡萝卜素双层乳液在不利条件下(高温、大离子强度、低pH)仍具有良好的稳定性[73]。有研究通过氧化钙凝胶法制备的用于输送叶黄素的海藻酸钠-叶黄素微球可以为叶黄素提供抗氧化屏障,并使叶黄素的肠溶性增加,从而获得更高的生物利用度[74]。
2.2.4 类胡萝卜素之间及类胡萝卜素与其他营养素的相互竞争 当多种类胡萝卜素被同时摄入时,可以观察到它们之间的竞争性吸收现象。雏鸡饲养实验发现,当大量摄入叶黄素、玉米黄质或β-胡萝卜素的任何一种时,会降低血浆和大多数组织中其他类胡萝卜素的浓度,例如高叶黄素补充剂会降低玉米黄质水平,高玉米黄质补充剂会降低叶黄素水平,高β-胡萝卜素补充剂会降低叶黄素和玉米黄质的水平[75]。
此竞争现象常发生于类胡萝卜素掺入胶束或乳糜微粒时。例如,叶黄素可显著降低β-胡萝卜素的胶束化[76]。这可能是由于叶黄素位于脂滴表面,而β-胡萝卜素位于脂滴的中心,需要转移到脂滴的表面才能形成胶束,这使β-胡萝卜素更易受到其他类胡萝卜素的竞争。健康人群实验也证明,在单种类胡萝卜素膳食中添加第二种类胡萝卜素,会减少第一种类胡萝卜素的乳糜微粒反应。例如,在天然蔬菜基质中,番茄红素、叶黄素和β-胡萝卜素会相互竞争以掺入乳糜微粒[21]。
类胡萝卜素的吸收竞争还可能发生于胶束中的类胡萝卜素与其他微量营养素之间。例如,在体外模型中,双氢黄酮类化合物柚皮苷与β-胡萝卜素竞争掺入混合胶束,对β-胡萝卜素的生物可及性产生明显的抑制作用[77]。已有研究表明,二价矿物质离子会干扰胶束的稳定性[35],与游离脂肪酸反应形成不溶性皂[78],同样地,它们也可以与胆盐反应,阻碍类胡萝卜素的乳化作用,导致胶束的显著减少[79]。一项研究同时使用体外消化模型与Caco-2细胞模型,发现矿物质离子(Ca2+、Fe2+、Zn2+、Mg2+)以浓度依赖性的方式显著抑制类胡萝卜素的胶束化及细胞摄取,研究还发现,Fe2+与Zn2+的抑制效果大于Ca2+与Mg2+,并且当Fe2+的浓度达到12.5 mmol/L时,可使胶束化率与细胞摄取率降至最低,分别降至对照组(未添加矿物质)的22.5%与5.0%[79]。一项体外消化研究也发现,较大浓度的钙离子会使乳状液发生絮凝与聚结,抑制β-胡萝卜素胶束化,从而减少其消化吸收率[80]。然而餐后随机交叉双盲试验的结果却与之相反,该研究招募了25名健康非肥胖男性,经过两周洗脱期后,在每隔一周的情况下,分别接受270 g菠菜及0、500或1000 mg的钙,结果显示,补充高浓度但仍在生理浓度范围内的钙似乎对菠菜中类胡萝卜素的生物利用度没有影响[81]。两种实验结果的差异可能来自于膳食种类差异、膳食中主要的类胡萝卜素差异、用于比较的指标差异等,也可能是体外消化模型并没有考虑人体在酶和胆盐分泌方面的潜在动态适应性。
2.2.5 加工方法 蔬果中的类胡萝卜素由于其嵌入性的结构而导致生物可及性低,当蔬果受到机械破坏(如切碎、打浆、榨汁等)时,阻碍类胡萝卜素释放的物理屏障植物细胞壁和质体膜被破坏,可促进其生物可及性。例如,当菠菜被切碎时,其叶黄素生物可及性增高[82];番茄酱中的番茄红素的生物可及性高于新鲜番茄[83];与生菜或熟菜相比,蔬菜汁中的α-胡萝卜素与叶黄素生物可及性更高[84]。
烹饪加热也可能会通过破坏植物的细胞壁而提高类胡萝卜素的生物可及性,效果因食材和加工方式而异。例如,将胡萝卜切成薄片煮沸10 min会破坏其细胞壁[85],而以相同的方式处理黄椒却不会破坏细胞[86]。与新鲜橙汁相比,巴氏杀菌橙汁中的β-隐黄素的生物可及性更高[87]。与炒相比,煮沸和煎炸后蛋黄中的玉米黄质的生物可及性更高[88]。然而,热处理可能会导致类胡萝卜素的损失。橙子或红萝卜中的β-胡萝卜素和番茄红素经加热后,其生物可及性未高于未进行热处理的对照组[89]。
研究表明高压均质(HPH)可通过破坏植物细胞壁,提高类胡萝卜素释放率,然而不一定增强消化过程中类胡萝卜素向胶束的转移[18]。体外模型测试表明,高压均质可破坏番茄中大多数的完整细胞及色质体,但没有提高番茄红素的生物可及性,这是由于某些内源性物质(如果胶)会阻碍释放出来的番茄红素向油滴转移[90]。果胶与胆盐、脂肪酶、油滴表面间的相互作用也可能影响脂质混合胶束形成的速率和程度[91]。
2.3 胃肠道消化因素
β-胡萝卜素乳状液体外消化模型显示,胆盐浓度、脂肪酶浓度以及pH会对乳状液中β-胡萝卜素的消化吸收率产生一定影响。胆盐浓度的增加会使β-胡萝卜素的消化吸收率显著增加;脂肪酶浓度增加时,β-胡萝卜素的消化吸收率也随之增加,当脂肪酶质量浓度增加至 0.4 mg/mL 时,β-胡萝卜素的消化吸收率最高,为51.2%,但当脂肪酶质量浓度增加至0.8 mg/mL时,β-胡萝卜素的消化吸收率下降至40.1%,之后,随着脂肪酶浓度的再增加,β-胡萝卜素的消化吸收率无显著变化[80]。pH显著影响类胡萝卜素从乳液转移到胶束这一过程,在强酸性乳液(pH在2~5之间)中,类胡萝卜素的转移要比弱酸性乳液(pH在5~6.9之间)低得多[76]。
2.4 宿主相关因素
性别、年龄、疾病状况、肠道菌群等宿主相关因素会对类胡萝卜素的生物利用度造成影响。例如,女性通常拥有比男性更高的血液类胡萝卜素浓度[92];年龄增长伴随的胃肠道功能恶化,降低番茄红素的生物利用度[93];与健康受试者相比,囊性纤维化患者的血浆叶黄素和玉米黄质浓度更低[94]。肠道寄生虫和胃肠道营养不良也可能损害粘膜细胞并导致类胡萝卜素吸收减少[64]。
2.5 转运蛋白的表达或活性
调节肠道转运蛋白的表达或活性可影响类胡萝卜素的生物利用度,例如类胡萝卜素本身或其他脂溶性维生素的负反馈调节,以及编码这些蛋白质的基因的遗传变异等。
SR-B1对肠道脂质的转运受到视黄酸信号的调控。视黄酸通过视黄酸受体(RARs)诱导肠道特异性同源框ISX的表达。ISX与BCO1基因(编码β-胡萝卜素-15,15’-双加氧酶BCO1,将维生素A类胡萝卜素转化为视黄醛)上游的保守DNA结合序列结合,抑制该基因在肠道中的表达。ISX信号同样控制SR-B1的活性(SR-B1基因上游的ISX结合序列与BCO1基因上游的ISX结合序列具有70%的一致性)[95],成为肠道中类胡萝卜素和脂溶性维生素吸收的关键调节因子。当视黄酸摄入降低时,细胞内视黄酸浓度下降,ISX对SR-B1和BCO1的阻遏降低,β-胡萝卜素的吸收和转化效率增加。
也有Caco-2细胞实验证明,柑橘类黄酮可促进SR-B1的表达,提高β-胡萝卜素的吸收效率[96]。对于NPC1L1,已知葡萄糖可以通过转录机制和磷酸酶依赖途径直接调节NPC1L1的表达[97]。
另一方面,转运蛋白编码基因的遗传变异或许可以解释人群中血浆类胡萝卜素浓度的个体差异。有研究使用3个独立人群的数据评估了转运蛋白编码基因的遗传变异是否与血浆类胡萝卜素水平相关,结果表明CD36、SR-B1、NPC1L1基因具有单核苷酸多态性,不同基因型参与者血浆类胡萝卜素浓度存在显著差异[31−34]。另外对于β-胡萝卜素,有研究者在ISX中发现了3个SNP,可调节BCO1介导的β-胡萝卜素裂解和SR-B1介导的β-胡萝卜素在肠上皮细胞的吸收。这也证实了ISX在调控β-胡萝卜素生物利用度中的关键作用。目前,对于遗传变异对类胡萝卜素生物利用度影响的了解有限,深层次研究正在进行中。
3 小结
本文综述了影响类胡萝卜素肠道吸收及生物利用度的因素,分析了类胡萝卜素的化学性质、食物基质、胃肠道因素及宿主遗传对其消化过程和生物可及性的重要影响。明确脂质膜转运蛋白(SR-BI、CD36、NPC1L1)、裂解酶BCO1和转录因子ISX等对类胡萝卜素的肠道吸收起关键作用。类胡萝卜素在人体的消化吸收过程较为复杂,受诸多因素影响。在消化层面,深入了解类胡萝卜素消化过程,通过加工针对性改变类胡萝卜素的消化特性,可改善其生物可及性,具有深入研究潜质。在吸收层面,由于类胡萝卜素转运蛋白具有低配体特异性,一种受体通常会转运多种类胡萝卜素,各种蛋白受体对特定类胡萝卜素的摄取顺序及比例仍有待研究,阐明类胡萝卜素的肠道吸收机制对提高其生物利用度有重大意义。同时,现有证据表明类胡萝卜素的生物利用度受遗传变异的影响,将基因多态性、表观遗传因素与其他影响类胡萝卜素生物利用度的因素相结合,可针对个体的类胡萝卜素生物利用提出个性化建议,符合精准营养的研究及实践方向。
