基于HPLC指纹图谱的木薯叶类黄酮质量研究
2021-08-11詹春莲陈新富麦力文王定美
詹春莲,陈新富,麦力文,杨 霞,王定美,
(1.海南省文昌市会文镇中心卫生院,海南文昌 571343;2.中国热带农业科学院环境与植物保护研究所,海南海口 571101;3.海南医学院热带医学与检验医学院,海南海口 571199;4.海南省热带生态循环农业重点实验室,海南海口 571101)
植物类黄酮由于具有天然、无毒、抗氧化活性等特点,利用其开发的功能食品及添加剂,日益受到人们重视[1−4]。木薯(Manihot esculenta)为世界第五大粮食作物,在热带地区广泛栽培,木薯叶作为木薯生产中的副产物,产量高,可达10 t/ha,目前除少部分作低附加值饲料外,大部分被丢弃,尚未得到充分开发利用[5]。研究表明,木薯叶类黄酮对四氯化碳诱导小鼠肝损伤具有保护作用[6],具有较高的抑菌活性[7−8],与维生素C相比木薯叶类黄酮表现出更强的抗氧化活性[9],并能够增强机体免疫力[10−11];实践也表明,木薯叶经捣烂、煮熟后,不仅可以作为蔬菜食用,还可以治疗膀胱炎,并且孕妇和哺乳期的妇女均可食用[12]。说明木薯叶类黄酮在功能食品方面有着极大的开发潜力。
植物类黄酮为多组分复杂体系,其化学成分的多样性和复杂性是其功效发挥的物质基础,同时也是质量评价的重点与难点。据报道,木薯叶的保健功能可能与其含有丰富的类黄酮化合物有关,如能调节血脂、抗炎抑菌、抗氧化、抗肿瘤及抗病毒等[13−15]。类黄酮作为一种植物体内代谢产物,其种类和组成受品种、产地、气候、生态环境、栽培技术等多因素共同影响,往往有一定的区别,有些还差异明显[16−19]。目前已鉴定的木薯叶类黄酮成分包括槲皮素、山奈酚、芦丁、clovin、杨梅素-3-O-芸香糖苷、金丝桃苷、刺槐甙、烟花甙、水仙甙、二氢黄酮甙、穗花杉双黄酮、儿茶素等已达60余种[20−23],而目前缺少针对如何全面表征木薯叶类黄酮质量的报道,与木薯叶类黄酮质量密切相关的特征成分尚不清楚,难以对木薯叶开展针对性的质量控制,制约木薯叶类黄酮功能食品开发。
指纹图谱是基于食品的固有品质特性,运用光谱、色谱等现代仪器检测得到的能反映该食品内部特征的图谱,具有整体性、系统性、特征性和稳定性的特点[24]。指纹图谱已成为食品产地鉴别、真伪鉴别、优劣鉴别与生产过程中质量控制的有效工具[25−28],为木薯叶类黄酮的质量控制提供了方法学借鉴。但目前未见有关于木薯叶类黄酮指纹图谱研究的文献报道,对于如何针对性的进行质量控制,更是缺少可靠依据。聚类分析是用相似度来衡量样品之间的亲疏程度,并以此来实现分类的一种方法[29]。主成分分析法是将多个相关性指标转换成少数几个相互独立的综合指标,从而使繁多的求解目标简化的一种方法[30]。指纹图谱结合化学计量法进行质量评价,可相互验证和补充,能更全面地体现研究对象的内在品质[31]。基于此,本研究采用高效液相色谱法,研究建立木薯叶类黄酮指纹图谱,并结合聚类分析、主成分分析等对其进行质量评价,筛选出与其质量密切相关的特征成分,旨在为木薯叶类黄酮质量评价提供新途径、并为其质量控制提供参考依据。
1 材料与方法
1.1 材料与仪器
本实验所用样品 分别为6个木薯品种(SC06、SC07、SC09、SC10、SC205、BC)的120、180、240 d植龄的叶片样品,并按“品种-植龄”进行编号,采自海南省海口市三江镇美达农园农场种植基地(19.0°55.0'9.196"N,110.0°34.0'34.939"E)。新鲜木薯叶片洗净后经60 ℃烘干至恒重后,粉碎至粒径0.3 mm后,−20 ℃保存备用;标准品芦丁(rutin,含量≥98.1%,批号:1022799)、二氢黄酮甙(hesperidin,含量95.3%,批号:110721-201316)、槲皮 素(quercetin,含 量≥96.5%,批 号:100081-200907)、穗花杉双黄酮(amentoflavone,含量≥90.2%,批号:111902-201102) 中国食品药品检定研究院;山奈酚(kaempferol,含量≥98.0%,编号:K107144) 阿拉丁公司;甲醇、乙腈为色谱纯;超纯水;其它试剂 均为分析纯。
Waters e2605高效液相色谱仪 美国沃特斯公司;METTLER TOLEDO AL204电子分析天平 瑞士梅特勒-托利多。
1.2 实验方法
1.2.1 木薯叶类黄酮样品的制备 参考文献[9],采用超声波辅助法制备木薯叶类黄酮,具体为:精确称取1.0 g样品于50 mL聚乙烯离心管中,加入40 mL 90%的乙醇提取液,进行超声波辅助提取,提取条件为:功率90 W,温度70 ℃,时间20 min。合并两次提取的上清液,在50 ℃、55 r/min下旋转蒸发浓缩至膏状,用90%乙醇清洗至50 mL离心管中,直立放置于4 ℃冰箱中12 h,在4000 r/min离心10 min后,上清液转至圆底烧瓶中,50 ℃、55 r/min下旋转蒸发浓缩至膏状,用乙腈清洗膏状物再次旋转蒸发浓缩,以保证乙醇彻底挥发,用乙腈清洗膏状物至25 mL容量瓶中,定容后贮存在−20 ℃作为液相分析备用液。HPLC分析前,吸取备用液过0.22 μm滤膜。
1.2.2 色谱条件 以实验室前期建立的色谱条件为基础[17],优化修改后如下:色谱柱CNW Athena C18-WP(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.02%乙酸水溶液(B),梯度洗脱(0~50 min,10%~80% A;50~55 min, 80%~100%A;55~57 min,100%A;57~59 min, 100%~10%A;59~68 min,10%A),流速1.0 mL/min,柱温室温,进样量10 μL,检测波长270 nm。
1.2.3 方法学考察 按以下实验条件,在“1.2.2色谱条件”下进行测样分析,计算各色谱峰相对保留时间和峰面积的相对标准偏差RSD:a.精密度实验:同一份样品备用液,连续进样6次分析;b.稳定性实验:同一份样品备用液分别于0、4、8、12 h进样分析;c.重复性试验:取同一样品,平行称取6份,按“1.2.1”制备木薯叶类黄酮样品,按“1.2.2” 色谱条件进样分析。
1.3 数据分析
采用Excel 2010软件进行数据整理和计算。将HPLC图谱数据导入《中药色谱指纹图谱相似度评价系统(2004 A版)》软件,生成木薯叶类黄酮指纹图谱共有模式,进行相似度评价。用SPSS 25、SIMCA 14.0软件对HPLC图谱共有峰进行系统聚类分析和主成分分析。
2 结果与分析
2.1 方法学考察
采用1.2.2所述色谱条件,木薯叶类黄酮样品连续测定6次,各共有峰保留时间和峰面积的RSD分别小于0.14%和0.91%,说明该方法具有较高的精密度。同一样品在12 h内的6次测定结果中,各共有峰保留时间和峰面积的RSD分别为0.03%~0.18%和0.03%~1.65%,说明该方法在12 h内稳定性良好。同时,重复性试验结果显示,各共有峰保留时间和峰面积的RSD分别为0.04%~0.19%和1.06%~3.67%,表明该方法具有较好的重复性。因此,本文采用的高效液相色谱法可准确表征不同品种不同植龄木薯叶中组成与含量复杂多样的类黄酮物质群,为进一步评价木薯叶类黄酮质量提供了可靠的方法学依据,克服了现评价方法难以全面反映木薯叶类黄酮质量不足问题。
2.2 指纹图谱共有模式的确定
采用《中药色谱指纹图谱相似度评价软件》(2004A版),以SC06-120的色谱图为参照,时间窗口设为0.5,选择样品中均含有的、含量相对较高且分离度较好的色谱峰位进行多点校正,釆用平均数法生成对照图谱。结果见图1、图2(b),从18张图谱中匹配出5个共有峰(X3、X6、X13、X15、X18),这些共有峰的峰面积之和均大于整张色谱图峰面积的90%,证明本文建立的指纹图谱符合中药色谱指纹图谱的评价要求,可用于评价本实验样品的整体质量。以上共有峰,经标准品对照指认,如图2(a),色谱峰X3、X6、X15分别为芦丁、二氢黄酮苷、穗花杉双黄酮,X13、X18未能指认。以此5个共有峰作为特征峰,以色谱峰X6为参照,计算各样品共有特征峰的相对保留时间,结果见表1。由表1可知,各品种各植龄样品的共有峰相对保留时间基本一致(RSD范围为0~0.136%)。由上述结果可见,各特征峰稳定、具有指纹图谱特征性,可初步视为木薯叶类黄酮的指标成分群。

图1 木薯叶类黄酮HPLC指纹图谱Fig.1 HPLC fingerprint of flavonoids from cassava leaves

表1 各共有峰的相对保留时间(min)Table 1 Relative retention time of each common peak(min)

图2 混合标准品的HPLC指纹图谱(a)和各样品HPLC指纹图谱的共有模式(b)Fig.2 HPLC fingerprints of mixed standards (a) and common pattern from each sample (b)
2.3 指纹图谱的相似度评价
以18个木薯叶样品类黄酮的共有模式(R)为对照指纹图谱,进行相似度评价,结果见表2。各样品的指纹图谱与对照指纹图谱的相似度范围为0.886~0.998(大于0.88),说明不同品种不同植龄的木薯叶类黄酮表现出较好的相似度,说明其类黄酮成分组成基本一致,但不同品种和植龄的样品色谱峰的峰面积有差异(见表3),RSD为19.86%~51.84%,说明其化学成分含量存在一定差异。
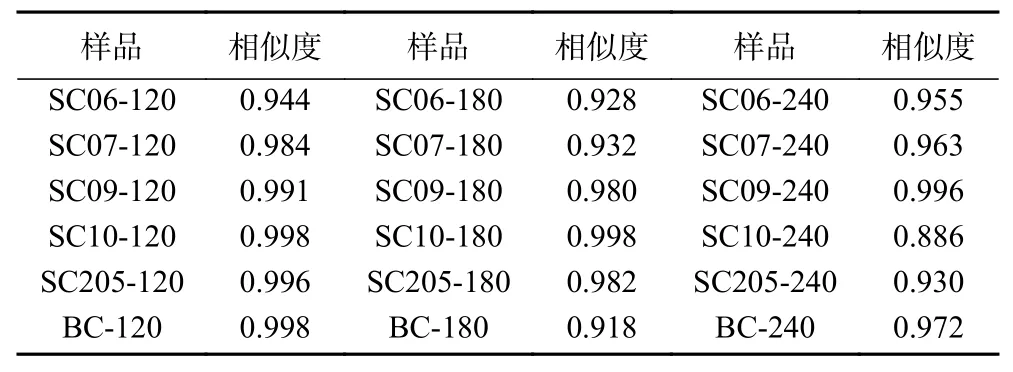
表2 木薯叶类黄酮指纹图谱相似度评价Table 2 Similarity evaluation of fingerprints of flavonoids from cassava leaves

表3 各共有峰的相对峰面积Table 3 Relative peak area of each common peak
2.4 木薯叶类黄酮样品聚类分析
将各共有色谱峰峰面积相对于称样质量进行量化,使用SPSS25.0软件对样品进行系统聚类,采用组间平均联结法、余弦法测度方法,结果见图3(a)。由图3(a)可知,当测度值约为8时,木薯叶样品经聚类分析后被分为四类:I类包括BC-120、SC10-180、SC09-240、SC09-120、SC10-120、SC205-120、SC09-180、SC205-180、SC07-240、BC-120、SC09-120;II类为SC06-120、SC06-240、SC06-180;III类包 括SC07-120、BC-240;Ⅴ类 包 括SC07-180、SC10-240、SC205-240、BC-180。结合基于聚类分析排列顺序的相似度线性拟合图如图3(b),各样品的聚类情况见该图虚线圆形标识,分为4类,与聚类分析结果一致。但从相似度大小排列来看,总体上I类>III类>II类>V类,其中I类与III类(其相似度在0.96以上)、II类与Ⅴ类(其相似度在0.96以下)较接近。聚类结果为相似度分析作了补充。以上分析中,除SC06、SC09外,同一品种不同植龄的样品均不能归到一类并且质量水平差别较大,同时,不同品种不同植龄的样品亦能聚到一起,说明不同品种不同植龄的样品具有一定的内在相似性。证明了木薯叶类黄酮的相似性受品种和植龄的共同影响,与王琴飞等[18]的研究结果“不同品种不同生育期的木薯叶片黄酮醇物质含量差异较大”一致。

图3 聚类分析图(a)与相似度线性拟合图(b)Fig.3 Clustering analysis diagram (a) and similarity linear fitting diagram (b)
2.5 主成分分析
以5个共有峰为对象,利用SPSS25.0软件进行主成分分析,得出相关矩阵的特征值及其方差贡献率,结果见表4,可见主成分数为2时,特征值均大于1,但此时方差累计贡献率只有69.886%,当主成分数为3时,方差累计贡献率可达到86.748%,但此时特征值为0.843,未达到1。陡坡图是根据各主成分对数据变异的解释程度绘制的图,图上每一个主成分为一个点,通过“陡坡趋于平缓”的位置判断提取主成分的数量。本研究中,陡坡图见图4,可见,第四主成分之后的数据趋于平缓,因此认为提取的前3个主成分可用来代表本研究中木薯叶类黄酮指纹图谱共有峰的大部分信息,可以显示研究样品的相似性与差异性。选取前3个主成分作为公因子,对样品进行综合评价,按方差贡献率加权计算综合得分,结果见表5。可见,排名前3的样品为SC10-180、SC205-120、SC205-180,综合得分在2.2以上,其中,SC10-180因子1和3表现突出,SC205-120和SC205-180因子2和3表现突 出;SC06-240、SC07-120、SC205-240、SC10-240的综合得分值均在−2以下,排名较低。
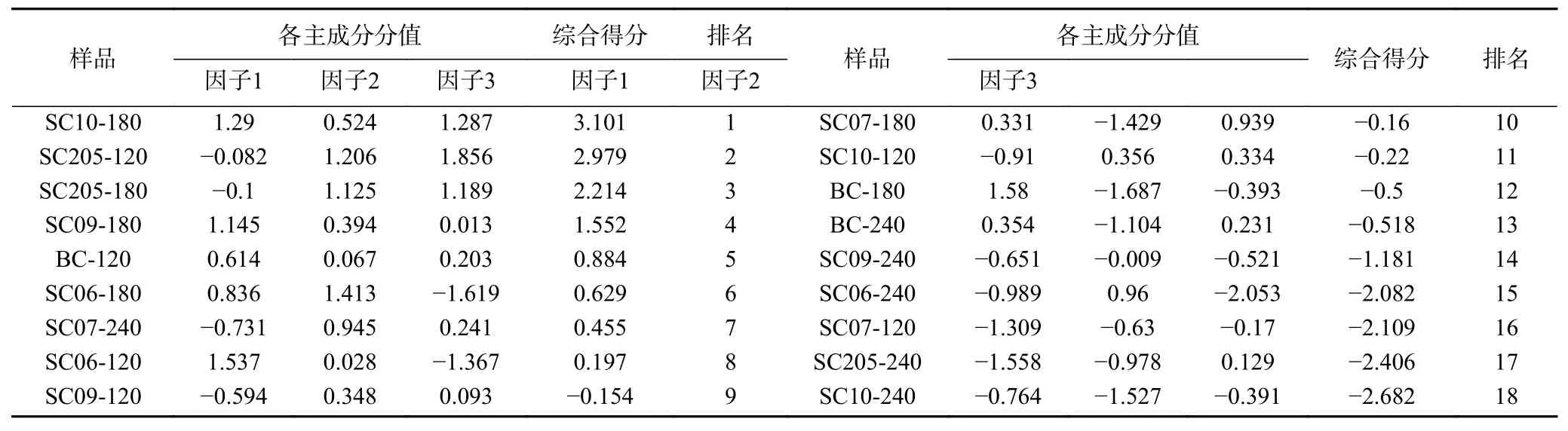
表5 主成分分析综合得分排序表Table 5 Ranking table of aggregate scores of principal component analysis

图4 主成分分析陡坡图Fig.4 Steep slope plot of principal component analysis
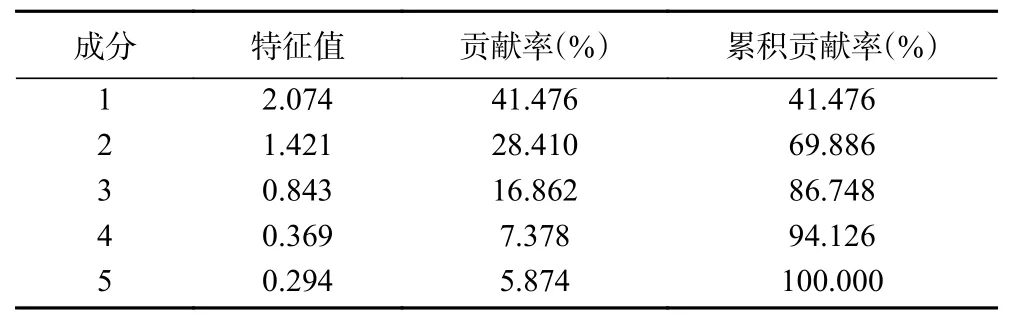
表4 主成分分析特征值与贡献率Table 4 Eigen value and contribution rate of principal component analysis
为了进一步确定与木薯叶类黄酮质量密切相关的成分,将样品共有峰面积导入SIMCA 14.0中,用PCA-X模型对样品进行主成分分析。主成分载荷见图5。离原点较远的点对模型影响较大,离中心较近的点对模型影响较小,由图5可知,指纹图谱中对于聚类起主要作用的色谱峰为X3、X6、X15,即芦丁、二氢黄酮苷、穗花杉双黄酮这3个成分与其质量有密切的相关性。建议以后在质量控制上要重点关注这3个成分。现有报道已证明,以上3种黄酮成分具有多种生物功能,说明木薯叶在保健方面有很大的开发潜力。另据王伟等[22]、王定美等[17]、陶海腾[21]报道,芦丁、穗花杉双黄酮是SC07、SC09、SC205木薯叶类黄酮的主要成分,芦丁和烟花甙是SC05木薯叶类黄酮的主要成分,与本研究结果不完全一致,推测主要是由于种植地区不同造成的。为了建立更为广泛的木薯叶质控方法,应进一步采集不同种植地区的木薯叶样品进行测定分析。
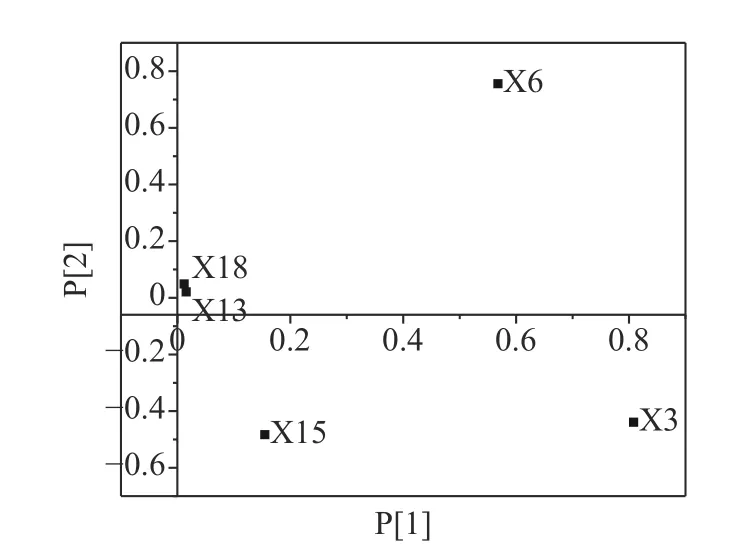
图5 特征峰主成分分析载荷图Fig.5 Principal component analysis load diagram of characteristic peak
通过主成分分析PCA得分图(图6)可知,以X3、X6、X15色谱峰3个主成分为指标成分进行得分分析,各得分点均位于Hotelling的T2公差椭圆之内,无离群值,与指纹图谱相似度不小于0.88一致,说明各样品之间趋同性较高。根据得分点分布,图中可分为四个得分区,其中I区包括BC-120、SC10-180、SC09-240、SC09-120、SC10-120、SC205-120、SC09-180、SC205-180、SC07-240、SC09-180、SC205-180、SC07-240;II区 为SC06-120、SC06-240、SC06-180;III区包括SC07-120、BC -240;Ⅴ区包括SC07-180、SC10-240、SC205-240、BC-180,其分区结果与聚类分析一致。这也验证了上文结论:色谱峰X3、X6、X15所代表的类黄酮成分与本文所考察的18个样品质量有密切的相关性。以上化学计量分析方法,相互验证和补充。

图6 主成分分析得分图Fig.6 Score plot of principal component analysis
3 结论
植物类黄酮组分复杂多样,本文采用的HPLC指纹图谱法通过考察精密度、稳定性、重复性,结果均符合方法学要求,能系统、客观反映出不同品种不同植龄木薯叶样品中类黄酮物质群的内在质量信息。指纹图谱相似度评价、聚类分析与主成分分析,又进一步探讨样品内在质量的差异性及引起差异的原因,表明:各样品木薯叶类黄酮特征指纹图谱的相似度在0.88以上,主成分分析得分图中各样品的得分点均未超出公差椭圆,不同品种不同植龄的木薯叶类黄酮的质量比较一致。聚类分析将木薯叶类黄酮分为4类,不同品种不同植龄的样品亦能聚到一起,表明木薯叶类黄酮的相似性受品种和植龄的共同影响。主成分分析结果显示,前3个主成分的累积方差贡献率为86.748%,SC10-180、SC205-120、SC205-180样品综合得分最高(>2.2)、质量最好,芦丁X3峰、二氢黄酮苷X6峰、穗花杉双黄酮X15峰与木薯叶黄酮质量有密切的相关性。该结果为评价木薯叶类黄酮提供了新途径,也为开展木薯叶类黄酮质量控制提供了参考依据。为了建立更为广泛的木薯叶类黄酮质量控制,应进一步采集不同种植地区的木薯叶样品进行测定分析。
