循环肿瘤细胞分型检测及其在晚期肺癌中的临床应用研究
2021-08-11孟凡萍牛晓昶李思颖康菊香
周 政,孟凡萍,赵 丹,牛晓昶,范 慧,李思颖,康菊香,赵 昕
重庆大学附属三峡医院检验科,重庆 404000
肺癌是我国发病率、病死率最高的癌症,每年有超过78万新发病例[1]。确诊时间晚、发生远处转移是肺癌整体生存率较低的两大主要原因[2]。肺癌已成为我国主要的公共卫生问题[3-4]。尽管现代医学在肺癌的诊治方面取得了重大进展,但肺癌的5年生存率仍低[5]。早期诊断、早期治疗以提高肺癌长期生存率仍然任重而道远。外周血循环肿瘤细胞(CTCs)是自发或因诊疗操作(手术、穿刺等)从实体肿瘤的原发灶或转移灶脱落进入外周循环或淋巴系统的肿瘤细胞,是研究肿瘤转移生物学行为的实时活检标本。CTCs可在肿瘤发生、发展的各个阶段检测到,血液标量为7.5 mL时,其阳性率为30.4%(38/125)~52.9%(18/34)[6-7]。CTCs有3个亚群,即上皮型、间质型、混合型[8]。在肿瘤发展过程中,循环系统中的CTCs会经历上皮-间质转化(EMT),即上皮表达减少、间质表达增加,导致细胞结构发生变化,细胞黏附力降低,从而促进肿瘤细胞迁移和浸润[9-10]。CTCs是导致恶性肿瘤患者肿瘤复发及发生远处转移的重要因素,与肿瘤诊断及疾病状态紧密相关。尽管外周血中CTCs的数量相对于血细胞而言,极其稀少(1~10亿个单核血细胞里可以找到1个CTCs)[11-12],但随着检测技术突飞猛进的发展,CTCs检测已经发展成一种新兴的非侵入性的临床辅助诊断方法。结合影像学或病理学检查结果可更综合地评估患者疗效及预后,实现对肿瘤术后复发、转移及时有效的管理。本研究探讨了晚期肺癌患者外周血CTCs的数量及分型与患者临床特征之间的关系,旨在为CTCs检测的临床应用提供依据。
1 资料与方法
1.1一般资料 以本院2018年2月至2019年11月诊断的43例初治或复治的原发性晚期(Ⅲ期及Ⅳ期)肺癌患者纳入研究组。其中男22例,女21例;年龄49~72岁,中位年龄60.8岁。根据修订的世界卫生组织(WHO)分类法和国际肺癌研究协会(IASLC)的第八版TNM分期建议,结合临床资料确定入组的晚期肺癌患者[13]。收集患者的一般特征(年龄、性别、吸烟史、是否为初治)和临床特征(肿块位置、肺叶分布、临床分期、病理亚型、器官转移状况)。在患者进行手术或治疗之前,行胸部CT、骨扫描、头颅MRI、腹部彩超或全身PET/CT影像学检查,并采集患者的外周血标本。另选择同期本院健康体检者31例作为对照组,其中男19例,女12例;年龄45~71岁,中位年龄59.7岁。两组研究对象年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,所有患者及家属均签署知情同意书。
1.2仪器与试剂 仪器:CanPatrol®CTCs(益善生物公司);Axio Observer A1荧光显微镜(德国Zeiss);恒温孵育箱(Thermo Fisher 3111);KDC60低速离心机(中科中佳公司);QY-31真空抽滤机(上海岐耀公司)。主要试剂:人CTCs分型检测试剂盒[多重信使RNA(mRNA)原位分析法(益善生物)];红细胞裂解液;4%甲醛溶液;磷酸盐缓冲液(PBS);洗涤液(0.1×SSC);前置扩增溶液(30%马血清、1.5%十二烷基硫酸、3 mmol/L pH 8.0 Tris-HCl、0.5 fmol的前置序列);扩增溶液(30%马血清、1.5%十二烷基硫酸、3 mmol/L pH 8.0 Tris-HCl、1.0 fmol的扩增序列);4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI);蛋白酶。除蛋白酶购自Qiagen公司外,其余试剂购自Sigma公司。
1.3方法
1.3.1采样 使用真空采血系统(EDTA-K2抗凝管)采集患者5 mL外周血,立即轻柔颠倒混匀8次,防止凝血。不能及时进行制模可于2~8 ℃保存,预处理需在标本采集后4 h内完成。
1.3.2制膜 进行CanPatrol®CTCs检测前,先将红细胞裂解,步骤如下:(1)将抗凝血转移至标本保存管于室温静置30 min;(2)1 850 r/min(600×g)低速离心5 min后弃上清液;(3)加入4 mL PBS和1 mL RI固定剂混匀,静止8 min后转移至过滤柱;(4)采用真空泵(负压0.06 MPa)进行抽吸,使细胞吸附于滤膜;(5)于过滤器中加入1 mL 4%甲醛溶液,固定1 h后弃溶液;(6)依次加入1 mL 50%、70%、100%乙醇溶液,分别室温静置2 min后完成细胞滤膜制备。
1.3.3杂交 取下滤膜进行如下操作:亲水、透化、消化、探针杂交、预扩增、扩增、显色、复染。具体操作按试剂盒说明书进行。
1.3.4镜检 于-20 ℃或室温直接镜检:采用全自动荧光显微镜染色体分析系统软件,首先进行20倍镜下预扫,而后于40倍镜下进行细胞核型拍摄及荧光拍摄,最后进行图片导出。
1.4统计学处理 采用SPSS19.0统计软件分析数据。非正态分布的计量资料以M(P25~P75)表示,多组间比较行Kruskal-WallisH非参数检验,两组间比较行Man-WhitneyU非参数检验;计数资料以例数或率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1CTCs表性特征 经CanPatrol®CTCs平台,将43例晚期肺癌患者的外周血CTCs分离出来,并分为上皮型、间质型、混合型3种亚型。患者外周血CTCs的表型特征如图1所示,其中深色荧光(图1A中全部斑点及图1B中对比度稍暗的斑点)标记的是上皮分子标志物(EpCAM及cytokeratin8/18/19),浅色荧光(图1C中全部斑点及图1B中对比度更亮的斑点)标记的是间质分子标志物(Vimentin及Twist)。
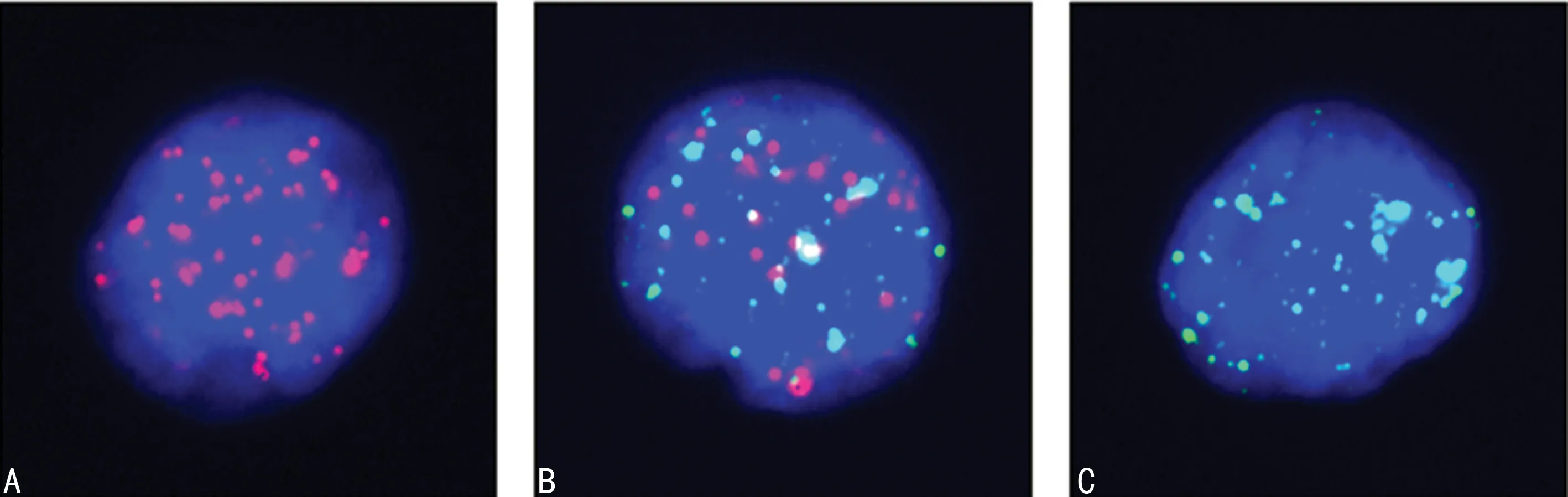
注:A为上皮型CTCs;B为混合型CTCs;C为间质型CTCs。
2.2CTCs检出情况 CTCs的检出范围为2~49个,中位数为13个;上皮型CTCs的检出范围为0~13个,中位数为2个;混合型CTCs的检出范围为0~31个,中位数为8个;间质型CTCs的检出范围为0~33个,中位数为2个。43例患者全都检出CTCs,阳性率为100.0%;上皮型CTCs、混合型CTCs和间质型CTCs的阳性患者分别是33例、42例和34例,阳性率分别为76.7%、97.7%和79.1%。此外,43例晚期肺癌患者中,31例(72.1%,31/43)以混合型CTCs为主。混合型CTCs在数量和阳性率上相较于上皮型CTCs和间质型CTCs更高,差异有统计学意义(P<0.05)。对照组均未检出CTCs,与研究组相比,差异有统计学意义(P<0.05)。
2.3CTCs与患者一般特征的关系 总CTCs和各亚型CTCs在患者的一般特征(年龄、性别、吸烟史、是否为初治)间的差异无统计学意义(P>0.05),提示总CTCs数量及不同表型CTCs的数量与晚期肺癌患者的年龄、性别、吸烟史以及是否为初治均无关。见表1。
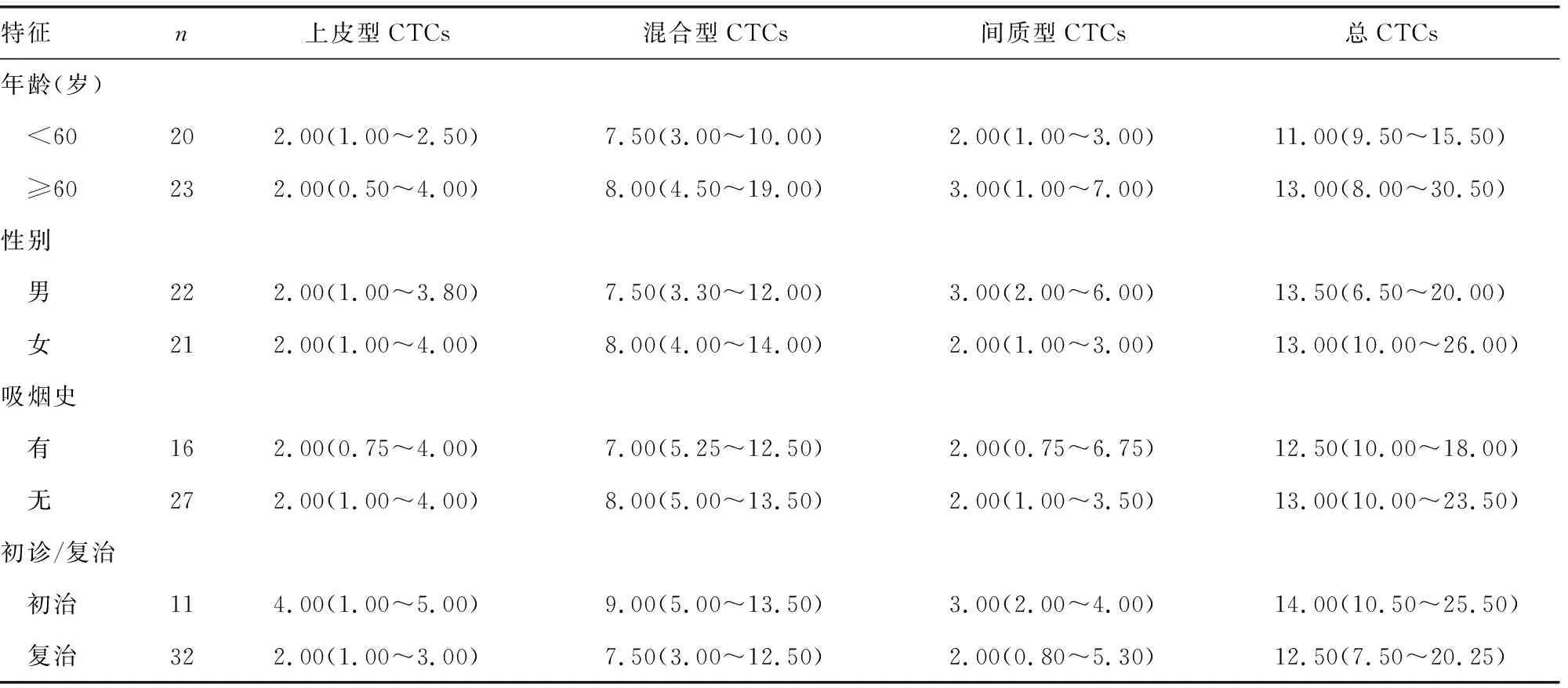
表1 CTCs与患者一般特征的关系[M(P25~P75),个]
2.4CTCs与患者临床特征的关系 总CTCs和各亚型CTCs在患者各临床特征(肿块位置、肺叶分布、临床分期、病理亚型)间的差异无统计学意义(P>0.05)。见表2。
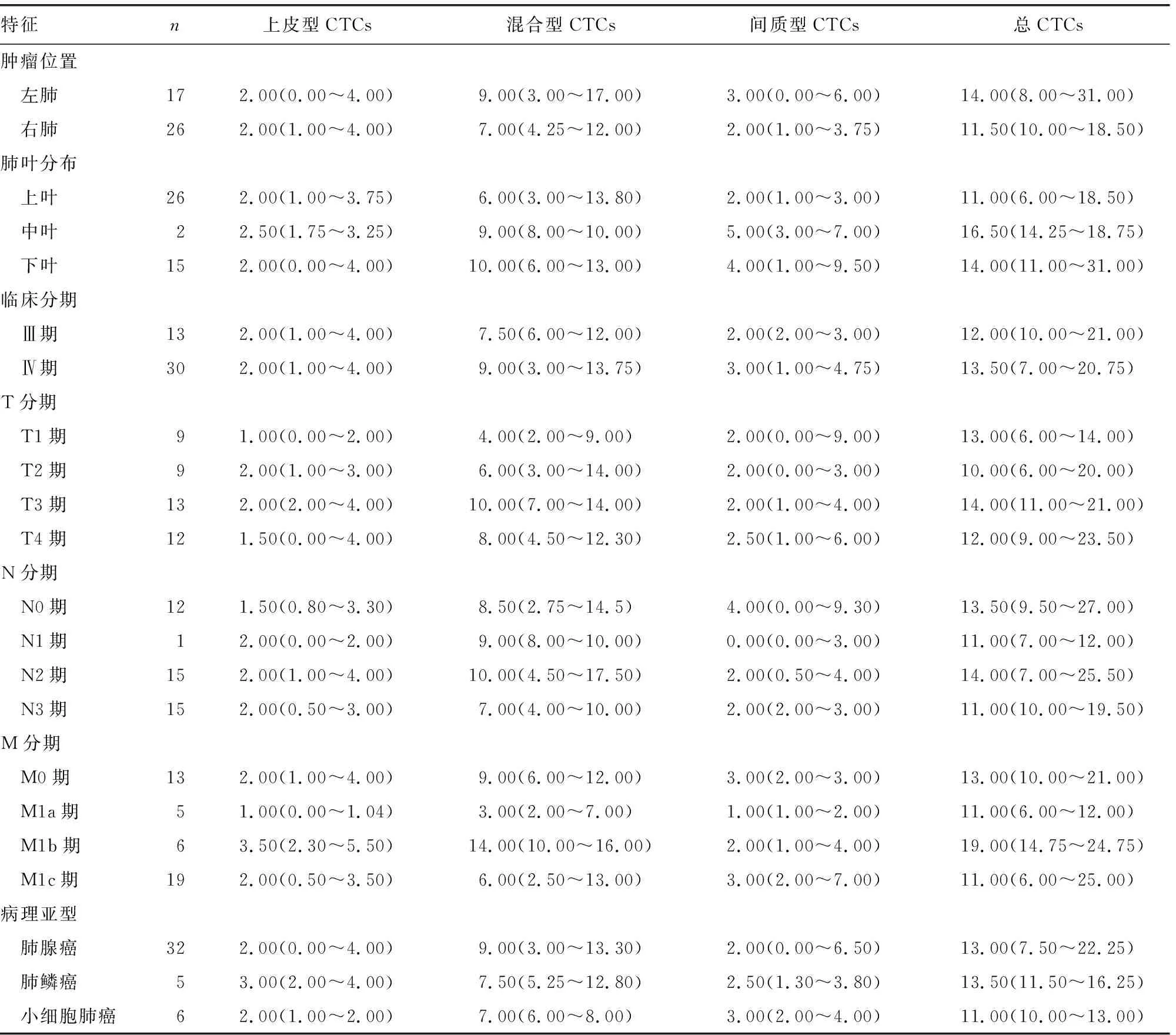
表2 CTCs与患者临床特征的关系[M(P25~P75),个]
2.5CTCs与患者器官转移的关系 由于CTCs与肿瘤的转移特性密切相关,因此将肿瘤的器官转移分为肺内转移(同侧肺转移、对侧肺转移)和肺外转移(脏器转移、骨转移、脑转移),以进一步探讨不同器官转移与CTCs数量及亚型的关系。在本研究中,共30例晚期肺癌患者发生了器官转移,占69.8%(30/43)。这30例患者的总CTCs、上皮型CTCs、混合型CTCs和间质型CTCs数量分别为12.50(7.00~20.75)、2.00(1.00~4.00)、7.50(3.00~14.00)、2.00(1.00~5.00)个。
有肺外转移的患者与无肺外转移的患者:上皮型CTCs的数量分别为1.00(0.00~2.00)个和0.00(0.00~0.50)个,差异有统计学意义(P<0.05);混合型CTCs的数量分别为3.00(2.50~8.50)个和2.00(2.00~2.50)个,差异有统计学意义(P<0.05);二者总CTCs数量比较,差异有统计学意义(P<0.05)。总CTCs数量和各亚型CTCs数量在其他分组中的差异均无统计学意义(P>0.05)。但值得注意的是,对于有脏器转移或骨转移(椎骨更易出现转移灶,尤其是胸椎)的患者,其总CTCs、上皮型CTCs、混合型CTCs和间质型CTCs数量均多于无脏器转移或骨转移的患者。见表3。
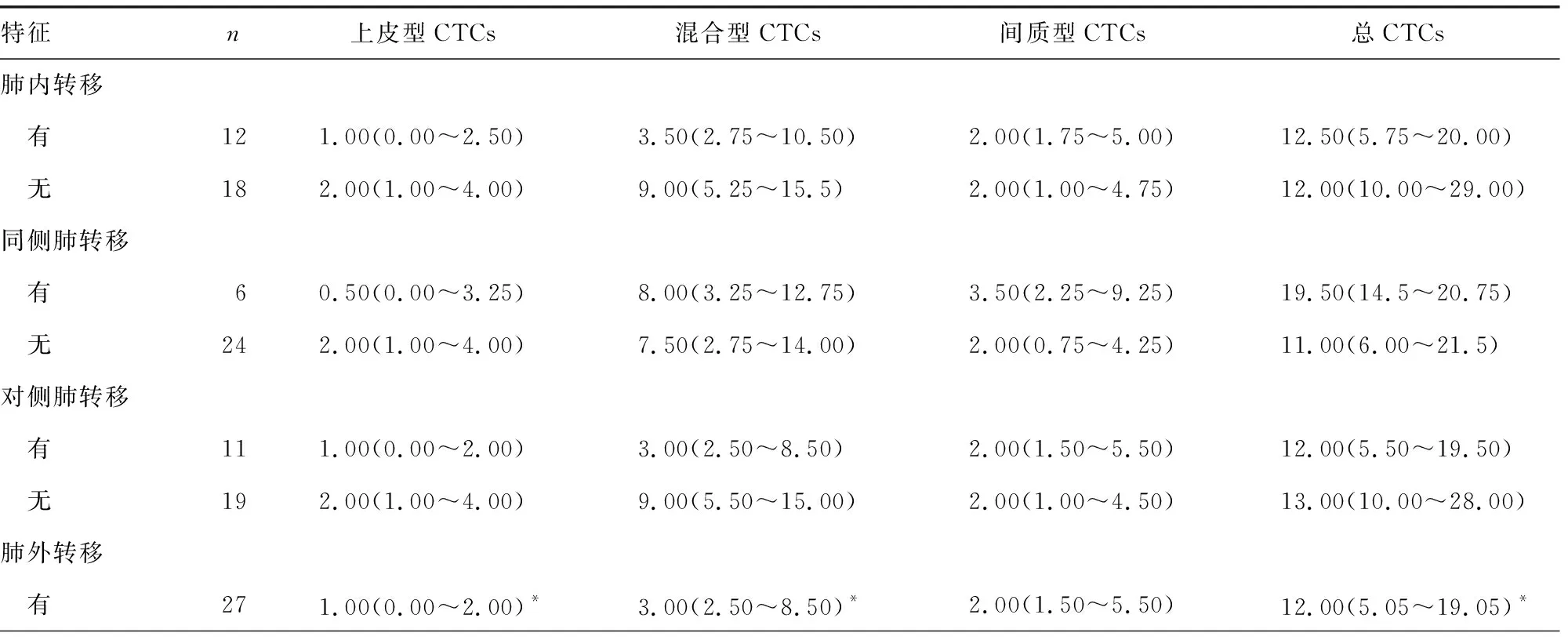
表3 CTCs与患者器官转移的关系[M(P25~P75),个]
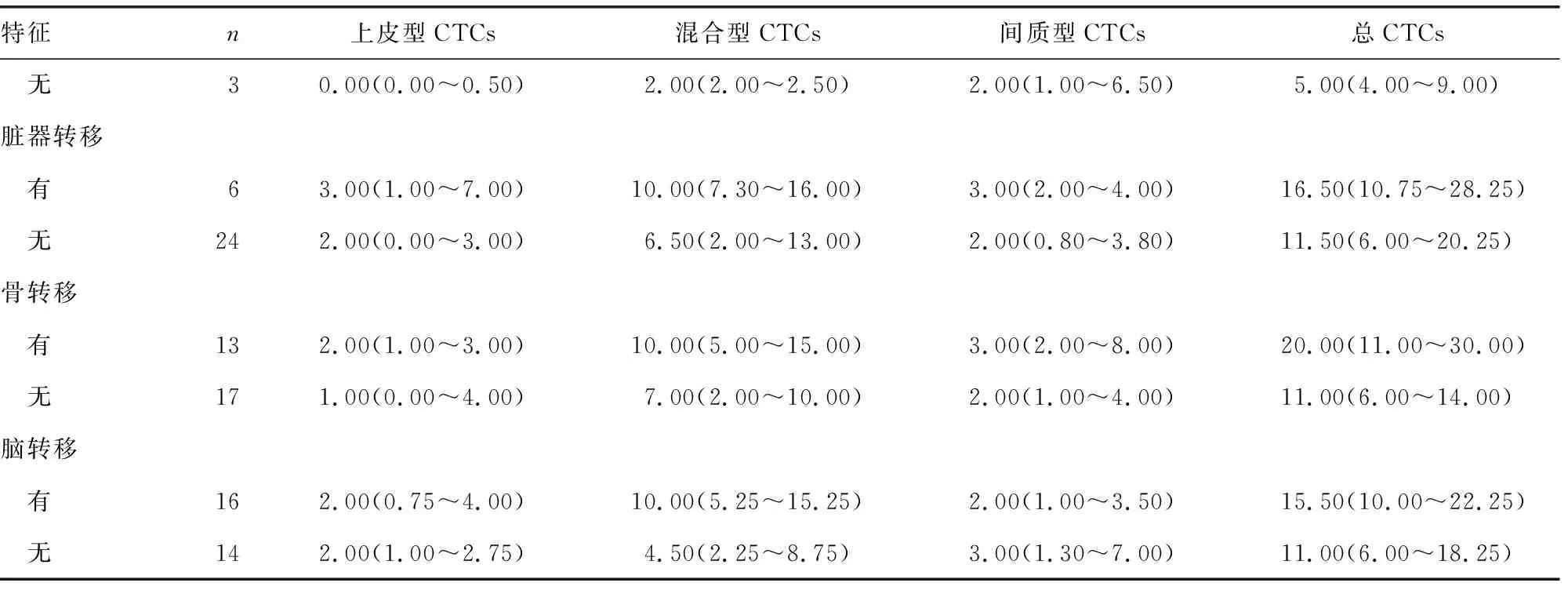
续表3 CTCs与患者器官转移的关系[M(P25~P75),个]
3 讨 论
为了有效地分离和检测CTCs,大量新技术和新方法被研发出来,但都未能突破只能单标记CTCs或检测上皮型CTCs的局限,因而实现对各表型CTCs的同时检测是一个技术方面的难题[14]。而CanPatrol®CTCs分型检测技术不仅实现了对外周血CTCs的快速分离,还实现了对各种表型CTCs的同时检测。其细胞采集系统的高效性依赖于纳米级滤膜的使用;此外,该技术选用特异性mRNA标志物(EpCAM、CK、Vimentin、Twist等)作为原位检测的靶标,相较于以往使用蛋白靶标的CTCs检测技术,该技术对CTCs的检出时间更早,检测特异性更高[15]。
本研究中43例晚期肺癌患者均检出CTCs,其中混合型CTCs阳性率最高,72.1%(31/43)的患者以混合型CTCs为主,表明混合型CTCs的检出与晚期肺癌具有相关性,与文献[16]报道结果一致。但其对于早、晚期肺癌的鉴别诊断作用还需要进一步收集早期肺癌患者进行对比分析。此外,晚期癌症以混合型CTCs为主的现象也见于结直肠癌等其他癌症[17]。
发生器官转移的患者有30例,其中发生肺外转移的患者所对应的混合型CTCs与上皮型CTCs,与未发生肺外转移的患者相比,差异有统计学意义(P<0.05),总CTCs数量也多于未发生肺外转移的患者(P<0.05)。CTCs脱离原发病灶后只有极少数能到达定植器官形成转移灶,而转移、定植后的CTCs增殖能力依赖于上皮型标记物的表达。在CTCs发生EMT后细胞凋亡受到抑制,表型与外周间质成分极其相似,免疫系统不易识别,进而可逃避免疫系统的攻击[18]。混合型CTCs与上皮型CTCs相比,有更强的转移能力,与间质型CTCs相比,有更强的增殖能力,因此,混合型CTCs能有效地播散及增殖,形成转移灶[19-20]。
发生肺外转移的患者共27例,发生脑转移的患者数量最多(16例),其次是骨转移(13例)和脏器转移(6例)。脑是CTCs肺外转移最常定植的器官,其次是骨骼(尤其是胸椎)。HANSSEN等[21]研究表明,出现脑转移的非小细胞肺癌(NSCLC)患者外周血中的总CTCs可作为预后评估的参照。也有研究表明,脑可作为转移储存库,但骨是CTCs最常寄居的部位,是最常见的储存库[22]。本研究发现,在骨转移的13例患者中,不同的骨形成转移灶的潜力是不同的,其中椎骨更易出现转移灶(尤其是胸椎)。此外,在发生脏器转移的6例患者中,3例为肝转移,3例为肾转移。对于转移的偏好和倾向性,还需要进一步收集相关病例进行探讨。
在43例晚期肺癌患者中,Ⅳ期肺癌患者的总CTCs、混合型CTCs和间质型CTCs数量均多于Ⅲ期患者,且总CTCs数随晚期肺癌分期的升高而呈升高趋势,但差异无统计学意义(P>0.05)。KREBS等[23]研究证明,Ⅳ期NSCLC患者的总CTCs数明显多于Ⅲa期和Ⅲb期患者。孙雯雯等[16]研究显示,在N分期中,N3期的上皮型CTCs数多于N2期,但N0期的上皮型CTCs数多于N2期;在M分期中,M1c期的上皮型CTCs数多于M0期和M1a期。而本研究数据显示,在T分期中,T3期的总CTCs数多于其他不同分期的间质型CTCs;在N分期中,N2期的总CTCs数多于其他不同分期;在M分期中,M1b期的混合型CTCs数多于其他所有亚型。
本研究中入组的肺癌包括肺腺癌、肺鳞癌、小细胞肺癌3种病理亚型,各病理亚型的总CTCs数和各亚型CTCs的数量差异均无统计学意义(P>0.05)。HUANG等[24]荟萃分析结果表明,CTCs数量与肿瘤分期和淋巴结转移呈正相关,而与病理分型无关。CHEN等[25]对肝细胞癌CTCs的研究结果也显示,发生EMT的CTCs数量和亚型与对应的病理分型无关。
综上所述,CTCs在晚期肺癌患者的外周血中具有较高的检出率,尤其是混合型CTCs,可作为晚期肺癌转移评估的辅助判断指标。CTCs分型检测对于探讨CTCs转移的器官偏向性也具有重要价值。CTCs检测技术属于非侵入性检测手段,可连续动态监测患者术后CTCs数量和比例变化,持续观察患者的疾病进展,推动晚期肺癌的精准诊疗进程。
