剪切波联合二维超声对甲状腺乳头状癌中央区淋巴结转移的预测价值
2021-08-06孙芳石岩杨智唐丽玮崔广和高岩冰董景云
孙芳 石岩 杨智 唐丽玮 崔广和 高岩冰 董景云
滨州医学院附属医院超声医学科(山东滨州256600)
甲状腺乳头状癌(PTC)约占甲状腺癌的74% ~85%,易发生颈部淋巴结转移[1],有无中央区淋巴结转移是影响PTC 复发及总体生存率的重要因素。修订版美国甲状腺协会(ATA)指南推荐对于低危的<1 cm 的PTC 结节仅行甲状腺侧叶切除,无需进行颈部淋巴结清扫[2]。因此术前准确评估PTC 中央区淋巴结状态对临床手术治疗方案的选择及患者的预后具有重要意义。超声被公认为甲状腺结节及颈部淋巴结首选的检查方法,但二维超声对判断甲状腺乳头状癌中央区淋巴结状态的敏感性和特异性较低[3]。剪切波弹性成像(SWE)是近年来发展起来的一种新兴成像技术,主要通过组织间的硬度差异对病灶的性质进行鉴别。有研究表明,SWE 检测的弹性指数可预测甲状腺结节的良恶性及PTC 中央区淋巴结转移[4-5]。目前,通过二维超声SWE 预测PTC 中央区淋巴结转移的研究较少。本研究意在探讨二维超声SWE 预测颈部中央区淋巴结转移的临床价值。
1 资料与方法
1.1 病例选取及排除标准模型建立组:收集2017年1月至2018年7月于我院甲状腺外科进行手术治疗的患者,术后病理为PTC,术前均行二维超声检查及SWE,共筛选出549 个结节。纳入标准:(1)术前穿刺病理证实为甲状腺乳头状癌,手术病理可明确有无中央区淋巴结转移;(2)术前图像清晰可查且记录详细;(3)术后资料可追踪。排除标准:(1)合并有其他类型的甲状腺癌;(2)伴有其他恶性肿瘤;(3)以往行甲状腺手术者;(4)有甲状腺癌家族史;(5)既往有放射治疗史。通过上述标准共筛选出PTC 结节501 个,记录患者的年龄、性别,分析结节二维超声特点及剪切波弹性成像值。
模型验证组:模型建立后,于2019年1月至2019年6月连续纳入穿刺活检为PTC 的入院待手术的患者共131 个结节作为模型的验证组。纳入标准及排除标准同模型建立组。
1.2 仪器与方法仪器:所有患者于术前一周进行常规超声及剪切波弹性成像,使用SuperSonic Imagine AixPlorer 彩色多普勒超声诊断仪,L4⁃15线阵探头,频率4~15 MHz。
检查方法:患者取仰卧位,头部后仰充分暴露颈部。先对甲状腺结节行纵、横、斜切等多切面扫查,选取最佳切面进行二维超声特征记录。然后启用SWE 模式,弹性模量值预设范围为0~100 kPa,扫查区域包括甲状腺整个结节、周围正常甲状腺组织及部分颈前肌肉。将感兴趣区域置于图像中央,为避免受颈部血管搏动及骨性结构影响,取纵切面扫查,嘱患者屏住呼吸3~5 s,图像稳定后冻结图像,应用弹性分析系统测量取样框内弹性模量值,记录最大值(Emax)、最小值(Em⁃in)和平均值(Emean)。同一病灶在同一切面重复测量3 次后取其平均值。
超声图像分析:由2 名主治资历超过5年的医师分析二维超声检查图像,记录病灶的大小、部位、边缘、内部回声、结构、纵横比、钙化类型、病灶与甲状腺被膜关系及可疑病灶数目等信息,其中病灶大小以病灶的最长径做记录,病灶的最长径分为<1 cm 及≥1 cm 两类;位置分为上极、中部、下极及峡部;边缘分为平滑、不清晰、不规则三类;内部回声分为无回声、极低回声、低回声、高回声或等回声四类;结构分为囊性、海绵性、混合性、实性回声四类;纵横比分为<1 及≥1 两类;钙化分为有无钙化或伴彗星尾钙化、粗大钙化、边缘钙化、微钙化四类,其中钙化直径<1 mm定义为微钙化[6],钙化直径≥1 mm 定义为粗大钙化;病灶与被膜关系定义为病灶与被膜接触长度/病灶周长,分为无接触、接触率0 ~ 25%、接触率25% ~ 50%、>50%;病灶数量分为单发与多发两类。
1.3 统计学方法采用SPSS 23.0 统计软件进行统计分析。采用单因素及多因素分析影响PTC 颈部中央区淋巴结转移的相关因素。首先对计量资料进行正态性分布检验,符合正态分布的使用独立样本t检验,非正态分布的使用U检验。对于二分类计数资料使用χ2检验,对于多分类比较使用Z检验。采用二元logistic 回归对单因素筛选的各变量进行回归分析,筛选独立预测因子,建立预测模型。对弹性模量值鉴别中央区淋巴结转移绘制受试者工作特征曲线(ROC)得出判断中央区淋巴结转移的最佳诊断截断值。将建立的模型代入验证组,以病理结果为金标准,计算模型的敏感度、特异度、误诊率、漏诊率。以P<0.05为差异有统计学意义。
2 结果
2.1 手术方式及病理结果501 例术后病理确诊为PTC 患者中,男148 例,年龄27~64 岁,平均(40.7 ± 10.3)岁,女353 例,年龄23~74 岁,平均(42.9±12.1)岁。316例患者行甲状腺侧叶切除术,185 例患者行甲状腺全叶切除术。所有患者行中央区淋巴结清扫,301 例患者行中央区+颈侧区淋巴结清扫。病理显示,229 例存在中央区淋巴结转移,272 例无中央区淋巴结转移。
2.2 中央区淋巴结转移的二维超声单因素分析结果以有无中央区淋巴结转移的病理结果为因变量,以术前结节的二维超声特征作为自变量,进行单因素分析(表1),单因素分析结果显示中央区淋巴结转移组与无淋巴结转移组病灶大小、边缘、纵横比、多灶性、微钙化、病灶与甲状腺包膜关系比较差异有统计学意义(P<0.05)。
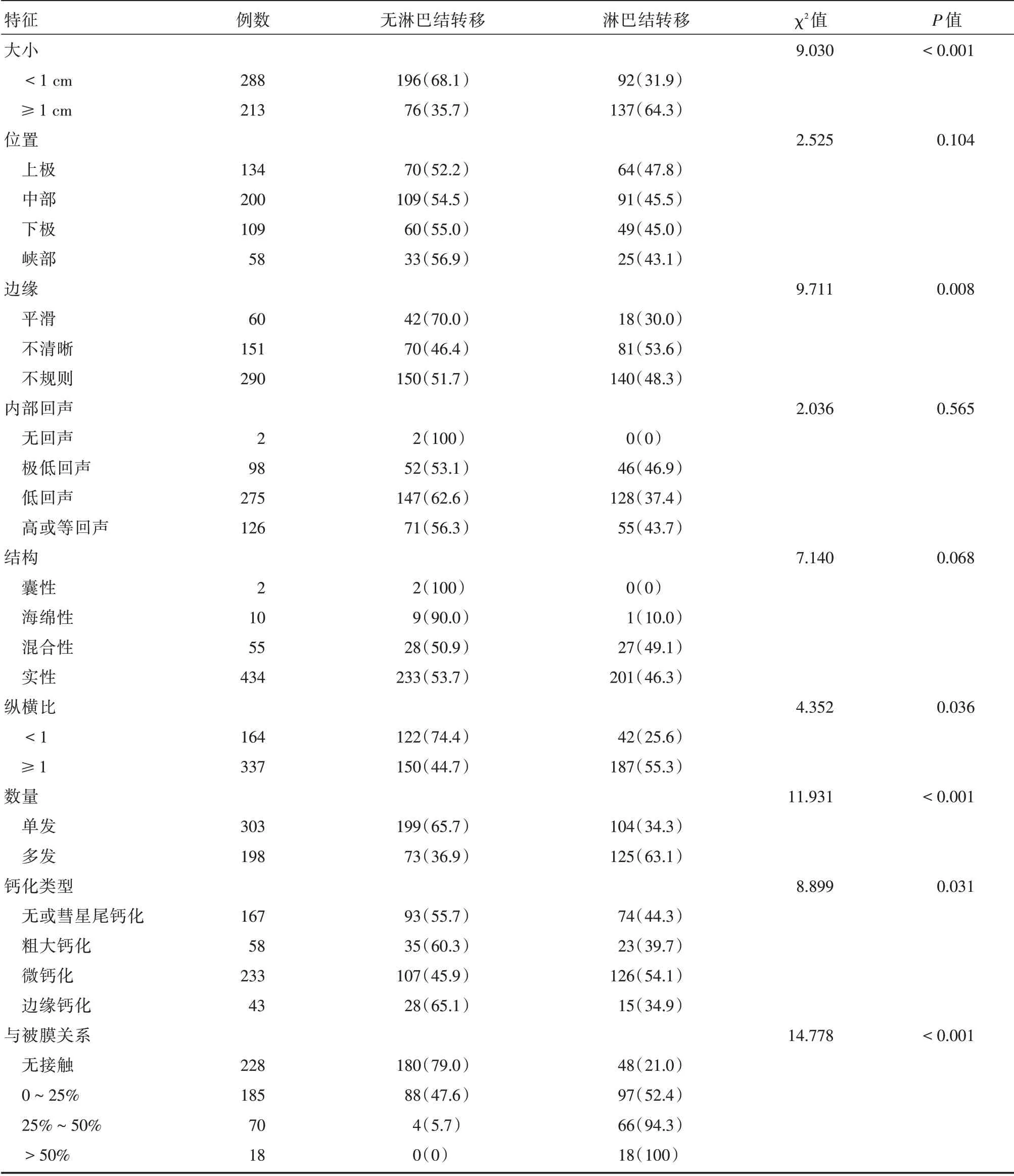
表1 PTC 中央区淋巴结转移单因素分析Tab.1 Single factor analysis of PTC lymph node metastasis 例(%)
2.3 PTC 中央区淋巴结转移的logistic 回归分析结果将二维超声单因素分析结果及Emin、Emean及Emax 进行二元logistic 回归筛选变量。结果显示病灶大小、病灶与包膜关系、多灶性以及Emean为PTC 中央区淋巴结转移的独立危险因素(P<0.05,表2)。同时将多因素logistic 回归得出的预测概率值做出ROC 曲线(图1),ROC 曲线下面积(AUC)为0.908。
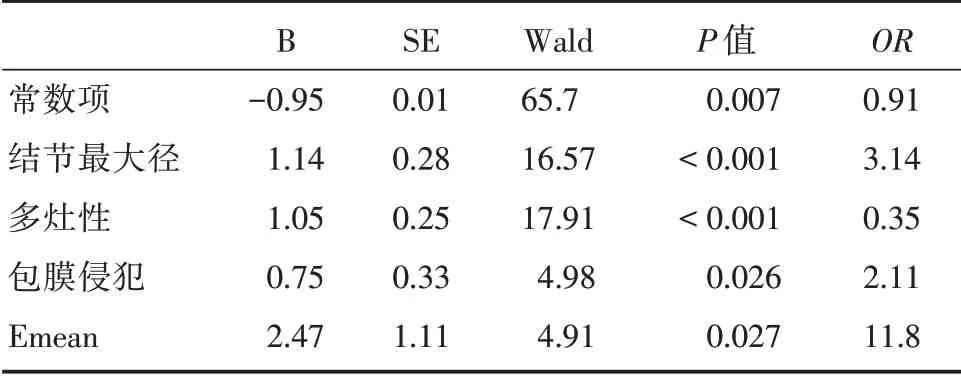
表2 PTC 中央区淋巴结转移的logistic 回归分析结果Tab.2 Logistic regression analysis results of central lymph node metastasis in PTC

图1 多因素logistic 回归预测概率值预测PTC 中央区淋巴结转移的ROC 曲线Fig.1 The ROC curve of multivariate logistic regression for predicting the probability value of central lymph node metastasis in PTC
2.4 剪切波弹性成像截断值的确定501 例行中央区淋巴结清扫患者中,转移组Emax、Emean、Emin 平均值分别为92.3、72.1、43.9 kPa,非转移组Emax、Emean、Emin 平均值分别为86.7、58.3、39.1 kPa,组间比较采用U检验,PTC 颈部中央区淋巴结转移与PTC 病灶Emean 测值相关。Emean 对PTC 中央区淋巴结转移的预测价值的ROC 曲线见图2。图2 示其对中央区淋巴结转移ROC 曲线下面积(AUC)为0.894,约登指数为0.779,得出诊断PTC 中央区淋巴结转移的最佳截断值为59.7 kPa。
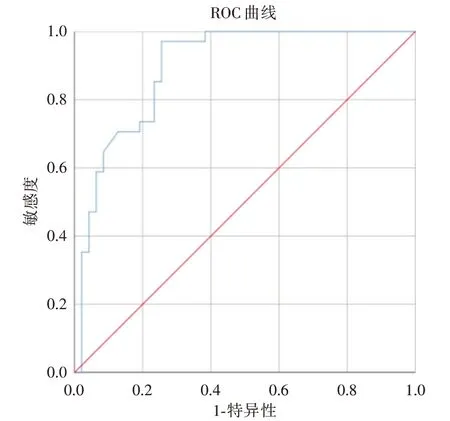
图2 Emean 预测PTC 颈部淋巴结转移的ROC 曲线Fig.2 The ROC curve of Emean predicting central lymph node metastasis of PTC
2.5 模型的验证建立模型后,对131 例验证队列进行验证,模型预测中央区淋巴结转移38 个(图3,为同一病灶)。术后病理证实中央区淋巴结转移42 个,无转移89 个,模型正确预测阳性38 个,漏诊4 个,正确预测阴性83 个,误诊6 个,模型预测的准确性为93.1%,敏感度为90.5%,漏诊率为9.5%,特异度为93.2%,误诊率为6.8%。

图3 中央区淋巴结转移阳性的PTC 超声图像Fig.3 Ultrasound image of PTC with positive central lymph node metastasis
3 讨论
PTC 发生颈部淋巴结转移是影响复发和预后的重要危险因素,通常转移首先发生在中央区淋巴结[7],因此,中央区淋巴结也被认为是PTC 前哨淋巴结,其状态可以预测PTC 的颈侧区淋巴结有无受累并影响患者手术方案的选择[5]。 因此,术前评估中央区淋巴结状态至关重要。美国甲状腺协会(ATA)强烈建议所有因甲状腺结节为恶性或可疑恶性的手术患者进行颈部淋巴结(包括中央和颈侧区淋巴结)术前超声检查[5]。然而,常规二维超声对中央区淋巴结状态的评估尤其是特异性并不令人满意[8],其他成像技术可能会提供相关信息以帮助诊断。SWE 由于其高再现性及高诊断性能,在颈部中央区淋巴结(尤其是直径较小的淋巴结)评估中显示了广阔的前景[9]。颈中央淋巴结比颈侧区淋巴结小得多,平均大小<1 cm[10],因此,SWE 对于诊断PTC 中央区淋巴结更有价值。本研究主要研究二维超声联合SWE 对PTC 中央区淋巴结转移的预测价值。
关于PTC 发生中央区淋巴结转移的危险因素研究较多,但目前研究结果未达成一致意见。本研究通过单因素及多因素分析,得出病灶大小、病灶与甲状腺包膜关系、多灶性是PTC 中央区淋巴结转移的独立危险因素,与以往研究结果基本一致[11-12]。与其他肿瘤相同,PTC 病灶越大,越容易侵犯包膜,颈部淋巴结转移风险越高,预后越差,但各项研究对癌灶大小的诊断临界值意见尚未统一。近期多位学者以不同的临界值进行研究,均发现肿瘤大小可作为PTC 中央区淋巴结转移的独立危险因素。多数研究[13-14]证实肿瘤大于1 cm 为中央区发生淋巴结转移的危险因素。本研究以1 cm 为界,发现肿瘤最大径>1 cm 是PTC 发生中央区淋巴结转移的独立危险因素,与以往的研究结果一致。多项研究证实,PTC 的病灶数目与中央区淋巴结转移相关[15-16],是因为病灶越多,增加了癌灶的侵袭性及肿瘤负荷,发生淋巴结转移的几率更大。甲状腺周围淋巴结丰富,癌灶侵犯周围包膜面积越多,越容易累及周围淋巴管,从而发生淋巴结转移。
剪切波可用于评估甲状腺结节的性质,但对于预测甲状腺乳头状癌淋巴结的转移,研究结果不一。PARK 等[17]纳入了208 例甲状腺乳头状癌患者,多因素回归分析发现Emean 和Emin 是预测甲状腺乳头状癌有无甲状腺外扩散的独立因素。HONG 等[18]对127 例PTC 患者进行回顾性分析,发现颈部淋巴结转移与弹性成像评分差异无统计学意义。JIANG 等[19]对147 例PTC 患者分析其二维超声超声及剪切波弹性值,通过绘制列线图方法,得出SWE 对PTC 中央区淋巴结转移有很好的预测价值。CHANG 等[20]对22 例PTC 手术患者在快速冰冻前进行离体剪切波扫查,在所有患者中,将二维超声与SWE 联合使用,结果显示联合方法的AUC 均高于二维超声。本研究与以往研究不同之处在于将剪切波弹性值纳入危险因素分析中,并与二维超声结果相结合,得出病灶大小、病灶与甲状腺包膜关系、多灶性及Emean 是PTC 中央区淋巴结转移的独立危险因素。本研究对501例PTC结节进行二维超声联合SWE检查,通过单因素和多因素筛选变量,并对131 例PTC 结节进行验证,在验证队列,二维超声联合Emean 提高了预测PTC 中央区淋巴结转移的敏感性及特异性,可增加中央区淋巴结转移的诊断准确率,避免患者的过度治疗,减少手术尤其是中央区淋巴结清扫带来的并发症,为临床手术方式的选择提供一定的指导意义。
本研究不足之处在于所选取患者为入院患者,可能存在一定的选择偏倚,下阶段可将粗针穿刺及FNA 确诊为PTC 的患者纳入其中进行相关研究。此外此研究为单中心研究,为回顾性研究,使用了两位超声医师之一获得的预先采集的SWE 图像,对SWE 联合二维超声与PTC 患者中央区淋巴结转移状态之间的关系还需进行多中心、大样本、前瞻性研究。且既往研究将甲状腺背景如甲亢、桥本等考虑其中,本研究由于为回顾性研究且病例数限制,未考虑上述疾病影响,期待扩大样本量进行后续研究。
本研究结果证明二维超声联合SWE 对PTC 中央区淋巴结转移具有良好的预测能力,可提高术前诊断率,为临床手术方案的选择提供一定的指导意义。
