细胞周期蛋白L1对人绒毛膜滋养细胞生物学行为的影响
2021-08-06杨闪闪唐冉冉江华汤秋勤
杨闪闪 唐冉冉 江华 汤秋勤
1南京医科大学(南京210029);2南京医科大学附属妇产医院(南京市妇幼保健院)(南京210004)
胎儿生长受限(fetal growth restriction,FGR)指胎儿应有的生长潜力受损,估测的胎儿体质量小于同孕龄第10 百分位数的小于孕龄儿[1]。我国FGR 平均发病率为6.39%[2]。 FGR 会增加胎儿窘迫、早产、死产等多种不良妊娠结局,对子代远期健康也会造成不良影响[3]。FGR 发病机制尚不明确,母亲对胎儿的营养供应主要通过胎盘转运,胎盘发育缺陷或功能障碍往往导致FGR[4]。滋养层细胞是胎盘最主要和最重要的成分,了解滋养层细胞功能的影响因素,从胎盘层面寻找FGR 防治的新分子并深入研究相关机制十分必要。
细胞周期蛋白L1(cyclin L1,CCNL1)定位于3q25.31,是细胞周期蛋白家族成员之一,参与前体mRNA 的剪切及RNA 的加工,并与细胞周期蛋白依赖性激酶的作用相关[5]。多个GWASs 研究在《Nature Genetics》等杂志上报道了CCNL1 为新生儿出生体重相关基因[6-9],位于CCNL1 附近的rs900400 与出生体重降低显著相关,每个风险等位基因可使出生体重降低35 g[8]。本研究通过体外实验将滋养细胞过表达和干扰CCNL1 基因后,观察滋养细胞迁移、侵袭、增殖能力及细胞周期、凋亡的变化,为FGR 发病机制的研究提供新的思路。
1 材料与方法
1.1 主要试剂和细胞人绒毛膜滋养细胞(HTR8⁃/SVneo)为本实验室储存细胞株。CCNL1 过表达慢病毒及其对照慢病毒购自汉恒生物科技有限公司、CCNL1 小干扰RNA 及其小干扰对照RNA 购自锐博生物科技有限公司;转染试剂Lipofectamine 3000 和Trizol 购自美国Invitrogen 公司;逆转录试剂盒、荧光定量PCR 试剂盒和蛋白Marker 购自美国Thermo 公司;电泳、转膜相关试剂购自赛维尔生物科技有限公司;实验所用抗体购自美国SANTA CRUZ 公司;CCK⁃8 试剂盒购自日本Dojindo 公司;Transwell 试剂盒购自美国Corning 公司;细胞凋亡试剂盒购自南京诺唯赞生物科技有限公司;细胞周期检测试剂盒购自上海碧云天生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养HTR⁃8/SVneo 培养于含10%胎牛血清的DMEM 培养基,于37 ℃,5% CO2培养箱中培养。
1.2.2 细胞转染转染前1 d 将HTR⁃8/SVneo 细胞分别消化并接种于六孔板,待细胞融合度达60%~ 70%,按照Lipofectamine 3000 转染试剂说明书和慢病毒转染方法操作。将转染的细胞分为CCNL1过表达对照组(CCNL1⁃NC)、CCNL1 过表达组(CCNL1⁃OE);干扰对照组(CCNL1⁃SiNC)、干扰组1(CCNL1⁃Si1)、干扰组2(CCNL1⁃Si2)、干扰组3(CCNL1⁃Si3)。
1.2.3 总RNA 提取及实时定量PCR 检测转染24 h 后,按照Trizol 法提取细胞中的RNA 并测定浓度,参照Thermo 逆转录试剂盒,反转录成cDNA。按照SYBGreen 说明书操作,于Thermo 实时荧光定量PCR 进行分析,以2⁃△△Ct平均值作为其mRNA 表达水平。
1.2.4 蛋白质提取及WB 法检测转染48 h 后,使用RIPA 和PMSF 提取蛋白,参照BCA 蛋白定量试剂盒说明书测定蛋白浓度,然后按照WB 法操作,最后用Image J 软件分析,以目的蛋白条带灰度值/内参蛋白条带灰度值的比值作为CCNL1 蛋白相对表达量。
1.2.5 细胞增殖实验转染24 h后,将HTR⁃8/SVneo细胞接种于96孔板中,密度为3 000个/孔。分别于0(即细胞贴壁后)、24、48、72 h向每孔加入10 μL 的CCK⁃8 溶液,培养箱培养2 h 后,检测450 nm 的吸光度值。
1.2.6 细胞侵袭实验提前将基质胶4 ℃融化后加入Transwell 小室上层,37 ℃温育凝固成胶状。分别收集各组细胞,用不含FBS 的培养基稀释后,按照3 × 104个/孔加入小室上层,下层加入600 μL完全培养基。细胞培养72 h 后,加入4%多聚甲醛内固定,结晶紫染色,用棉棒将小室内层未迁移过膜的细胞擦除,显微镜下拍照后统计结果。
1.2.7 细胞迁移实验Transwell 小室上层无需铺基质胶,其余步骤均同侵袭实验。
1.2.8 流式细胞术检测细胞周期用不含EDTA的胰酶消化后分别收集各组细胞,70%乙醇4 ℃固定过夜。离心后弃上清液,加入预冷PBS 轻轻振荡重悬细胞。离心收集细胞后加入配置好的碘化丙啶染色液染色、滤网过滤,采用流式细胞仪检测细胞周期。
1.2.9 流式细胞术检测细胞凋亡用不含EDTA的胰酶消化后分别收集各组细胞,离心后弃上清液,加入预冷PBS 轻轻振荡重悬细胞,离心收集细胞后加入Annexin V⁃PE 和7⁃AAD 避光、室温孵后滤网过滤,采用流式细胞仪检测细胞凋亡情况。
1.3 统计学方法应用SPSS 26.0 统计软件进行分析,计量资料以均数±标准差表示,组间均数比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 CCNL1 转染效果检测qPCR 检测和WB 检测结果显示,与CCNL1⁃NC 组相比,CCNL1⁃OE 组CCNL1mRNA 和蛋白表达水平升高,差异有统计学意义(P<0.05),见图1、2;与CCNL1⁃SiNC 组相比,CCNL1⁃Si1 组、CCNL1⁃Si2 组、CCNL1⁃Si3 组CCNL1 mRNA 和蛋白表达水平降低,差异有统计学意义(P<0.05),见图1、2。
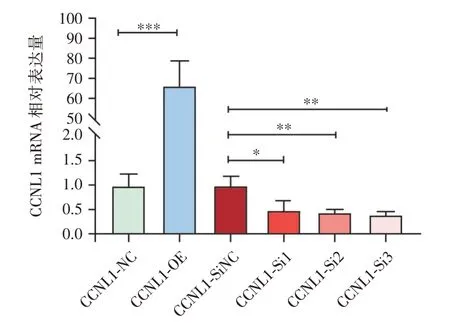
图1 各组HTR⁃8/SVneo 细胞中CCNL1 mRNA 相对表达水平Fig.1 Relative mRNA levels of CCNL1 in HTR⁃8/SVneo cells in each group
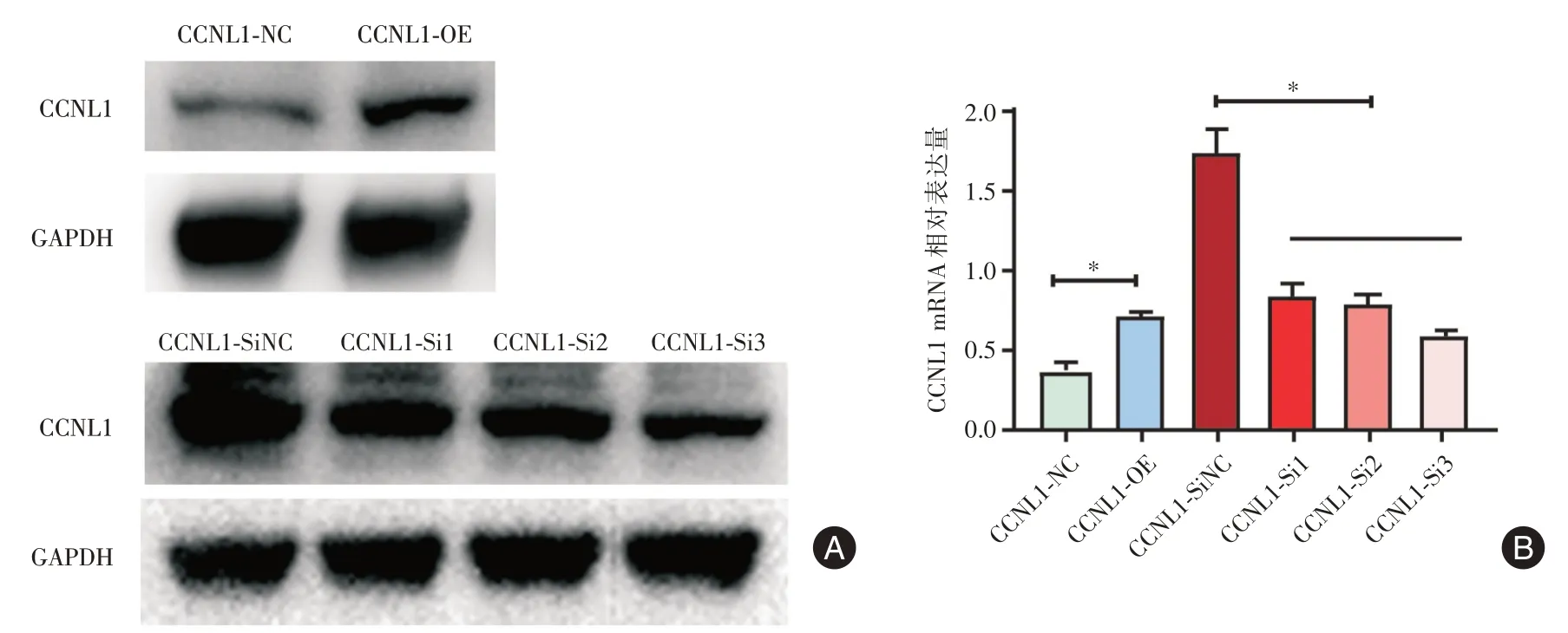
图2 各组HTR⁃8/SVneo 细胞中CCNL1 蛋白相对表达水平Fig.2 Relative protein levels of CCNL1 in HTR⁃8/SVneo cells in each group
2.2 CCNL1 表达变化对HTR⁃8/SVneo 细胞增殖的影响CCK⁃8 实验显示,转染24、48、72 h 后,与CCNL1⁃NC 组相比,CCNL1⁃OE 组的细胞活性减弱,差异具有统计学意义(P<0.01),见图3A;转染24、48、72 h 后,与CCNL1⁃SiNC 组相比,CCNL1⁃Si1 组、CCNL1⁃ Si2 组、CCNL1⁃Si3 组的细胞活性增强,差异具有统计学意义(P<0.01),见图3B。

图3 各组HTR⁃8/SVneo 细胞增殖实验结果Fig.3 Results of HTR⁃8/SVneo cell proliferation in each group
2.3 CCNL1 表达变化对HTR⁃8/SVneo 细胞侵袭的影响Transwell实验显示,与CCNL1⁃NC组相比,CCNL1⁃OE 组穿膜侵袭细胞数降低,差异具有统计学意义(P<0.001),见图4 和表1;与CCNL1⁃SiNC组相比,CCNL1⁃Si1 组、CCNL1⁃ Si2 组、CCNL1⁃Si3组穿膜侵袭细胞数增多,差异具有统计学意义(P<0.001),见图4 和表1。
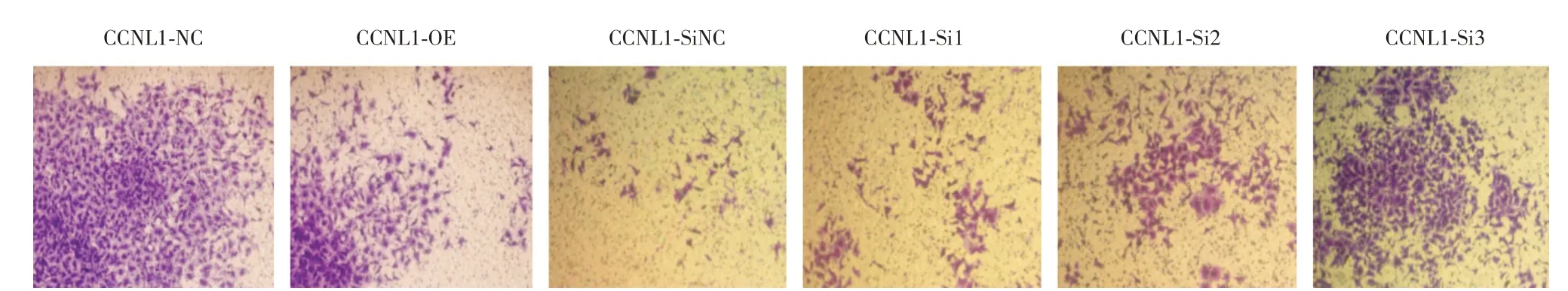
图4 各组HTR⁃8/SVneo 细胞侵袭室验结果Fig.4 Results of HTR⁃8/SVneo cell invasion in each group
2.4 CCNL1 表达变化对HTR⁃8/SVneo 细胞迁移的影响Transwell实验显示,与CCNL1⁃NC组相比,CCNL1⁃OE 组穿膜迁移细胞数降低,差异具有统计学意义(P<0.001),见图5和表1;与CCNL1⁃SiNC组相比,CCNL1⁃Si1 组、CCNL1⁃Si2 组、CCNL1⁃Si3 组穿膜迁移细胞数增多,差异具有统计学意义(P<0.001),见图5 和表1。

图5 各组HTR⁃8/SVneo 细胞迁移实验结果Fig.5 Results of HTR⁃8/SVneo cell migration in each group
表1 各组HTR⁃8/SVneo 穿膜细胞数比较Tab.1 Comparison of the number of HTR⁃8/SVneo penetrating cells in each group ±s
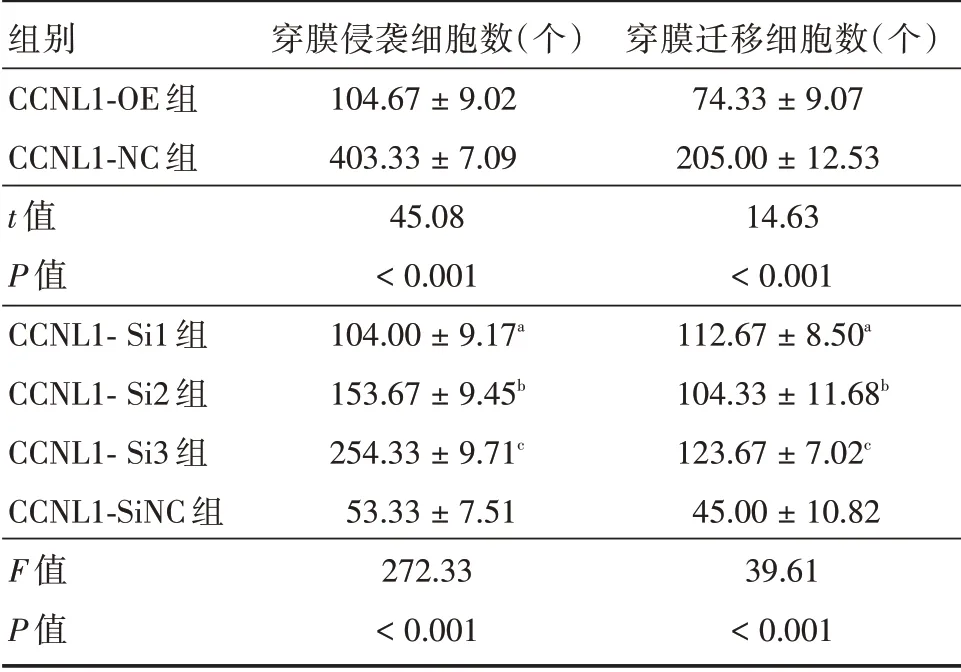
表1 各组HTR⁃8/SVneo 穿膜细胞数比较Tab.1 Comparison of the number of HTR⁃8/SVneo penetrating cells in each group ±s
注:CCNL1⁃Si1 组与CCNL1⁃SiNC 组比较,aP <0.001;CCNL1⁃Si2组与CCNL1⁃SiNC 组比较,bP <0.001;CCNL1⁃Si3 组与CCNL1⁃SiNC组比较,cP <0.001
组别CCNL1⁃OE 组CCNL1⁃NC 组t 值P 值CCNL1⁃Si1 组CCNL1⁃Si2 组CCNL1⁃Si3 组CCNL1⁃SiNC 组F 值P 值穿膜侵袭细胞数(个)104.67±9.02 403.33±7.09 45.08<0.001 104.00±9.17a 153.67±9.45b 254.33±9.71c 53.33±7.51 272.33<0.001穿膜迁移细胞数(个)74.33±9.07 205.00±12.53 14.63<0.001 112.67±8.50a 104.33±11.68b 123.67±7.02c 45.00±10.82 39.61<0.001
2.5 CCNL1 表达变化对HTR⁃8/SVneo 细胞周期的影响流式分析结果显示,分别与CCNL1⁃NC 组细胞的G1 期、S 期、G2 期相比,CCNL1⁃OE 组细胞的G1 期和G2 期细胞比例差异无统计学意义(P>0.05),S 期细胞比例降低(P<0.05),见图6 和表2;分别与CCNL1⁃SiNC 组细胞的G1 期、S 期、G2 期相比,干扰组(CCNL1⁃Si1、CCNL1⁃Si2、CCNL1⁃Si3)的G1 期、S 期、G2 期细胞比例差异无统计学意义(P>0.05),见图6 和表2。
表2 各组HTR⁃8/SVneo 细胞周期比例比较Tab.2 Comparison of cell cycle ratio of HTR⁃8/SVneo in each group ±s
表2 各组HTR⁃8/SVneo 细胞周期比例比较Tab.2 Comparison of cell cycle ratio of HTR⁃8/SVneo in each group ±s
注:CCNL1⁃OE 组与CCNL1⁃NC 组比较,dP <0.05
组别CCNL1⁃OE 组CCNL1⁃NC 组t 值P 值CCNL1⁃Si1 组CCNL1⁃Si2 组CCNL1⁃Si3 组CCNL1⁃SiNC 组F 值P 值G1 期60.14±1.96 57.18±2.03 1.48 0.28 52.39±0.64 55.55±2.72 51.81±0.36 51.41±0.91 3.25 0.14细胞周期(%)S 期18.53±0.38d 21.61±0.41-0.77 0.02 24.59±1.92 24.49±1.10 26.97±1.00 26.52±0.81 2.02 0.25 G2 期21.33±1.57 21.21±2.44 0.06 0.96 23.03±1.28 19.96±1.61 21.23±1.36 22.08±1.71 1.50 0.34

图6 CCNL1 过表达或干扰对细胞周期的影响Fig.6 Effects of CCNL1 overexpression or interference on cell cycle
2.6 CCNL1 表达变化对HTR⁃8/SVneo 细胞凋亡的影响流式分析结果显示,CCNL1⁃OE组和CCNL1⁃NC 组中凋亡细胞比例分别为(8.52 ± 0.99)%和(11.42 ± 0.16)%,差异无统计学意义(P>0.05),见图7。
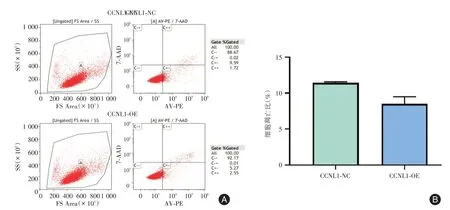
图7 CCNL1 过表达或干扰对细胞凋亡的影响Fig.7 Effects of CCNL1 overexpression orInterference on cell apoptosis
3 讨论
FGR 是一种常见的新生儿出生体重异常疾病,发病机制复杂,目前仍未阐明。胎盘是胚胎生长发育的关键器官,承担母体及胎儿之间营养物质的摄取和转运。研究[10-12]表明FGR 胎盘组织中存在着异常表达的基因,这些基因可通过调控胎盘滋养层细胞的功能,改变滋养细胞的侵袭、迁移能力,打破胎盘滋养细胞增殖/凋亡平衡而导致胎盘功能障碍,与FGR 的发生发展密切相关。
近年来,多个研究报道了CCNL1为新生儿出生体重相关基因,与FGR 的发生密切相关。研究[13]发现CCNL1 家族成员Cyclin D1 敲除后,小鼠出生体重下降,发育异常率增加,CCNL1 基因与FGR 间的关系引起人们关注。CCNL1 是细胞周期蛋白家族的一员,参与前体mRNA 的剪切及RNA 的加工,并与细胞周期蛋白依赖性激酶的作用相关[14]。目前国内外有很多研究发现,CCNL1 在肿瘤进展方面发挥重要作用,被认为是肿瘤预后因子和调节细胞增殖因子,研究发现CCNL1 可以改变多种肿瘤细胞的侵袭、迁移能力[15-18]。胎盘被认一种类肿瘤组织,其功能细胞——滋养细胞具有与肿瘤细胞相似的侵袭及增殖行为,不同之处在于肿瘤不受控制,而人滋养细胞的侵袭局限于子宫内膜和子宫肌层的上三分之一处[19]。故猜测CCNL1基因在胎盘的发育和功能中也发挥一定作用。但目前CCNL1 调控胎盘滋养层细胞功能作用机制并不完全清楚。
本研究结果发现,CCNL1 在HTR⁃8/SVneo 中过表达后,细胞的增殖、侵袭、迁移能力降低,而CCNL1 在HTR⁃8/SVneo 中干扰后,细胞的增殖、侵袭、迁移能力增强。细胞周期分为间期与分裂期两个阶段。间期又分为三期、即DNA 合成前期(G1 期)、DNA 合成期(S 期)与DNA 合成后期(G2 期),CCNL1 在HTR⁃8/SVneo 中过表达后,细胞阻滞于S 期。这些结果均表明CCNL1 在HTR⁃8/SVneo中是一个抑制增殖因子。推测过表达CCNL1基因会减少滋养层细胞侵入子宫蜕膜与子宫肌层能力,导致胎盘的浅着床,不利于子宫螺旋动脉的重铸,影响胎盘发育,限制母胎血液循环及营养物质转运。国内外学者和本课题组前期研究均发现胎盘的体积和重量与新生儿出生体重成正相关,巨大儿胎盘明显增大,而FGR 胎盘则明显缩小[20-21]。由此可见胎盘中高表达CCNL1 可影响胎盘发育从而导致FGR 的发生。
综上所述,CCNL1 能够抑制HTR⁃8/SVneo 增殖,降低侵袭、迁移能力,可能影响细胞周期分布。本研究探讨了CCNL1 对人绒毛膜滋养细胞生物学行为的影响,为从胎盘层面寻找FGR 防治提供了思路,有助于阐明在FGR 发生中的分子机制,并可能为FGR 防治提供潜在的干预靶标,以改善妊娠结局,提高新生儿的生存质量。
