BX⁃912对前列腺癌骨转移小鼠骨质破坏的影响
2021-08-06张亚男周佺农海斌韦寿锋张琼白亦光刘明富曾高峰宗少晖
张亚男 周佺 农海斌 韦寿锋 张琼 白亦光 刘明富 曾高峰 宗少晖
1广西医科大学第一附属医院脊柱骨病外科(南宁530021);2广西医科大学公共卫生学院(南宁530000);3广西医科大学,广西生物医药协同创新中心(南宁530021)
在全球男性常见的恶性肿瘤中,前列腺癌发病率仅次于肺癌居第二位,占恶性肿瘤总数的13.5%[1]。前列腺癌在早期症状不明显,大约50%的患者确诊即伴有骨转移,有超过约75%的前列腺癌患者会最终发生骨转移[2]。癌细胞侵犯到骨骼会引起的脊髓压迫、病理性骨折等骨骼并发症,严重者可能出现全身器官功能衰竭[3]。由于大多数患者确诊时已经发生远处转移或已到晚期,临床上对于此类患者没有根治性方案[4]。目前治疗前列腺癌主要应用手术、化疗、内分泌治疗、放疗等方法[5-6],近年来虽然通过改进治疗技术、优化治疗方案,前列腺癌的中位生存期有所提高[7],但是前列腺癌一旦发生转移,无法彻底治愈,而目前的放化疗等治疗手段给患者带来严重副作用[8-9],因此寻求防治前列腺癌及其转移的新靶点具有重要意义。磷脂酰肌醇3⁃激酶/蛋白激酶B(PI3K/AKT)通路参与细胞增殖、分化和葡萄糖转运等多种细胞调节过程,是肿瘤的基础信号通路之一[10]。磷酸肌醇依赖性蛋白激酶⁃1(PDK⁃1)被认为是PI3K⁃AKT 级联的重要上游脂质激酶,通过磷酸化的方式激活AKT,触发级联反应,进一步激活AKT下游因子[11]。目前对PDK⁃1 研究逐渐成为肿瘤研究的热点,但是对PDK⁃1 的具体分子机制研究尚未明确。有学者在非霍奇金淋巴瘤中抑制PDK⁃1 阻断其下游的信号传导通路,通过诱导细胞凋亡和阻断细胞周期抑制非霍奇金淋巴瘤的生长[12],表明通过药物抑制PDK⁃1 可以抑制非霍奇金淋巴瘤生长。因此推测BX⁃912 可能抑制前列腺癌的生长与转移,本研究通过体外、体内验证其对前列腺癌的影响,为研究前列腺癌骨转移的治疗提供新的思路。
1 材料与方法
1.1 材料30 只8 周龄C57BL/6 雄鼠购于广西医科大学动物实验中心,体质量18~22 g,RM⁃1 购于美国ATCC 公司,BX⁃912 购美国Selleck 公司,胎牛血清购于美国VWR 公司,DMEM 培养基、0.25%胰蛋白酶、PBS 和2.5%结晶紫染液购于索莱宝公司,CCK⁃8 购于上海碧云天生物技术有限公司。
1.2 细胞增殖⁃毒性检测(CCK⁃8)RM⁃1 以2 000个/孔密度接种于96 孔板上,置于细胞培养箱中培养,24 h 后用含有不同浓度BX⁃912(0、0.156、0.313、0.625、1.25、2.5、5、10、20、40 μmol/L)的完全培养基换液,分别培养12、24、36、48 h 后,每孔加入10 μL CCK⁃8,将96 孔板放回细胞培养箱孵育2 h,Microplate Reader795 酶标仪测450 nm 波长处的OD值。
1.3 细胞划痕实验取对数期生长RM⁃1 以5 ×105个/孔种植于6 孔板中培养至95%融合度,每孔加入20 μg/mL 的丝裂霉素C,放回细胞培养箱孵育2 h,吸去培养基,用灭菌100 μL 枪头在孔中垂直划线,PBS 小心清洗3 次,分别加入配置好含有BX⁃912(0、2.5、5 μmol/L)的无血清DMEM 培养基,放回细胞培养箱,在加药后(0、8、16、24 h)时间点在倒置显微镜下观察拍照,分析细胞迁移率。
1.4 细胞克隆实验取对数生长期的RM⁃1,用0.25%含有EDTA 的胰蛋白酶消化下来,计数后每孔加入250 个RM⁃1,置于5% CO2,37 ℃细胞培养箱中培养,约12 h 后细胞贴壁,用含有不同浓度的BX⁃912(0、2.5、5 μmol/L)的完全培养基换液(含10%胎牛血清),每隔3 d 换液,若培养皿中出现多个肉眼可见的克隆,用结晶紫染色液参照说明书对细胞进行染色。计算克隆形成数目及克隆形成率。
1.5 前列腺癌骨转移小鼠模型的建立30 只C57BL/6 雄鼠用5%水合氯醛(0.2 mL/只)腹腔注射,麻醉满意后,备皮,碘伏消毒三次右下肢膝关节周围,用微量注射器从右下肢胫骨近端胫骨头凹点进针,旋转穿刺2~3 mm,缓慢注射10 μL 配置好的细胞悬液(含5 × 105个RM⁃1),拔出注射器,碘伏消毒,待小鼠苏醒后放回笼中。
1.6 BX⁃912对前列腺癌骨转移小鼠模型干预造模成功后,30 只小鼠随机分为3 组,分别为对照组(PBS)、低浓度组(1 mg/kg)、高浓度组(5 mg/kg)。每隔1 天腹腔注射相应剂量的药物。14 d 取右下肢胫骨行Micro⁃CT 检测(SCANCO Medical AG,型号:μCT100),扫描参数:电压70 kV,电流200 μA,分辨率10 μm,随机选取胫骨近端骨溶解区域分析骨体积分数,骨小梁数目及骨小梁厚度,然后游离瘤体称重并进行统计学分析。
1.7 统计学方法使用SPSS 24.0 软件对数据进行统计分析,计量资料采用()表示,单因素方差分析用于比较不同组别之间的差异,两组间比较用独立样本t检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 CCK⁃8 检测RM⁃1 增殖活性结果在BX⁃912干预12、24、36、48 h 时间点分别通过CCK⁃8 检测RM⁃1增殖活性。在BX⁃912浓度为1.25 μmol/L及以上时对RM⁃1 有明显的抑制作用,并呈浓度依赖性(P<0.05),在0.625 μmol/L 及以下浓度时,BX⁃912对RM⁃1 无毒性作用(P>0.05,表1)。
表1 CCK⁃8 实验测定RM⁃1 增殖活性Tab.1 The proliferative activity of RM⁃1 was detected by CCK⁃8 ±s
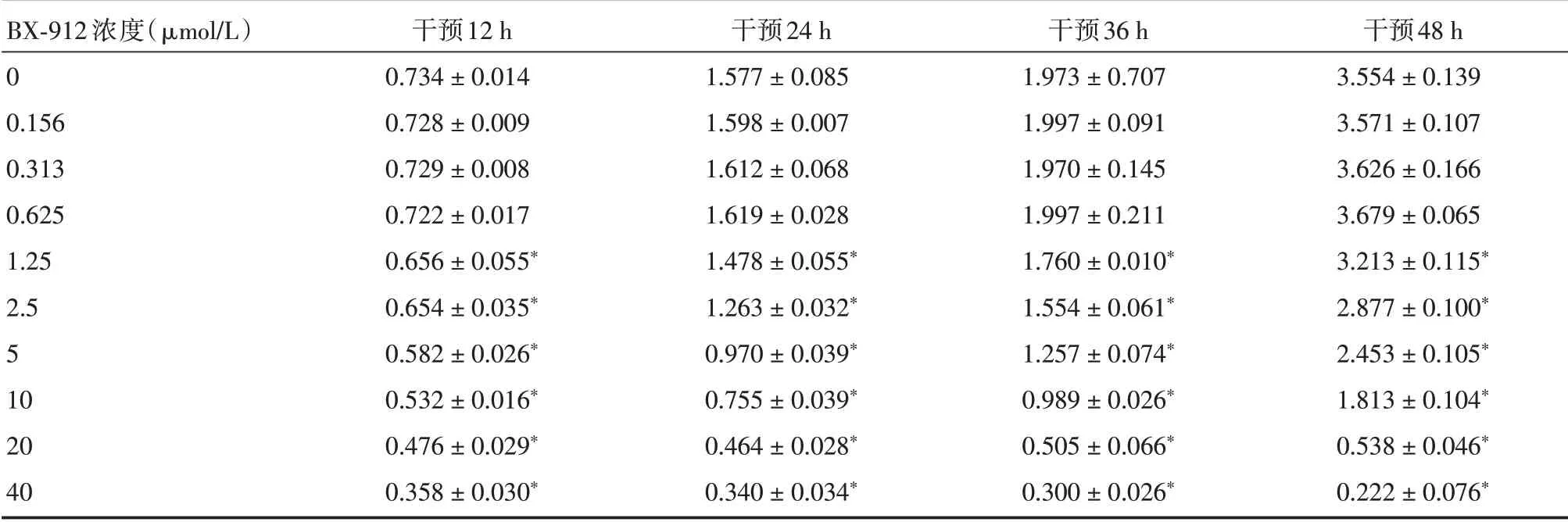
表1 CCK⁃8 实验测定RM⁃1 增殖活性Tab.1 The proliferative activity of RM⁃1 was detected by CCK⁃8 ±s
注:通过CCK⁃8 在12、24、36、48 h 时间点测定BX⁃912 干预RM⁃1 的OD 值,*P <0.05
BX⁃912 浓度(μmol/L)0 0.156 0.313 0.625 1.25 2.5 5 10 20 40干预12 h 0.734±0.014 0.728±0.009 0.729±0.008 0.722±0.017 0.656±0.055*0.654±0.035*0.582±0.026*0.532±0.016*0.476±0.029*0.358±0.030*干预24 h 1.577±0.085 1.598±0.007 1.612±0.068 1.619±0.028 1.478±0.055*1.263±0.032*0.970±0.039*0.755±0.039*0.464±0.028*0.340±0.034*干预36 h 1.973±0.707 1.997±0.091 1.970±0.145 1.997±0.211 1.760±0.010*1.554±0.061*1.257±0.074*0.989±0.026*0.505±0.066*0.300±0.026*干预48 h 3.554±0.139 3.571±0.107 3.626±0.166 3.679±0.065 3.213±0.115*2.877±0.100*2.453±0.105*1.813±0.104*0.538±0.046*0.222±0.076*
2.2 划痕实验检测RM⁃1 的迁移能力结果通过细胞划痕实验观察BX⁃912 对RM⁃1 细胞迁移能力的影响,结果显示BX⁃912 能显著抑制RM⁃1 的迁移能力(图1A),随着BX⁃912 浓度的增加,抑制效果更加明显(图1B)。
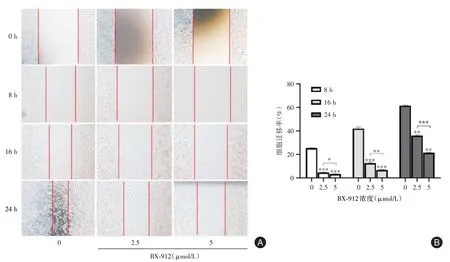
图1 BX⁃912 抑制RM⁃1 的迁移Fig.1 BX⁃912 inhibits the migration of RM⁃1
2.3 克隆实验检测RM⁃1 独立生存能力克隆结果显示,BX⁃912 干预组克隆形成数目较对照组低(图2A),对克隆数目计数显示三组克隆形成数:0 μmol/L 组>2.5 μmol/L 组>5 μmol/L 组(P<0.05,图2B),三组克隆形成率0 μmol/L 组>2.5 μmol/L 组>5 μmol/L 组(P<0.05,图2C),提示BX⁃912 能抑制RM⁃1 的独立生存能力,随着BX⁃912 浓度的增加,这种抑制作用更加明显。

图2 BX⁃912 抑制RM⁃1 克隆形成Fig.2 BX⁃912 inhibits clone formation of RM⁃1
2.4 BX⁃912 干预前列腺癌骨转移小鼠模型结果造模7 d 后,小鼠右下肢胫骨近端可触及绿豆大小包块,造模成功,进行药物干预,14 d 后处死小鼠,游离瘤体观察瘤体大小情况(图3A),进一步对瘤体称重统计分析,瘤体质量的比较结果为:对照组>低浓度组>高浓度组(P<0.05,见图3B),表明BX⁃912 能抑制前列腺癌骨转移瘤体的生长,并呈浓度依赖性。Micro⁃CT 检测显示骨侵蚀情况:对照组>低浓度组>高浓度组(P<0.05,图3D),表明BX⁃912 抑制了前列腺癌骨质破坏。选取骨溶解区域对骨参数进行统计分析,骨体积分数、骨小梁数目和骨小梁厚度(高浓度组>低浓度组>对照组,P<0.05,图3C⁃F),表明与对照组相比,BX⁃912 处理组骨质破坏受到抑制。
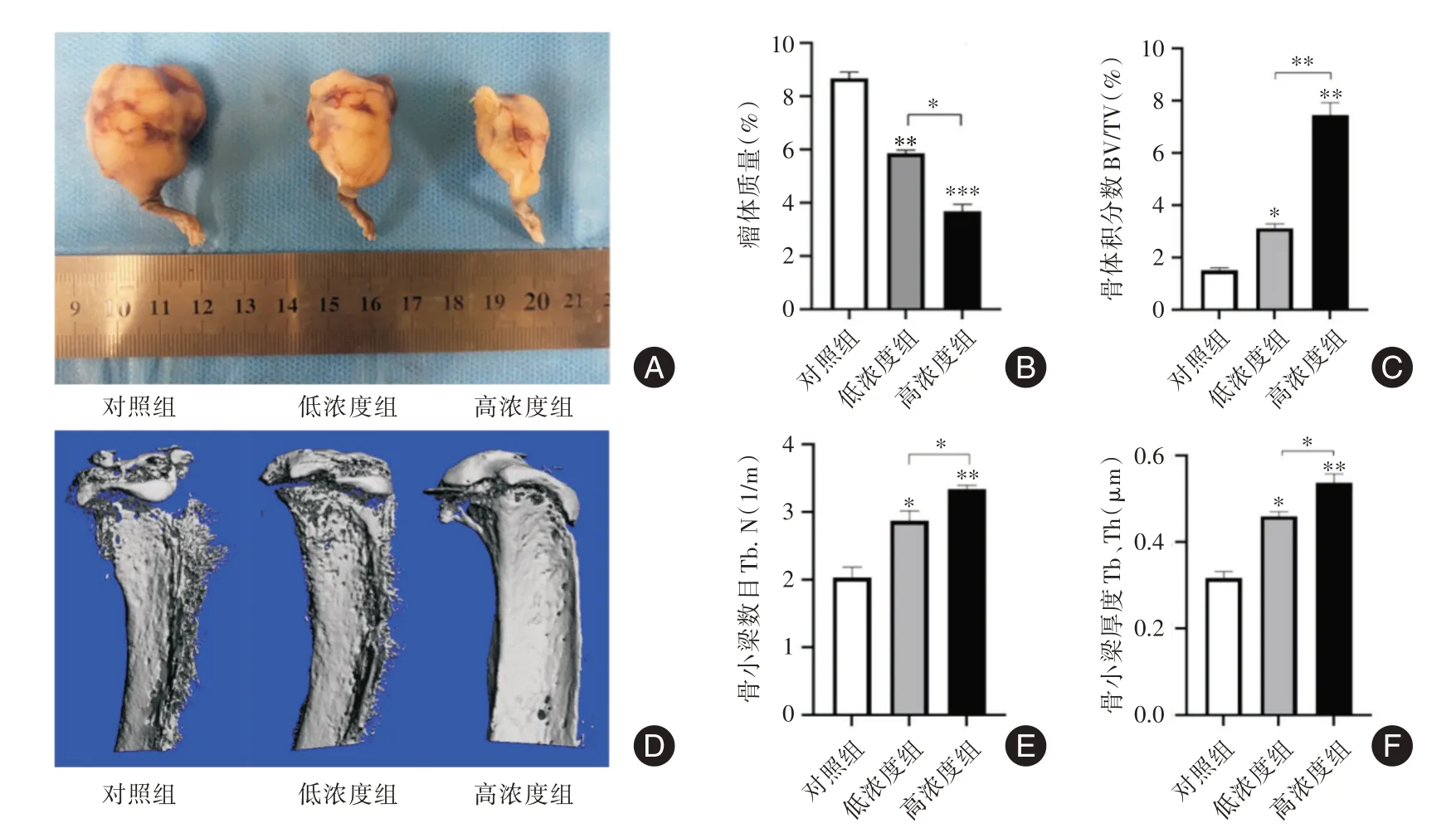
图3 BX⁃912 对前列腺癌骨转移模型的影响Fig.3 Effect of BX⁃912 on bone metastasis model of prostate cancer
3 讨论
前列腺癌是一种骨转移率极高的恶性上皮样肿瘤,且一旦发生转移,目前无法彻底治愈[13-14],严重的并发症及治疗副作用给患者及家庭带来巨大的精神压力及沉重的经济负担[15]。前列腺癌的发生的分子机制错综复杂,纠其根源是基因层面上的失调[16],所以目前对于前列腺癌的研究主要集中在其发病机制的分子信号通路上[17-18]。
PI3K/AKT 通路与前列腺癌的发生息息相关,在癌细胞转移的过程中调节细胞的转移、侵袭和生长,激活此通路可以促进前列腺癌的发展[19]。有研究[20]表明PI3K/AKT 信号传导途径在大多数癌症中被过度激活,PI3K/AKT 通路与其他通路相互作用可以驱动前列腺癌的进展。而AKT 属于PDK⁃1 的下游激活元素,理论上抑制PDK⁃1 可以间接抑制了AKT 的磷酸化[21]。因此推测通过靶向抑制PDK⁃1 可能会抑制前列腺癌生长与转移。本研究在CCK⁃8 结果的基础上设计细胞划痕实验和细胞克隆实验,结果发现BX⁃912 显著抑制RM⁃1 细胞的迁移能力和独立生存能力。本研究结果显示低浓度组和高浓度组的瘤体较小,骨质破坏受到抑制,并且这种抑制呈现浓度依赖性,进一步验证了通过靶向抑制PDK⁃1 可以抑制前列腺癌对骨骼的破坏。
本研究仍存在不足之处,骨形成和骨吸收是成骨细胞和破骨细胞动态相互作用的过程,破骨细胞是骨组织内唯一具有骨吸收功能的细胞,其来源于骨髓源巨噬细胞的分化,分化过程受巨噬细胞集落刺激因子(M⁃CSF)和核因子κB 受体活化因子配体(RANKL)两种关键因子的调控[22],同时成骨细胞分泌的骨保护素(OPG)可以竞争性抑制RANKL,骨微环境的改变会使这些因子发生相应的变化,肿瘤细胞侵袭骨骼会造成这种稳态调控的失调,这涉及到多种因子及调节蛋白的参与[23],而BX⁃912 在这些机制中作用尚不清楚。除此之外,有关BX⁃912 抑制RM⁃1 增殖与迁移生物学分子机制有待进一步研究。
