地西他滨联合预激方案治疗首疗程标准诱导化疗失败急性髓系白血病疗效及安全性分析
2021-08-06陈依丽赵文舒郭绪涛赵珂张钰刘启发戴敏
陈依丽 赵文舒 郭绪涛 赵珂 张钰 刘启发 戴敏
南方医科大学南方医院血液内科(广州510515)
数十年来,蒽环类联合阿糖胞苷(cytarabine,Ara⁃C)组成的“3+7”化疗方案是初诊急性髓系白血病(acute myeloid leukemia,AML)的标准治疗方案[1-3]。<65岁的患者中完全缓解(CR)率45%~65%,而65 岁以上的患者中CR 率仅为30% ~ 40%[4]。目前,对于初次标准诱导化疗失败的患者没有统一的治疗方法,不同再诱导化疗方案的结果差异较大,再诱导方案的选择成为了一个亟需解决的临床问题。
过去10余年,地西他滨(DAC)在骨髓增生异常综合征(MDS)患者的治疗中显示出良好的疗效[5]。研究表明,DAC 与Ara⁃C、阿克拉霉素(Acla)、粒细胞集落刺激因子(G⁃CSF)组成的DCAG 方案对复发难治AML患者具有一定疗效[6]。此外,含中等剂量Ara⁃C 的方案如IA3+3 方案、CLAG(克拉曲滨,Ara⁃C、G⁃CSF)方案对AML 患者亦显示出一定疗效[7]。然而,DCAG 方案作为AML 再诱导治疗的疗效尚未得到证实。本研究比较了DCAG 方案与另外两种化疗方案治疗首疗程标准诱导化疗失败AML 患者的疗效和安全性。
1 资料与方法
1.1 一般资料回顾性分析2015年5月至2018年5月在南方医科大学南方医院就诊的初诊AML 患者(急性早幼粒细胞白血病除外)。纳入标准为:(1)根据WHO 标准新诊断的AML(包含骨髓增生异常综合征进展为AML 患者);(2)年龄在14 岁至65 岁之间;(3)首疗程标准诱导化疗后评估疗效为未缓解(no remission,NR)。此研究均获得患者知情同意,并经我院医学伦理委员会批准[2018年(审)104 号)。
1.2 诊断标准及治疗反应评估AML 的诊断及疗效评价基于骨髓形态学、免疫表型、细胞遗传学和(或)分子生物学检查,根据NCCN 指南(2021年版)对AML 患者进行分层[1]。
1.3 治疗方法在标准诱导化疗[柔红霉素(DNR)45 mg/(m2·d)或去甲氧柔红霉素(IDA)10 mg/(m2·d),d1⁃3;Ara⁃C 100 mg/(m2·d),d1⁃7]结束后,根据NR患者的年龄、一般体能状况、合并症、治疗意愿等综合因素选择3 种再诱导方案之一:(1)DCAG 组[DAC 20 mg/(m2·d)d1⁃5,Ara⁃C 10 mg/(m2·d)d1⁃14,Acla 20 mg/(m2·d)d1⁃5,G⁃CSF 300 μg/d d4⁃14,WBC>20 G/L 时停用];(2)IA3+7 组[IDA 10 mg/(m2·d)d1⁃3;Ara⁃C 100 mg/(m2·d)d1⁃7];(3)IDCB组,包括IA3+3 方案、CLAG 方案。IA3+3 方案[IDA 10 mg/(m2·d)d1⁃3;Ara⁃C 2 g/(m2·d),d1⁃3,q12h];CLAG 方案[克拉曲滨5 mg/(m2·d),d1⁃5;Ara⁃C 2 g/(m2·d)d1⁃5;G⁃CSF 300 μg/d d1⁃5,WBC>20 G/L 时停用]。
1.4 疗效评估标准及随访总体生存率(OS)定义为从AML 确诊之日起至死亡,并对存活患者进行至少2年的随访;无复发生存(RFS)定义为完全缓解(CR)至复发或非复发死亡。从未获得缓解的移植患者则将移植后第1 天疾病状态定义为CR。
1.5 统计学方法采用SPSS 23.0 软件进行统计分析。计量资料的组间比较,符合正态分布资料采用单因素方差分析或t检验,非正态资料使用Kruskal⁃WallisH检验或Mann⁃WhitneyU检验;计数资料采用χ2检验或Fisher 精确概率法进行差异性分析,检验水准α=0.05。生存分析使用Kaplan⁃Meier 法。
2 结果
2.1 一般情况研究共纳入84例首疗程标准诱导化疗失败的AML 患者,其分布及临床特点见图1及表1。DCAG 组,1 例失访,24 例患者接受后续治疗,其中移植14 例,11 例移植前CR,3 例NR,10 例仅接受巩固化疗。IA3+7 组中,1 例失访,29 例患者接受后续治疗,其中移植18 例,13 例移植前CR,5 例NR,11 例仅接受巩固化疗。IDCB 组中,2例失访,27例患者接受后续治疗,其中移植15例,9 例移植前CR,6 例NR,12 例仅接受化疗(图1)。
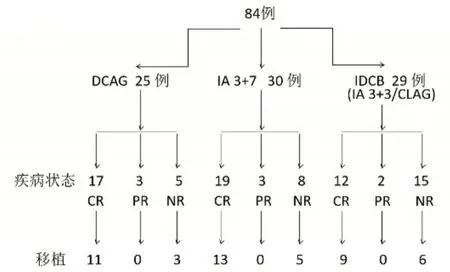
图1 84 例首疗程标准诱导化疗失败AML 患者再诱导治疗疗效及后续治疗Fig.1 Efficacy of reinduction therapy and subsequent treatment in 84 AML patients who failed the first course of standard induction chemotherapy
表1 首疗程标准诱导化疗失败AML 患者基本特征Tab.1 Characteristics of AML patients who failed the first course of standard induction chemotherapy ±s
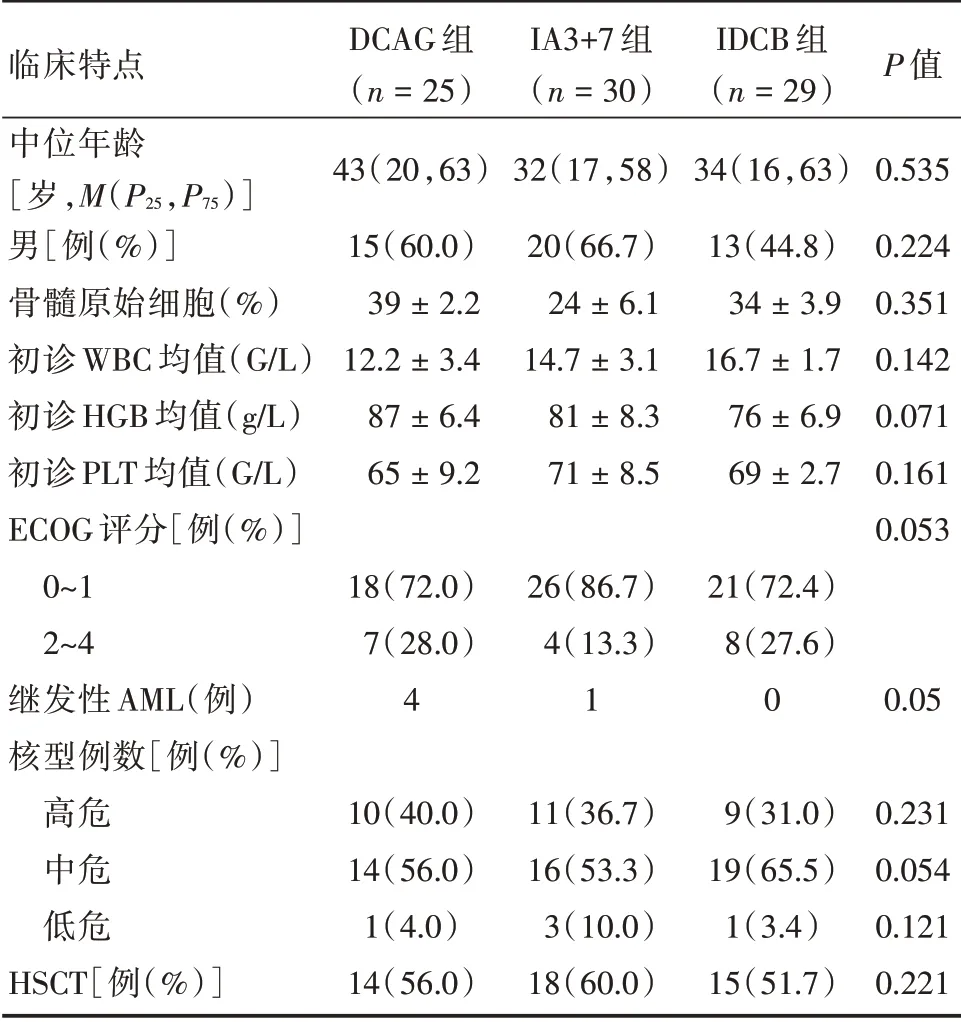
表1 首疗程标准诱导化疗失败AML 患者基本特征Tab.1 Characteristics of AML patients who failed the first course of standard induction chemotherapy ±s
临床特点中位年龄[岁,M(P25,P75)]男[例(%)]骨髓原始细胞(%)初诊WBC 均值(G/L)初诊HGB 均值(g/L)初诊PLT 均值(G/L)ECOG 评分[例(%)]0~1 2~4继发性AML(例)核型例数[例(%)]高危中危低危HSCT[例(%)]DCAG 组(n=25)43(20,63)15(60.0)39±2.2 12.2±3.4 87±6.4 65±9.2 18(72.0)7(28.0)4 10(40.0)14(56.0)1(4.0)14(56.0)IA3+7 组(n=30)32(17,58)20(66.7)24±6.1 14.7±3.1 81±8.3 71±8.5 26(86.7)4(13.3)1 11(36.7)16(53.3)3(10.0)18(60.0)IDCB 组(n=29)34(16,63)13(44.8)34±3.9 16.7±1.7 76±6.9 69±2.7 21(72.4)8(27.6)0 9(31.0)19(65.5)1(3.4)15(51.7)P 值0.535 0.224 0.351 0.142 0.071 0.161 0.053 0.05 0.231 0.054 0.121 0.221
2.2 治疗反应与生存84 例患者中,DCAG 组17例(68.0%)、IA3+7 组19 例(63.3%)、IDCB 组12 例(41.4%)患者获得CR,3 组间CR 率差异无统计学意义(P=0.091)。再诱导治疗后DCAG 组OR 率高于IDCB组(80.0%vs.48.3%,P=0.049),DCAG组和IA3+7 方案组的OR 差异无统计学意义(80.0%vs.73.3%,P=0.170,表2)。
2.3 不良反应84 例患者均出现骨髓抑制。DCAG 组PLT <20 G/L 中位持续时间短于IA3+7 组(10 dvs.12 d,P= 0.001)及IDCB 组(10 dvs.14 d,P= 0.023,表2)。3 组粒缺中位持续时间分别为9 d、11.5 d、12 d,差异无统计学意义(P= 0.061)。DCAG 组、IA3+7 组、IDCB 组肺部感染率分别为84.0%、86.7%、86.2%,DCAG 组肺部感染率低于IA3+7方案组(P=0.018),与IDCB组差异无统计学意义(P=0.061)。DCAG组、IA3+7组、IDCB组中性粒细胞缺乏伴发热的发生率分别为60.0%、83.3%、65.5%,DCAG组明显低于IA3+7方案组(P=0.004),与IDCB 组相比差异无统计学意义(P= 0.190)。3 组非血液学毒性轻微,转氨酶升高发生率组间差异无统计学意义(P=0.224)。DCAG 组及IA3+7组无患者死于化疗相关毒性,IDCB 组有2 例死亡(1例死于急性心功能不全,1例死于重症肺炎)。

表2 首疗程标准诱导化疗失败AML 患者不同再诱导情况Tab.2 Different reinduction conditions of AML patients who failed the first course of standard induction chemotherapy M(P25,P75)
2.4 生存分析随访截止至2020年6月30日,中位随访时间13.5 个月(3 ~ 61 个月)。3 组间2年OS 率差异有统计学意义(P=0.031),DCAG 组2年OS率明显高于IA3+7组(69.4%vs.43.8%,P=0.038)及IDCB 组(69.4%vs.33.2%,P= 0.023,图2A),IA3+7 组与IDCB 组OS 差异无统计学意义(P=0.670)。再诱导治疗后CR 及接受移植的患者,DCAG 组、IA3+7 组、IDCB 组的2年RFS 分别为70.6%(95%CI:67.6% ~ 73.6%)、50.3%(95%CI:47.7% ~ 52.9%)、41.4%(95%CI:40.7% ~ 42.1%),DCAG 组2年RFS 明显高于IA3+7 组(P= 0.048)及IDCB组(P=0.016),IA3+7组与IDCB组间差异无统计学意义(P= 0.622,图2B)。接受移植的患者,DCAG 组、IA3+7 组、IDCB 组2年生存分别为83.2%(95%CI:80.6%~85.8%)、71.3%(95%CI:68.7%~73.9%)、43.6%(95%CI:41.3%~45.9%),3 组间差异无统计学意义(P=0.064,图2C)。

图2 各组生存分析结果Fig.2 Survival analysis in each group
3 讨论
IA3+7方案为AML标准诱导治疗方案。20%~50%的患者接受标准诱导化疗后不能达到CR[8-9]。不同再诱导化疗方案疗效差异较大[8],原IA3+7 方案再诱导化疗的CR 率仅40% ~ 50%[10],老年患者缓解率更低[11],而且缓解持续时间短,治疗相关不良反应多;含大剂量Ara⁃C 的强化化疗方案可能会因药物相关毒性而带来较大的副作用[12]或不能获得令人满意的总体生存[13]。因此,临床工作中迫切需要能够改善标准诱导化疗失败患者预后的安全、有效的治疗方案。
随着表观遗传学研究的深入及白血病相关基因检测的开展,研究发现DNA 甲基化参与了AML的发生发展,而去甲基化可使基因重新活化[14]。DAC 是甲基化转移酶抑制剂,可活化沉默的抑癌基因,达到治疗肿瘤的目的[15]。多中心研究表明,DAC 单药治疗AML 有效,CR 率偏低[16-18]。其抗白血病效应发生在细胞周期特异性S 期,仅对处于细胞生长期的白血病细胞起作用。研究表明,DAC 和Ara⁃C 在体外对人白血病细胞株的细胞杀伤起协同或累加作用,且DAC 的去甲基化作用可使难治耐药的ALL 患者对Ara⁃C 敏感。这些均表明DAC 联合Ara⁃C 治疗AML 有较好的临床前景。G⁃CSF 可诱导白血病细胞分化,促进G0 期细胞进入细胞增殖周期,增加了化疗药物对白血病细胞的杀伤能力。YAMADA[19]首次报道用CAG 方案治疗复发、难治和老年AML,在临床上取得了满意疗效,使得该方案在标准诱导化疗失败患者中应用提供了可能。
本研究比较了首疗程标准治疗失败的AML 患者采用DCAG、IA3+7 及IDCB 方案治疗的疗效及安全性。分析表明,3 组的基线资料差异无统计学意义,DCAG 组患者CR 率为68%,OR 率为80%,高于IDCB 组OR率,与既往研究大致相同[20-21]。生存分析表明,DCAG 组2年生存率及RFS 率显著高于IDCB组及IA3+7 组,表明DCAG 方案治疗能给首疗程诱导化疗失败的AML 患者带来明显生存获益及缓解率。与IA3+7 方案和IDCB 方案相比,DCAG 方案的血液学和非血液学毒性较小,化疗后骨髓抑制期血小板恢复时间更短。既往有研究表明,获得CR 的AML 患者中,诱导化疗开始后28 d 血小板恢复较快或血小板计数较高≥500 × 109/L 与更好的无病生存和总生存相关[22-23]。机制上,DAC 通过促进巨核细胞的分化和成熟来促进血小板的产生,加速血小板的恢复[24-25]。DAC 诱导化疗后血小板计数的早期恢复被认为是AML[26]可作为患者较好预后的预测标志,本研究结果显示DCAG 组患者血小板恢复时间最短,总生存及无病生存优于其他两组,同样支持此结论。本研究3 组患者非DCAG 组粒缺伴发热、肺部感染发生率与刘英等[27]人的研究结果相似,低于IA3+7 组,且非血液学毒性轻微,表明DCAG 治疗方案安全性良好。
综上所述,地西他滨联合预激方案治疗首疗程标准诱导化疗失败AML 患者,可获得较好的疗效及安全性,延长生存时间,是标准诱导化疗失败的AML 患者理想的再诱导治疗方案。此研究的局限性在于单中心回顾性研究,需前瞻性、随机性、更多样本量、多中心、长期随访的临床研究进行验证。
