恩替卡韦联合或序贯聚乙二醇干扰素-2b对慢性乙型病毒性肝炎核苷经治患者的疗效及安全性分析
2021-08-05许烂漫朱垠徐洁蔡超毛书奇龚凌雯陈婉婷吴昊汪志军陈永平
许烂漫,朱垠,徐洁,蔡超,毛书奇,龚凌雯,陈婉婷,吴昊,汪志军,陈永平
随着乙型肝炎(乙肝)疫苗的普及,乙肝病毒感染率已较前明显下降,但我国仍是慢性乙型病毒性肝炎(CHB)高发区[1]。乙肝病毒感染导致慢性持续肝脏损伤和纤维化,并进一步发展为肝硬化及肝癌。目前临床上一线口服抗病毒药物有核苷及核苷酸类似物(NAs),可快速有效抑制乙肝病毒(HBV)DNA合成,但面临难以清除乙肝病毒环状DNA(cccDNA)及乙肝病毒表面抗原(HBsAg),难以停药、停药后复发率高、复发后病情加重及耐药、药物不良反应等困扰。近年来,关于NAs经治患者联合或序贯聚乙二醇干扰素(PegIFN)-2b、进一步清除cccDNA、下降HBsAg、实现多靶点免疫控制的观点正逐步被广大学者所接受;但如何联合或序贯及相应的疗程、适用指征等均需进一步研究。笔者通过观察恩替卡韦(ETV)联合、序贯PegIFN-2b治疗对核苷经治CHB患者的临床疗效及安全性,探寻其临床预测价值,为不同CHB患者个体化抗病毒治疗方案提供临床实践依据。现将结果报道如下。
1 资料与方法
1.1 一般资料 收集2016年1月至2019年12月温州医科大学附属第一医院CHB患者65例。入组标准:均符合参考文献[2]诊断标准;年龄18~65周岁;使用NAs治疗至少1年以上;HBV DNA<1 000 copies/ml;HBsAg阳性且HBsAg<3 000 IU/ml;影像学提示无肝硬化。排除标准:妊娠或哺乳期妇女;6个月内接受过抗肿瘤或免疫调节治疗;合并其他肝炎病毒感染和/或人类免疫缺陷病毒(HIV)感染;丙氨酸氨基转移酶(ALT)≥10倍正常上限,合并其他慢性肝病如血色病、自身免疫性肝病、代谢性肝病、酒精性肝病等;合并肿瘤;中性粒细胞计数<1.5×109/L,或血小板计数<90×109/L;磷<0.65 mmol/L;抗核抗体(ANA)>1∶100,存在自身免疫性疾病如红斑狼疮等;有抑郁等精神病史;癫痫发作史;严重心肺肾功能不全者;药物控制欠佳的甲状腺疾病病史;严重视网膜病变者。
1.2 入组和随访 本研究共入选CHB患者65例,分3个治疗组:ETV组,即ETV单药治疗72周;序贯组,即ETV与PegIFN-2b联合治疗12周后,序贯PegIFN-2b单药治疗36周后停药,随访24周;联合组,即在ETV治疗基础上,加用PegIFN-2b联合抗病毒48周,随访24周。治疗和随访期间如出现病毒学反跳则加用或换用一线口服抗病毒药物,如替诺福韦等。本研究通过了温州医科大学附属第一医院伦理委员会审查(临床研究伦理[2016]第[017]号),每例患者均签署知情同意书。
1.3 观察指标 3组患者分别在0、24、48、72周进行相关临床指标检测和血液标本的留取。主要研究指标为72周HBsAg阴转率,次要观察指标为不同随访点HBsAg水平和HBsAg水平下降幅度、HBsAg血清学转换率、药物不良反应、不同基线HBsAg水平对HBsAg下降情况及阴转率的影响等。
1.4 统计方法 采用SPSS 19.0统计软件进行统计学处理,计量资料采用均数±标准差表示,不同组间及组内不同时间点数据比较采用重复测量方差分析;计数资料采用2检验,如理论个数小于1,则采用似然比2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 本研究最初纳入77例CHB患者,其中进一步筛选失败4例,出国失访2例,因不良反应退出研究5例,中途要求妊娠退出1例;最后纳入统计病例65例,分别为ETV组24例,序贯组21例,联合组20例。3组入组时一般资料差异均无统计学意义(均P>0.05)。见表1。
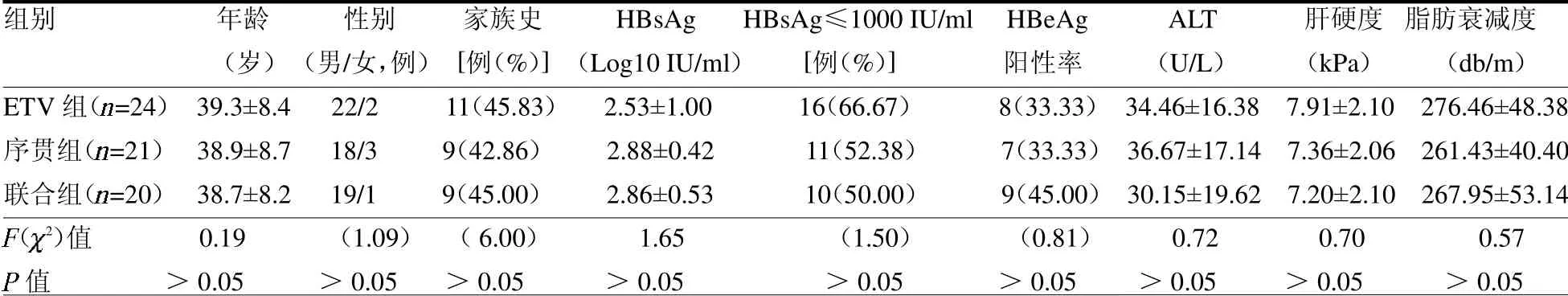
表1 3组一般资料比较
2.2 各组不同时间点HBsAg下降水平比较 ETV组24、48、72周HBsAg水平与基线值相比,差异均无统计学意义(均P>0.05),而序贯组和联合组在24周均显著低于基线值(均P<0.05),其中联合组下降与ETV组、序贯组相比,差异均有统计学意义(均P<0.05)。72周时,联合组HBsAg水平与ETV组、序贯组差异均有统计学意义(均P<0.05)。见表2。

表2 3组不同时间点HBsAg变化
2.3 各组不同时间点HBsAg阴转率及血清学转换率比较 ETV组24、48、72周HBsAg阴转率为0,即无一例出现HBsAg阴转。序贯组在24、48、72周HBsAg阴转率分别为0、9.5%(2/21)、9.5%(2/21),联合组为10.0%(2/20)、15.0%(3/20)、25.0%(5/20)。序贯组24、48、72周HBsAg血清学转换率分别为0%、4.8%(1/21)、4.8%(1/21),联合组24、48、72周HBsAg血清学转换率分别为10.0%(2/20)、15.0%(3/20)、20.0%(4/20)。72周时,联合组HBsAg阴转率、HBsAg血清学转换率均高于ETV组(2=8.67、6.80,均P<0.05),而序贯组与ETV组差异均无统计学意义(2=3.16、1.55,均P>0.05)。72周时,联合组HBsAg阴转率、HBsAg血清学转换率均高于序贯组,但差异无统计学意义(2=1.73、2.35,均P>0.05)。见图1。
2.4 联合组不同HBsAg基线水平对HBsAg下降及阴转率影响 将ETV与PegIFN-2b联合组根据基线HBsAg水平分为两组:HBsAg≤1 000 IU/ml组(10例),HBsAg>1 000 IU/ml组(10例)。HBsAg≤1 000 IU/ml组24、48、72周HBsAg阴转率分别为20.0%(2例)、20.0%(2例)、40.0%(4例),而HBsAg>1000 IU/ml组72周时仅1例(10%)阴转,但两组差异均无统计学意义(2≤3.00,均P>0.05)。HBsAg≤1000 IU/ml组至48周时,HBsAg≤10 IU/ml的患者比例与HBsAg>1000 IU/ml组相比[70.0%(7例)vs 10.0%(1例)]差异有统计学意义(2=8.20,P<0.05)。见图2。
2.5 各组不良反应发生率及安全性治疗期间,5例患者(未纳入统计)出现较严重不良反应,主要为粒细胞缺乏(2例)、蛋白尿(1例)、甲状腺功能亢进(1例)、眼底病变(1例),上述病例通过停药及对症处理后均能好转恢复。3组病例在48周治疗过程中,除ETV组不良反应较少外,序贯组和联合组都存在一定比例的常见不良反应,且两组差异均无统计学意义(均P>0.05),大多数患者均能耐受药物不良反应。治疗48周时,序贯组出现病毒学突破发生率为14.3%(3例),而联合组无一例发生,两组差异有统计学意义(P<0.05)。见表3。

表3 各组治疗48周不良反应发生率及病毒学突破率 例(%)
3 讨论
“临床治愈”是慢乙肝抗病毒治疗理想终点[2-3],即停药后血清HBsAg阴性,伴或不伴乙肝表面抗体(HBsAb)出现,HBVDNA持续检测不到,肝脏炎症和组织病理学改善。NAs可强效抑制HBV复制,但无法清除cccDNA,难以实现HBsAg的阴转和持久的免疫学控制,且停药后复发率高[4];干扰素则通过增强体内免疫细胞功能、激活下游抗病毒信号通路,发挥免疫调节和抗病毒功效,可实现较高的血清学应答率和持久的免疫学控制。以往的研究提示NAs和干扰素联合治疗可显著提高HBsAg下降幅度及阴转率[5],但上述两类药物如何序贯、联合,如何选择合适的时机和优势人群,仍需要进一步研究探索。
本研究通过随机入组NAs经治HBsAg<3 000 IU/ml的CHB患者,发现与ETV组相比,序贯或联合组在24周即出现HBsAg水平显著降低,提示CHB患者在长期NAs抗病毒基础上,无论是序贯或联合干扰素,都可以协同加强抗病毒疗效;在72周时,联合组HBsAg水平、HBsAg阴转率及血清学转换率均显著高于ETV组(均P<0.05),而序贯组与ETV组差异无统计学意义,提示多靶点联合治疗更有利于HBV的免疫学控制。国内有学者纳入NAs经治1年以上HBsAg≤1 500 IU/ml的CHB患者,结果表明干扰素联合NAs显著增加了48周时HBsAg阴转率,选择合适的患者联合多靶点干预有望实现更高比例的“临床治愈”[6],这与本研究结果相符。
CHB患者均存在免疫细胞功能和数量的缺陷,而NAs对病毒的长期抑制可部分恢复CHB患者体内免疫细胞功能,从而有利于PegIFN更好地发挥免疫调节和抗病毒疗效[7-8],为NAs经治获得一定免疫学控制基础上再联合干扰素治疗提供了理论依据,但最佳干预的基线HBsAg水平尚无明确定论。本研究发现基线HBsAg≤1 000 IU/ml组48周HBsAg(≤10 IU/ml)低水平比例(70%vs 10%)明显高于HBsAg>1 000 IU/ml组(P<0.05)。72周HBsAg阴转率也高于HBsAg>1000 IU/ml组(40%vs 10%)。上述结果提示HBsAg基线水平是评估HBsAg能否阴转的重要参考指标,HBsAg≤1 000 IU/ml可能是给予联合多靶点免疫控制的优选条件之一,其中低水平HBsAg患者比例(≤10 IU/ml)在48周时高达70%,适当延长疗程有望获得更高的临床治愈率。
本研究中ETV组不良反应少,序贯组和联合组发生的较为严重不良反应主要有粒细胞缺乏、蛋白尿、甲状腺功能亢进、眼底病变,均退出研究并通过停药对症处理后恢复;发热、白细胞和血小板减少、ALT升高也是常见不良反应。另外还要注意精神改变等情况。序贯组由于停用NAs,存在一定的病毒升高风险(14.3%),需监测HBV DNA。
