人工肝支持系统与糖皮质激素治疗重度急性药物性肝损伤的疗效
2021-08-04刘师伟梁静唐飞刘华刘磊刘芳王凤梅
刘师伟 ,梁静 ,唐飞,刘华 ,刘磊,刘芳 ,王凤梅 1,△
药物性肝损伤(drug-induced liver injury,DILI)的发病率近年呈不断上升趋势。其作为最常见和最严重的药物不良反应之一,轻者仅表现为肝功能指标异常,但重度急性DILI 会导致肝细胞大量坏死,极易引发急性肝功能衰竭(acute liver failure,ALF),病死率较高,容易被误诊和漏诊,这也是药物肝毒性临床监测中应该引起重视的问题[1-2]。目前尚缺乏简便、客观、特异的DILI诊断指标和特效治疗手段。对于重度DILI 的治疗,尤其是胆汁淤积型或者常规内科综合治疗效果不佳的患者,可根据其具体情况给予人工肝支持系统(artificial liver support system,ALSS)或糖皮质激素治疗[3-5]。目前尚缺乏ALSS 与糖皮质激素治疗重度急性DILI 的临床疗效及安全性的对比研究。本研究对重度急性DILI 患者的相关临床数据进行分析,评估两种疗法的临床疗效和安全性,以期为重度急性DILI 的临床诊治提供科学依据。
1 对象与方法
1.1 研究对象 回顾性纳入天津市第三中心医院肝内科2013 年 8 月—2019 年 12 月收治住院的 120 例重度急性 DILI患者为研究对象。住院期间患者分别采用人工肝支持治疗或糖皮质激素治疗。纳入标准:(1)符合《药物性肝损伤诊治指南》中重度肝损伤的诊断标准,即血清丙氨酸转氨酶(ALT)和(或)碱性磷酸酶(ALP)升高,总胆红素(TBIL)≥5倍正常上限(85.5 μmol/L),伴或不伴凝血酶原时间国际标准化比值(INR)≥1.5[6]。(2)药物性肝损伤因果关系评分量表(RUCAM)评分均大于6分[6]。(3)ALSS 的适应证和治疗方式参照《肝衰竭诊治指南》及《非生物型人工肝治疗肝衰竭指南》[7-8]。(4)糖皮质激素治疗的适应证参照《药物性肝损伤诊治指南》[6]。排除标准:(1)感染性肝病及合并酒精性、自身免疫性或其他非药物性肝病。(2)恶性肿瘤、结核、感染、胃肠道溃疡及出血倾向、骨质疏松、糖尿病、高血压患者。根据治疗方法将患者分为ALSS 组和激素组,2 组患者年龄、性别及药物性肝损伤程度差异无统计学意义,见表1。药物性肝损伤程度分级参照《药物性肝损伤诊治指南》[6]。
1.2 常规内科基础治疗 2 组患者入院后均接受DILI 常规内科基础治疗,治疗方案包括停用导致肝损伤的药物,给予谷胱甘肽、异甘草酸镁、双环醇、熊去氧胆酸等药物进行保肝治疗,针对并发症积极对症治疗。
1.3 ALSS 治疗 ALSS 组患者在上述常规内科治疗的基础上同时给予人工肝血浆置换或血浆灌流方式(旭化成血液净化装置OP08或IQ21型号)。每例患者根据病情需要进行2~5次人工肝治疗,每次间隔3~4 d,ALSS组60例患者共行人工肝治疗452次,平均7.5次/人,平均治疗4周。
1.4 糖皮质激素治疗 激素组患者在常规治疗基础上加用糖皮质激素治疗。治疗方案为静脉滴注甲泼尼龙(商品名:米乐松,注射用甲泼尼龙琥珀酸钠;规格:40 mg/瓶,国药集团容生制药有限公司)40~60 mg/d,5~7 d 后改为口服甲泼尼龙片(商品名:尤金;规格:4 mg/片,天津天药药业股份有限公司)40 mg/d,每5~7 d减量4 mg,治疗4周。
1.5 观察指标 观察2组患者治疗1、2、3周后各项指标的变化:(1)肝功能指标。ALT、天冬氨酸转氨酶(AST)、总胆汁酸(TBA)、TBIL 及凝血酶原活动度(PTA)。(2)治疗中不良反应及并发症。
1.6 临床疗效判定 临床疗效参照《药物性肝损伤诊治指南》并结合患者临床症状及相关实验室指标综合判断[6]。显效:典型临床症状明显改善,肝功能指标水平较治疗前恢复超过1/2,DILI分级与治疗前相比下降2级或以上;有效:典型临床症状好转,肝功能指标水平较治疗前恢复超过1/3,DILI分级与治疗前相比下降1级或以上;无效:典型临床症状无明显改善,肝功能指标无明显改善或肝功能进一步恶化。其中,因入院后治疗效果不佳进行肝移植、入院后经积极治疗但病情恶化而家属要求自动出院放弃治疗者、死亡患者也归入无效。总有效率=(显效病例数+有效病例数)/总病例数×100%。
1.7 统计学方法 采用SPSS 25.0 软件进行数据统计分析。计数资料采用例(%)表示,组间比较采用χ2检验;计量资料均进行正态性检验及方差齐性检验,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用重复测量数据的方差分析和独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2 组治疗前后肝功能比较 时间和治疗方法对ALT、AST、TBA、TBIL 和 PTA 水平均有影响(P<0.05),但不存在交互效应(P>0.05)。2组患者治疗1、2、3 周后,ALT、AST、TBA、TBIL 均较治疗前显著降低,PTA显著上升(P<0.05)。ALSS组治疗1、2、3周后 ALT、AST、TBA、TBIL 和 PTA 的改善程度较激素组更为显著(P<0.05),见表2。
2.2 临床疗效 ALSS 组总有效率显著高于激素组(χ2=5.175,P<0.05),见表3。
2.3 临床安全性分析 ALSS 组发生血浆过敏反应3例(5.0%)、手足口唇麻木6例(10.0%)、导管相关感染1例(1.7%)、血压下降3例(5.0%),合计不良反应发生率为21.7%;激素组胃肠道出血3 例(5.0%)、血糖升高4例(6.7%)、低钾血症2例(3.3%)、踝部浮肿5例(8.3%),合计不良反应发生率为23.3%。
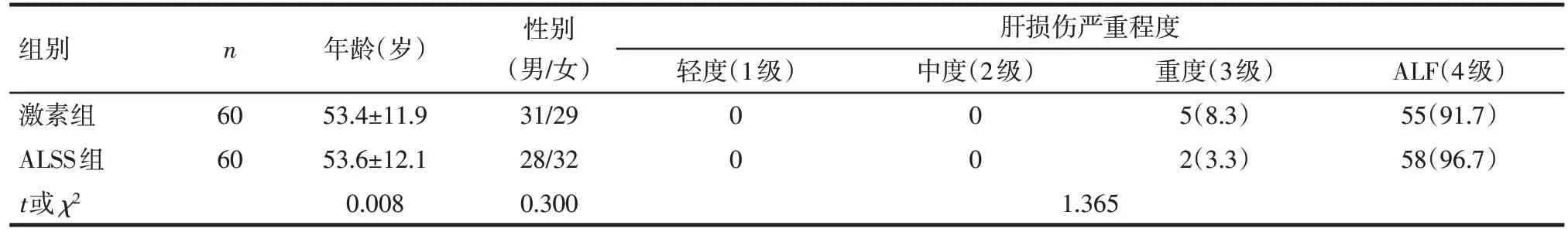
Tab.1 Comparison of clinical data between the two groups of patients表1 2组患者临床资料比较
Tab.2 Comparison of the biochemical indicators of liver function before and after treatment between the two groups of patients表2 2组患者治疗前后肝功能生化指标比较 (n=60,±s)
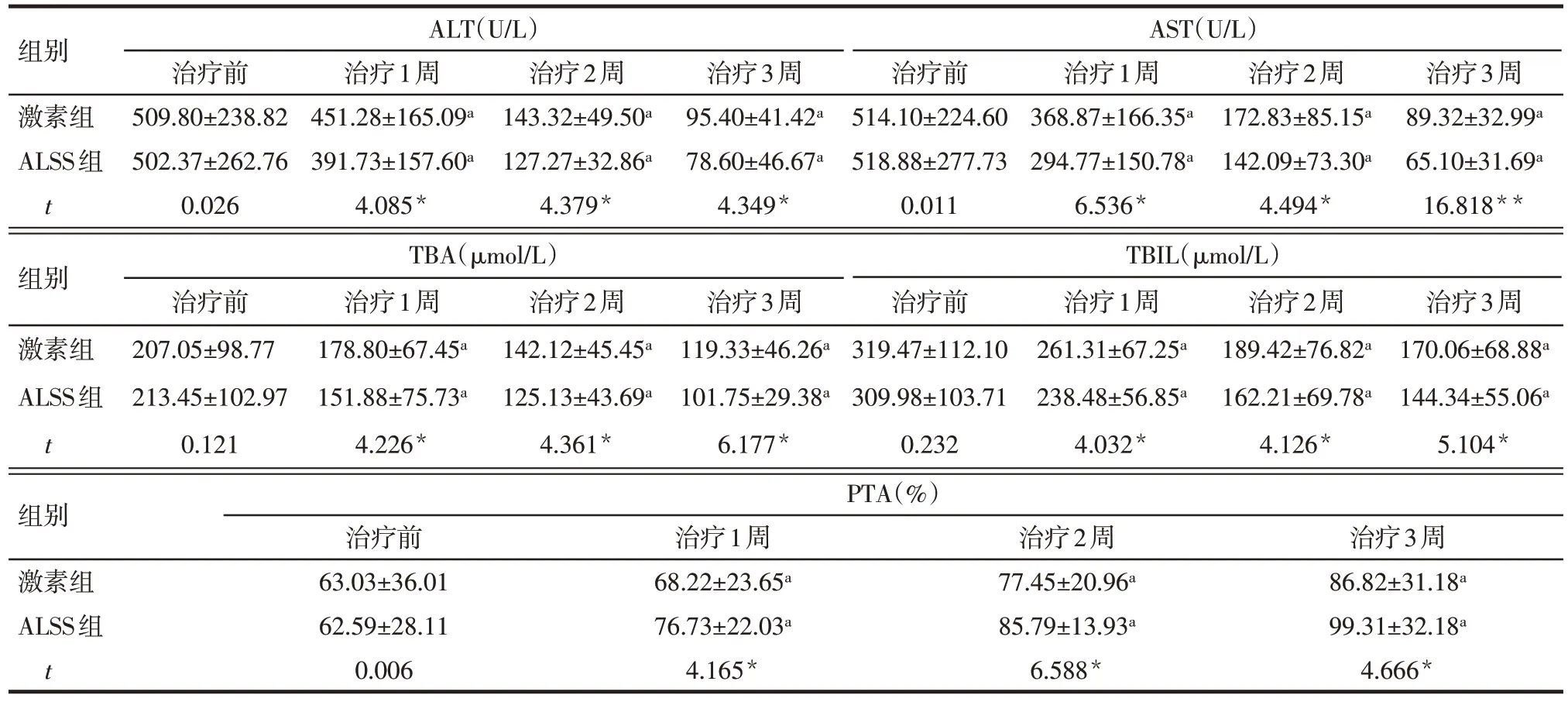
Tab.2 Comparison of the biochemical indicators of liver function before and after treatment between the two groups of patients表2 2组患者治疗前后肝功能生化指标比较 (n=60,±s)
*P<0.05,**P<0.01;a与治疗前比较,P<0.05;ALT:F组间=7.955**,F时间=412.407**,F交互=1.956;AST:F组间=14.896**,F时间=190.225**,F交互=2.063;TBA:F组间=13.875**,F时间=30.761**,F交互=0.614;TBIL:F组间=10.041**,F时间=77.618**,F交互=0.040;PTA:F组间=10.081**,F时间=25.836**,F交互=0.335
组别ALT(U/L)AST(U/L)治疗前 治疗1周 治疗2周 治疗3周 治疗前 治疗1周 治疗2周 治疗3周激素组509.80±238.82451.28±165.09a143.32±49.50a95.40±41.42a514.10±224.60368.87±166.35a172.83±85.15a89.32±32.99a ALSS组502.37±262.76391.73±157.60a127.27±32.86a78.60±46.67a518.88±277.73294.77±150.78a142.09±73.30a65.10±31.69a t 0.0264.085*4.379*4.349*0.0116.536*4.494*16.818**组别TBA(μmol/L)TBIL(μmol/L)治疗前 治疗1周 治疗2周 治疗3周 治疗前 治疗1周 治疗2周 治疗3周激素组207.05±98.77178.80±67.45a142.12±45.45a119.33±46.26a319.47±112.10261.31±67.25a189.42±76.82a170.06±68.88a ALSS组213.45±102.97151.88±75.73a125.13±43.69a101.75±29.38a309.98±103.71238.48±56.85a162.21±69.78a144.34±55.06a t 0.1214.226*4.361*6.177*0.2324.032*4.126*5.104*组别PTA(%)治疗前 治疗1周 治疗2周 治疗3周激素组63.03±36.0168.22±23.65a77.45±20.96a86.82±31.18a ALSS组62.59±28.1176.73±22.03a85.79±13.93a99.31±32.18a t 0.0064.165*6.588*4.666*

Tab.3 Comparison of clinical efficacy between the two treatment methods表3 2种治疗方法临床疗效比较 (n=60)
3 讨论
随着近年各类新药的不断上市以及中草药、保健品、膳食补充剂的出现,DILI及药物性肝衰竭的发病率逐年增高。目前,在我国引起肝损伤的主要药物为中草药和膳食补充剂(26.81%),且多以胆汁淤积型为主[9]。但由于DILI 缺乏特异性诊断标志物,病理形态学表现多样,如果不及时治疗,病情进展迅速,并发症多,病死率极高[10]。ALSS 是一种基本的血液净化治疗方法,包括血液透析滤过、血浆置换、胆红素吸附、分子吸附循环系统等,通过体外机械、化学或生物装置暂时取代肝脏功能来治疗肝病。ALSS在重症DILI患者治疗中具有重要价值,可创造一系列内环境条件,促进肝细胞再生、肝功能恢复,帮助患者度过危险期,提高生存率[11]。糖皮质激素治疗重症DILI 的主要机制为稳定溶酶体膜,减轻门脉区和毛细胆管的非特异性炎症,利于胆汁的排泌,改善全身毒性反应,阻止抗原抗体复合物产生,减少肝细胞免疫损伤[12]。欧洲肝病学会(EASL)指南中指出在药物诱导胆汁淤积性肝病的治疗中可考虑使用糖皮质激素,尤其是有免疫高敏感性证据者,要密切关注其相关不良反应[13]。但是,目前尚缺少2 种治疗方案的疗效和安全性对比研究。
本研究结果显示,治疗后2 组患者肝功能指标如ALT、AST、TBA、TBIL均明显降低,PTA明显升高。治疗1、2、3 周后ALSS 组ALT、AST、TBA、TBIL 等指标改善程度较激素组更为显著,提示常规内科综合治疗联合ALSS 可快速有效改善重症DILI 患者的临床症状,预后较好。这可能与ALSS 用于重症DILI治疗优势有关:(1)通过体外装置,利用滤过和吸附等技术清除肝脏代谢所产生的有害物质,缓解病情。(2)可补充相关活性物质(如血浆蛋白)改善机体内环境,促进肝细胞再生和肝功能恢复,提高生存率。(3)ALSS 减轻了肝脏解毒的负担,避免其他消化器官、组织的继发性受损或多脏器衰竭的出现[14-16]。此外,本研究通过2 种疗法的对比发现,ALSS 组总有效率为95.0%,不良反应发生率为21.7%;激素组的总有效率为81.7%,不良反应发生率为23.3%。激素作为目前应用最为广泛的抗炎和免疫抑制剂,治疗重症DILI 有一定疗效,至于用药时机、种类和剂量的选择还需要继续探究。ALSS 治疗和激素治疗的相关不良反应均较轻微,大部分可在一定时间内自行缓解,少数患者在对症处理后可有效缓解,无后遗症,2 种疗法均无明显不良反应发生,安全性较高。本研究显示,在常规内科方案基础上实施ALSS治疗重症肝病效果显著,可有效改善患者预后,缩短症状消失时间,加速肝功能改善,且无明显不良反应,与国内魏丽艳[17]报道一致。
综上,ALSS及激素治疗均能有效改善重症DILI患者的临床症状及生化指标,ALSS较糖皮质激素可更快速有效改善肝功能,且并发症处于可控范围内,安全性有保障。对于糖皮质激素的使用应严格掌握适应证,并充分权衡治疗收益和可能的不良反应。
