扶肾方对尿毒症腹膜透析大鼠腹膜超滤功能及VEGF-Notch信号通路的影响
2021-08-04杨波王孟孟孙林钟柯李洁杨洪涛
杨波,王孟孟,孙林,钟柯,李洁,杨洪涛△
腹膜透析(peritoneal dialysis,PD)是终末期肾脏病(end stage renal disease,ESRD)患者主要的替代治疗方式之一,其有效性取决于腹膜功能的完整性。由于使用含葡萄糖腹膜透析液,长期PD可致腹膜超滤功能逐渐下降,直至衰竭,最终迫使患者退出PD治疗[1]。因此,明确腹膜超滤衰竭的具体机制,对于提高PD效能具有重要意义。研究表明,腹膜血管新生是引起超滤功能衰竭的重要原因之一[2]。中药复方具有多靶点调控的优势,在抑制腹膜血管新生和防治超滤衰竭方面应用前景良好[3]。本课题组前期研究发现,扶肾方(院内制剂:津药制字Z20130941)可改善尿毒症腹膜透析大鼠超滤功能,这一作用是否与抑制腹膜血管新生有关尚不明确。本研究通过利用5/6肾切除尿毒症大鼠PD模型,探讨扶肾方对尿毒症PD大鼠腹膜超滤功能及腹膜组织Notch1、Delta-样配体4(delta-like ligand 4,Dll4)、Notch胞内域(intracellular domain of Notch,NICD)、Hes1(hairy and enhancer of split homolog-1,Hes1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)及血管内皮生长因子受体-2(vscular endothelial growth factor receptor-2,VEGFR-2)的影响,以期为扶肾方防治PD超滤衰竭提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取50只SPF级雄性SD大鼠,6~8周龄,体质量200~250 g,自由饮水摄食。大鼠购自北京维通利华实验技术有限公司,合格证号:SCXK(京)2016-0006。
1.1.2 实验药物 扶肾方:黄芪15 g、淫羊藿15 g、陈皮10 g、半夏15 g、当归10 g、丹参30 g、鬼箭羽30 g、熟军10 g。上述中药饮片购自天津中医药大学第一附属医院中药房。塞来昔布购自美国辉瑞制药有限公司(批号:J20140072)。1.5%双联腹膜透析液(批号:G19121675)、4.25%双联腹膜透析液(批号:G18082462)均购自广州百特医疗用品有限公司。
1.1.3 主要试剂及仪器DNA/RNA蛋白质共提取试剂盒、反转录试剂盒、荧光定量预混试剂(北京天根生化科技有限公司),BCA蛋白浓度测定试剂盒、4×蛋白上样缓冲液、10×TBST缓冲液、180彩虹广谱蛋白Marker、ECL超敏发光液(北京索莱宝科技有限公司),Notch1、NICD兔多克隆抗体(美国CST公司),Dll4、Hes1、VEGF、VEGFR2、p-VEGFR2兔多克隆抗体,HRP标记羊抗兔IgG二抗(1∶5 000)及内参GAPDH(北京博奥森生物技术有限公司),多功能酶标仪、超微量核酸蛋白测定仪(德国Thermo),电泳仪、快速转膜仪、显影仪(美国Bio-Rad),微量移液器、实时荧光定量PCR(qPCR)仪(德国Eppendorf),-80℃超低温冰箱(青岛海尔股份有限公司)。
1.2 方法
1.2.1 动物分组及造模50只大鼠适应性喂养7 d后,采用随机数表法分为正常组、模型组、扶肾方低剂量组、扶肾方高剂量组、塞来昔布组,每组10只。模型组、扶肾方低剂量组、扶肾方高剂量组、塞来昔布组大鼠行5/6肾脏切除术建立尿毒症模型,大鼠血肌酐较正常组上升2~3倍,提示尿毒症造模成功[4]。造模成功后,以大鼠右下腹靠近腹股沟中点为腹腔注射部位,按每日100 mL/kg,腹腔注射1.5%腹膜透析液,腹腔内保留,不再抽出,注射4周。正常组予以每日生理盐水2 mL灌胃,连续4周。
1.2.2 扶肾方制备 扶肾方药剂经过提取、分离、浓缩、干燥及制粒而成。扶肾方颗粒成人服用剂量为每次18 g,每日2次,根据人和大鼠体表面积折算(折算系数为0.018)得出大鼠等效剂量为0.324 g,每日2次。
1.2.3 实验给药 扶肾方低剂量组每日扶肾方324 g/L,2 mL灌胃;扶肾方高剂量组每日扶肾方648 g/L,2 mL灌胃;塞来昔布组每日塞来昔布溶液1.8 g/L,2 mL灌胃;正常组和模型组每日生理盐水2 mL灌胃。每组均连续灌胃4周。
1.2.4 腹膜超滤功能检测 各组大鼠规律腹腔注射1.5%腹膜透析液4周末,行腹膜平衡实验检测大鼠腹膜超滤功能。腹腔注射4.25%葡萄糖腹膜透析液25 mL,4 h后用5%水合氯醛(6 mL/kg体质量)麻醉大鼠,先抽吸腹腔液体计量,再打开腹腔,收集腹腔内未抽净的液体并计量。超滤量=(纱布吸水后的质量-纱布的质量)×1 mL/g+腹腔抽吸量-腹腔注射量。
1.2.5 标本留取及血肌酐的检测5/6肾切除4周后,从大鼠眶后静脉丛取血,应用7100型日立全自动生化分析仪检测血肌酐(酶法)。规律腹腔注射腹膜透析液4周,腹膜平衡实验计算超滤量后脊椎脱臼法处死大鼠,大鼠仰卧位固定于鼠板,沿腹白线剪开腹壁,于冰盘上取出腹膜组织,一部分于液氮中保存用于qPCR、蛋白免疫印迹实验,其余部分于10%福尔马林中固定用于HE染色。
1.2.6 HE染色观察腹膜形态学变化 取大鼠腹膜组织,常规固定、脱水、石蜡包埋、切片后,行HE染色,光镜下观察大鼠腹膜形态学变化。
1.2.7 qPCR检测Notch1、Dll4、NICD、Hes1、VEGFR-2、VEGF的mRNA水平 按试剂盒说明书从每组腹膜组织中提取总RNA,测定提取RNA纯度,反转录反应合成cDNA,再进行qPCR扩增,引物序列见表1。PCR反应体系:2×SuperReal PreMix Plus 12.5 μL,上、下游引物(10 μmol/L)各0.75 μL,cDNA模板1.5 μL,50×ROX Reference Dye 0.5 μL,加ddH2O至总体系25 μL。反应条件:95℃预变性30 s;95℃变性10 s,60℃退火32 s,40个循环。以β-actin为内参,用2-ΔΔCt法进行数据的相对定量分析。每组选取6个样本,实验重复3次。
1.2.8 蛋白印迹法检测Notch1、Dll4、NICD、Hes1、VEGF、VEGFR-2、p-VEGFR-2蛋白的表达 取腹膜组织150 mg标本加入预冷的RIPA裂解缓冲液,冰浴超声20 min,4℃下12 000 r/min离心10 min后吸取上清液,采用BCA法测定蛋白浓度,将蛋白质加入到4×上样缓冲液中并在95℃下煮沸10 min。通过SDS-PAGE分离等量的蛋白质并印迹到活化的聚偏二氟乙烯膜上。封闭后,将膜与一抗GAPDH(1∶3 000)、Notch1(1∶500)、Dll4(1∶500)、NICD(1∶1 000)、Hes1(1∶1 000)、VEGFR-2(1∶1 000)、p-VEGFR-2(1∶1 000)、VEGF(1∶1 000)在4℃温育过夜。缓冲液洗膜3次,每次10 min,室温下孵育带有HRP标记羊抗兔IgG二抗(1∶5 000)1.5 h,缓冲液洗膜3次,每次10 min。使用化学发光成像系统采集图像,以GAPDH为内参照进行带灰度分析。将目标带与参考带的灰度比值作为蛋白质的相对表达水平,采用Image J v2.1.4.7软件进行图片处理。每组抽取6个样本,实验重复3次。

Tab.1 Primer sequences of qPCR表1 qPCR引物序列
1.3 统计学方法 采用SPSS 22.0软件进行分析。计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,以Levene法进行方差齐性检验;组间多重比较,方差齐采用LSD-t检验,方差不齐采用Games-Howell检验。P<0.05为差异有统计学意义。
2 结果
2.1 尿毒症模型一般情况 造模过程中大鼠死于肾切除术后失血1只,死于感染3只,余36只5/6肾切除大鼠血肌酐水平(77.04±9.11)μmol/L明显高于正常组(28.74±3.73)μmol/L,差异有统计学意义(t=161.180,P<0.05)。
2.2 各组大鼠腹膜超滤量比较 正常组、模型组、扶肾方低剂量组、扶肾方高剂量组及塞来昔布组大鼠腹膜超滤量分别为(3.83±0.57)mL、(-19.01±1.04)mL、(-18.66±0.99)mL、(-14.95±1.59)mL和(-17.38±1.67)mL,差异有统计学意义(F=719.906,P<0.05);与正常组比较,模型组、扶肾方低剂量组、扶肾方高剂量组及塞来昔布组大鼠腹膜超滤量明显下降(P<0.05);与模型组比较,扶肾方低剂量组腹膜超滤量无明显变化(P>0.05),扶肾方高剂量组与塞来昔布组超滤量明显增加(P<0.05);与扶肾方低剂量组比较,扶肾方高剂量组和塞来昔布组超滤量增加(P<0.05);与扶肾方高剂量组比较,塞来昔布组超滤量明显下降(P<0.05)。
2.3各组大鼠腹膜组织HE染色 正常组大鼠腹膜组织较连续和完整,腹膜间皮细胞呈扁平状态,腹膜厚度较薄;模型组腹膜组织明显增厚,部分间皮呈柱形,有大量炎性细胞浸润,可见较多新生的小血管,伴有结缔组织的增生。扶肾方低剂量组、高剂量组腹膜厚度介于正常对照组和模型组之间,血管新生较模型组减少,炎性细胞浸润减轻,可见明显血管淤血;塞来昔布组炎性细胞浸润、腹膜增厚较模型组减轻,与扶肾方高剂量组病理变化相当。见图1。
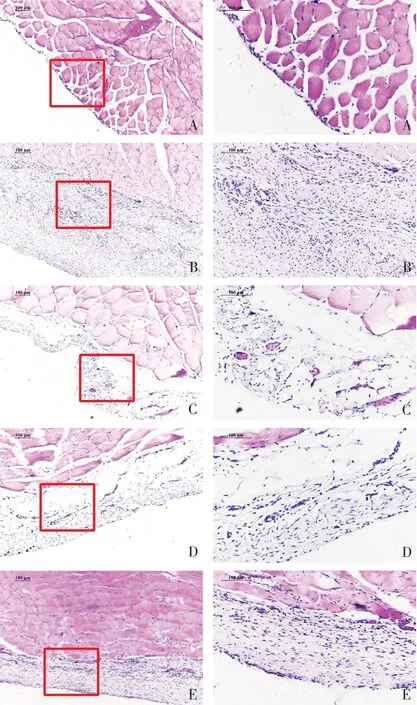
Fig.1 HE staining of peritoneal tissues of rats in the five groups(left×100,right×200)图1各组大鼠腹膜组织HE染色(左×100,右×200)
2.4 各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、VEGFmRNA表达水平比较 与正常组比较,模型组大鼠腹膜组织Notch1、Dll4、NICD、Hes1mRNA表达下调,VEGFR-2、VEGFmRNA表达上调;扶肾方低剂量组Notch1、NICDmRNA表达下调,VEGFR-2、VEGFmRNA表达上调;扶肾方高剂量组VEGFmRNA表达上调;塞来昔布组Dll4、Hes1mRNA表达下调,VEGFmRNA表达上调(P<0.05)。与模型组比较,扶肾方低剂量组NICD、Hes1mRNA表达上调,VEGFR-2、VEGFmRNA表达下调;扶肾方高剂量组Notch1、Dll4、NICD、Hes1mRNA表达上调,VEGFR-2、VEGFmRNA表 达 下 调 ;塞 来 昔 布 组Notch1mRNA表达上调,VEGFR-2、VEGFmRNA表达下调(P<0.05)。与扶肾方低剂量组比较,扶肾方高剂量组Notch1、Dll4、VEGFmRNA表达上调,塞来昔布组Notch1mRNA表达上调(P<0.05)。与扶肾方高剂量组比较,塞来昔布组Dll4mRNA表达下调(P<0.05)。见表2。
Tab.2 Comparison of expression levels of Notch1,Dll4,NICD,Hes1,VEGFR-2 and VEGF mRNA in peritoneal tissue of rats between the five groups表2各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、VEGF mRNA表达水平比较 (±s)

Tab.2 Comparison of expression levels of Notch1,Dll4,NICD,Hes1,VEGFR-2 and VEGF mRNA in peritoneal tissue of rats between the five groups表2各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、VEGF mRNA表达水平比较 (±s)
*P<0.05;a与正常组比较,b与模型组比较,c与扶肾方低剂量组比较,d与扶肾方高剂量组比较,P<0.05
组别nNotch1Dll4NICD正常组101.01±0.191.05±0.231.00±0.07模型组90.64±0.15a0.40±0.29a0.46±0.14a扶肾方低剂量组90.63±0.07a0.73±0.140.87±0.11ab扶肾方高剂量组91.12±0.29bc1.47±0.30bc1.06±0.37b塞来昔布组91.41±0.33bc0.61±0.14ad0.67±0.26 F 6.348*10.949*4.073*组别Hes1VEGFR-2VEGF正常组1.01±0.141.04±0.351.01±0.30模型组0.60±0.20a7.93±2.25a10.03±2.15a扶肾方低剂量组1.60±0.57b2.59±0.49ab2.56±0.79ab扶肾方高剂量组1.30±0.38b2.70±1.41b5.59±1.46abc塞来昔布组0.75±0.10a3.07±1.17b3.71±0.38ab F 4.994*12.704*27.270*
2.5 各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、p-VEGFR-2、VEGF蛋白表达水平的比较 与正常组比较,模型组Notch1、Dll4、NICD、Hes1蛋白表达下调,VEGFR-2、p-VEGFR-2、VEGF蛋白表达上调,扶肾方低剂量组Hes1蛋白表达下调,扶肾方高剂量组与塞来昔布组NICD蛋白表达下调(P<0.05)。与模型组比较,扶肾方低剂量组Notch1、Dll4、NICD、Hes1蛋白表达上调,VEGFR-2、p-VEGFR-2、VEGF蛋白表达下调,扶肾方高剂量组Dll4、Hes1蛋白表达上调,VEGFR-2、p-VEGFR-2、VEGF蛋白表达下调,塞来昔布组Notch1、Dll4蛋白表达上调,p-VEGFR-2、VEGFR-2、VEGF蛋白表达下调(P<0.05)。见表3、图2。
Tab.3 Comparison of expression levels of Notch1,Dll4,NICD,Hes1,VEGFR-2,p-VEGFR-2 and VEGF protein in peritoneal tissue of rats between the five groups表3各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、p-VEGFR-2、VEGF蛋白表达水平比较 (±s)

Tab.3 Comparison of expression levels of Notch1,Dll4,NICD,Hes1,VEGFR-2,p-VEGFR-2 and VEGF protein in peritoneal tissue of rats between the five groups表3各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、p-VEGFR-2、VEGF蛋白表达水平比较 (±s)
*P<0.05;a与正常组比较,b与模型组比较,c与扶肾方低剂量组比较,d与扶肾方高剂量组比较,P<0.05
组别nNotch1Dll4NICDHes1VEGFR-2p-VEGFR-2VEGF正常组101.04±0.431.20±0.441.32±0.211.63±0.120.86±0.240.48±0.060.93±0.28模型组90.42±0.15a0.57±0.19a0.98±0.02a0.30±0.17a2.64±0.83a0.92±0.45a1.51±0.60a扶肾方低剂量组90.97±0.37b0.86±0.37b1.19±0.11b1.25±0.20ab1.36±0.19b0.42±0.30b0.81±0.27b扶肾方高剂量组90.71±0.440.90±0.27b1.07±0.16a1.43±0.16b1.42±0.49b0.42±0.20b0.93±0.27b塞来昔布组90.78±0.37b0.97±0.21b1.05±0.26a0.93±0.491.25±0.77b0.47±0.22b0.78±0.30b F 3.244*4.252*5.444*14.310*4.234*6.633*4.090*

Fig.2 The expressions of Notch1,Dll4,NICD,Hes1,VEGFR-2,p-VEGFR-2 and VEGF protein in peritoneal tissue of rats between the five groups图2各组大鼠腹膜组织Notch1、Dll4、NICD、Hes1、VEGFR-2、p-VEGFR-2、VEGF蛋白表达
3 讨论
目前,全球接受PD治疗的患者超过272 000例[5]。截至2017年底,我国PD患者为86 264例[6]。腹膜超滤功能衰竭发生的原因和机制复杂,其中腹膜血管新生起到了重要作用。抑制腹膜血管新生较抑制腹膜纤维化更能保护腹膜功能[7]。目前,临床主要采用改进PD技术、预防PD相关腹膜炎、改善腹膜透析液的生物相容性等手段抑制PD相关腹膜血管新生,改善腹膜超滤功能,延缓超滤衰竭。近年有研究表明,部分单味及中药复方具有抑制腹膜血管新生、抗腹膜纤维化的作用,如丹参酮、黄芪甲苷、肾康注射液等可改善由含葡萄糖腹膜透析液诱导的大鼠腹膜功能减退,防治腹膜纤维化[8]。中医药在抑制PD相关腹膜血管新生,防治超滤衰竭中的作用越来越受到关注。
血管新生是在原有血管基础上,通过出芽或套叠增生而形成,该过程不仅与机体的正常发育和组织修复等密切相关,也参与肿瘤、动脉粥样硬化等病变的发生与发展[9]。血管新生受VEGF及其受体VEGFR-2调控[10],Notch通路也参与了血管形成的一系列过程,可直接影响尖端细胞的分化、内皮细胞的增殖、血管稳定性以及动静脉分化等。VEGFNotch通路可影响血管新生过程的多个环节,可通过调控VEGF-Notch信号通路的不同作用靶点,达到调控血管新生的目的[11]。Notch信号通路是一条高度保守的经典信号转导通路,参与细胞的增殖分化、组织和器官的发育等[12]。在哺乳动物中,Notch通路由Notch受体、Notch配体以及下游分子等组成。Notch受体共4个,包括Notch1、Notch2、Notch3及Notch4。Notch配体有5个,包括Dll1、Dll3、Dll4、Jagged1及Jagged2。Notch1受体表达于柄细胞,主要参与血管新生及血管正常生长。Dll4在尖端细胞表达,其表达过度或者减少,都会影响内皮细胞功能。Notch1与Dll4配体结合,抑制VEGF诱导柄细胞转化为尖端细胞,上调Dll4表达,可影响Notch信号通路,防止内皮细胞过度出芽,使血管适度生长,从而维持血管有序发生及生长,保证新生血管的管腔形成,促使血管功能性成熟,从而达到调控血管新生的目的。而阻断Notch信号通路能够导致血管内皮细胞的过度增殖,产生大量无功能的新生血管,使血管灌注减少[13]。NICD是Notch的活性形式,NICD的表达可促进Notch信号通路的活化,Hes1是Notch信号通路重要的下游靶分子[14]。研究发现,Hes1的表达与Notch1高表达呈正相关,而Notch1的活性表现形式为NICD,说明NICD与Hes1的表达也具有一致性[15]。
有序的血管形成需要VEGF与Notch信号通路协调作用,VEGF包括不同的分子亚型和不同的VEGF结合受体,其中VEGFR-2与血管新生的关系最为密切[16]。Dll4是VEGF的下游分子,VEGF与其受体VEGFR-2结合后可引起Dll4高表达,过表达的Dll4与Notch受体结合,激活Notch信号通路。同时,Dll4可以通过对VEGF的负反馈来抑制其受体VEGFR-2的表达以减少血管内皮细胞的增殖与迁移,减少血管的过度生长[17]。塞来昔布是环氧化酶2抑制剂,可以抑制尿毒症PD大鼠腹膜血管新生,改善腹膜超滤功能,已在实验研究中得到广泛应用[18]。本课题组前期研究表明,扶肾方可通过调节各种细胞因子表达,抑制腹膜间皮细胞上皮间质转化,改善腹膜功能及腹膜纤维化[19]。VEGF-Notch信号通路与PD相关腹膜血管新生及腹膜超滤衰竭的关系鲜见研究报道。
本研究通过建立5/6肾切除大鼠慢性肾衰竭模型,腹腔注射含葡萄糖腹膜透析液,成功复制尿毒症大鼠PD模型,观察扶肾方对尿毒症PD大鼠腹膜超滤功能及腹膜组织Notch1、Dll4、NICD、Hes1、VEGF、VEGFR-2表达的影响。结果显示,模型组及各干预组大鼠腹膜超滤量明显低于正常组,扶肾方高剂量组与塞来昔布组超滤量高于模型组和扶肾方低剂量组,塞来昔布组超滤量低于扶肾方高剂量组,提示扶肾方可改善腹膜超滤功能。腹膜HE染色显示,扶肾方低剂量组与高剂量组大鼠腹膜新生血管较模型组明显减少。与正常组比较,模型组大鼠腹膜组织Notch1、NICD、Dll4、Hes1的mRNA及蛋白表达均下调 ,VEGFR-2、VEGFmRNA及VEGFR-2、p-VEGFR-2、VEGF蛋白表达上调。与模型组比较,扶肾方低剂量组NICD、Hes1mRNA及Notch1、NICD、Dll4、Hes1蛋白表达上调,扶肾方高剂量组Notch1、NICD、Dll4、Hes1mRNA及Dll4、Hes1蛋白表达上调,塞来昔布组Notch1mRNA及Notch1、Dll4蛋白表达上 调 ,各 干 预 组VEGFR-2、VEGFmRNA及p-VEGFR2、VEGFR-2、VEGF蛋白表达均下调。以上结果表明扶肾方的作用与塞来昔布类似。笔者推测在5/6肾切除尿毒症大鼠PD模型中,扶肾方通过上调腹膜组织Notch1、NICD、Dll4、Hes1的mRNA及蛋白表达,下调VEGFR-2、VEGFmRNA及VEGFR-2、p-VEGFR-2、VEGF蛋白表达,抑制腹膜血管新生,达到改善腹膜超滤功能,防治超滤衰竭的作用。
传统医学认为,尿毒症为本虚标实证,本虚多为脾肾亏虚,标实以湿浊、瘀血为主,浊、瘀是脾肾亏虚产生的病理因素,又是诱导加重脾肾亏虚的主因。ESRD患者行PD治疗后,尿毒症病机关键未变,故PD相关腹膜超滤衰竭的主要病机仍为脾肾亏虚、湿浊瘀血内蕴。扶肾方正是据此病机关键组成的临床效方,由陈皮、半夏、当归、黄芪、淫羊藿、丹参、熟军、鬼箭羽组成,治法融“补、消、和”于一体,效专“健脾益肾,化瘀降浊”。既往临床及基础研究表明,扶肾方可显著延缓尿毒症PD大鼠腹膜纤维化,改善腹膜超滤衰竭[19-20],但该作用与腹膜血管新生的关系目前尚不明确。
综上所述,本研究从动物实验初步证实,扶肾方可通过上调腹膜组织Notch1、NICD、Dll4、Hes1的mRNA及蛋白表达,下调VEGFR-2、VEGFmRNA及VEGFR-2、p-VEGFR-2、VEGF蛋白表达,抑制腹膜血管新生,防治腹膜超滤衰竭,为临床应用扶肾方防治腹膜超滤衰竭提供了实验依据及理论支持。但扶肾方抑制腹膜血管新生,防治腹膜超滤衰竭是否还通过其他信号通路发挥作用尚需进一步深入探索。
