大麻二酚通过激活PPAR-γ减轻四氯化碳所致小鼠急性肝损伤
2021-08-04舒远辉马润谢娜李垚王豫萍
舒远辉,马润,谢娜,李垚,王豫萍,2△
肝损伤是一个多因素、多途径、多靶点共同作用的结果[1-2]。短时间内肝脏受到药物、病毒、化学毒物大量刺激会引起急性肝损伤[3-4]。肝损伤可进一步发展为肝纤维化、肝硬化、肝癌等严重的肝脏疾病。因此,如何有效地预防和治疗肝损伤,已经成为国内外研究的焦点。大麻二酚(cannabidiol,CBD)是大麻(Cannabis Sativa)中含量最多的非成瘾成分,患者即使长期使用仍具有良好的安全性[5-6]。研究证明,CBD对急性、慢性炎症动物模型有治疗效果[7-8]。CBD对氧化应激和炎症相关的疾病如结肠炎[9]、糖尿病并发症[10]、药物诱导的肾毒性[11]、乙醇诱导的脂肪沉积症或缺氧缺血引起的脑损伤等[12]具有治疗作用。本课题组前期研究结果发现,在慢性过量乙醇饲养的小鼠酒精性肝损伤模型中,CBD可通过减轻氧化应激反应和炎症反应改善酒精性脂肪肝[13]。然而,CBD对化学毒物所致肝损伤是否也有保护作用目前尚未明确。本研究使用四氯化碳(CCl4)诱导小鼠急性肝损伤,探讨CBD对小鼠急性肝损伤的影响及机制。
1 材料与方法
1.1 实验动物42只雄性C57BL/6J小鼠,SPF级,6~8周龄,体质量(22±2)g,购自斯贝福(北京)生物技术有限公司,批准号:[SCXK(京)2016-0002],小鼠饲养于通风良好,温度(22±2)℃,湿度40%~70%,昼夜节律(12 h/12 h)相对恒定的环境中,自由饮食饮水,适应性饲养1周后开始建模。
1.2 主要试剂与仪器CBD、还原型谷胱甘肽(GSH)购自美国Sigma公司,CCl4购自中国Aladdin公司,超氧化物歧化酶(SOD)、GSH、丙二醛(MDA)检测试剂盒购自中国南京建成生物工程研究所,抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自英国Abcam公司,抗过氧化物增殖物激活受体-γ(PPAR-γ)抗体、抗环氧合酶-2(COX-2)抗体购自中国万类生物科技公司,全蛋白提取及BCA定量试剂盒购自中国北京索莱宝公司。ELX酶标仪、全套电泳装置购自美国Bio-Rad公司,超高速低温离心机购自美国Beckman公司,化学发光成像仪购自上海培清有限公司。
1.3 动物分组和建模方法 将42只C57BL/6J雄性小鼠采用随机数字表法分为5组:对照组(9只)、模型组(9只)、CBD对照组(9只)、GSH干预组(阳性对照组,6只)、CBD干预组(9只),其中CBD对照组、GSH干预组、CBD干预组分别腹腔注射CBD 5 mg/kg、GSH 200 mg/kg、CBD 5 mg/kg,对照组、模型组注射相同剂量的生理盐水。2 h后模型组、GSH干预组、CBD干预组腹腔注射含20%CCl4橄榄油5 mL/kg建立急性肝损伤模型,对照组、CBD对照组注射相同剂量的橄榄油。禁食12 h,不禁水,造模24 h后麻醉小鼠,摘眼球取血,后颈椎脱臼处死小鼠,立刻冰上留取肝左叶,置于-80℃低温冰箱保存备用;同时肝右叶以4%多聚甲醛固定,并在3 d内石蜡包埋、切片,准备组织病理检测。
1.4 指标检测与方法
1.4.1 肝组织HE染色检测病理变化 将肝组织用4%多聚甲醛固定24 h后脱水处理,再行石蜡包埋,用切片机切取约4 μm厚的组织贴片,进行HE染色,光镜下(×200)观察肝组织的形态病理变化及损伤程度。
1.4.2 血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)检测 将收集到的小鼠血液室温静置,至血块自然收缩有血清析出,3 500 r/min离心10 min,收集上层血清,采用罗氏生化仪COBAS C501,按标准操作肌酸激酶测定(IFCC)法检测血清ALT、比色法检测血清AST。
1.4.3 肝组织匀浆检测SOD、GSH、MDA水平 每组随机抽取6只小鼠,取约100 mg肝组织,按照1∶9的比例加入生理盐水,用匀浆器充分研磨制成10%的肝组织匀浆。采用酶标仪,严格按说明书的操作步骤,水溶性四唑盐-1(WST-1)法检测SOD、微板法检测GSH、硫代巴比妥酸(TBA)法检测MDA。
1.4.4 Western blot法检测肝组织PPAR-γ、COX-2蛋白的表达 取约50 mg肝组织放入冰上预冷的研钵,加入液氮后快速研磨成粉末,再加入500 μL的RIPA裂解液和含1%蛋白酶抑制剂-苯甲基磺酰氟(PMSF),冰上裂解30 min,4℃,12 000 r/min离心10 min,上清液即所提蛋白。用BCA蛋白测定试剂盒按说明书测定蛋白浓度,加入相应体积的磷酸盐缓冲溶液(PBS)和5×上样缓冲液,使得各个样本体系蛋白浓度相同,煮沸10 min后置于-20℃保存备用。在20~40 μg之间,以相同的蛋白含量计算上样体积,进行SDS-PAGE电泳、转膜、封闭,一抗(TBST稀释,GAPDH比例为1∶10 000,PPAR-γ为1∶1 000,COX-2为1∶1 000)4℃孵育过夜,洗膜,加入辣根过氧化物酶标记的羊抗兔二抗(TBST,1∶8 000稀释)室温孵育1 h,均匀滴加化学发光液(ECL)后在曝光仪上曝光,保存图片用Image J进行灰度分析。
1.5 统计学方法 采用SPSS 22.0和Graphpad Prism 8.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较进行单因素方差分析,组间多重比较行LSD-t检验;非正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CBD对小鼠模型肝脏病理变化的影响 见图1。HE染色显示,对照组、CBD对照组肝组织结构正常,细胞形态清晰,无明显异常,细胞间无炎性细胞浸润;模型组肝组织结构模糊,肝索解离,细胞出现大面积的脂肪变性,局部点灶状坏死;GSH干预组、CBD干预组肝组织结构较为清晰,仅有小面积细胞水肿及少量炎性细胞浸润。
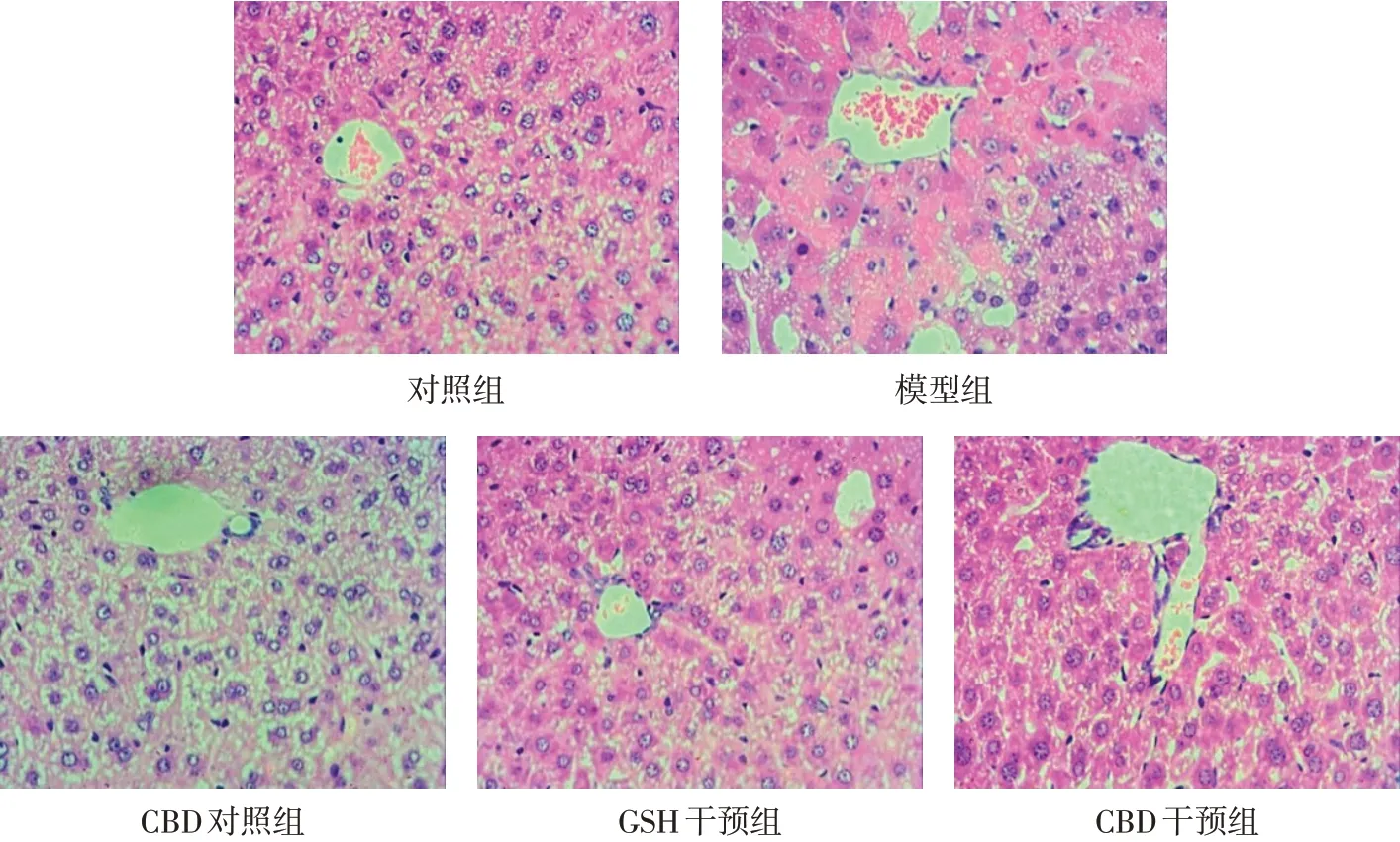
Fig.1 Pathological changes in liver tissues of mice in five groups(HE staining,×200)图1各组小鼠肝组织病理变化情况(HE染色,×200)
2.2 CBD对小鼠血清ALT、AST的影响 与对照组比较,模型组、GSH干预组、CBD干预组ALT、AST水平均明显升高(P<0.05);与模型组比较,CBD对照组、GSH干预组、CBD干预组ALT、AST水平均降低(P<0.05);与CBD对照组比较,GSH干预组、CBD干预组ALT、AST水平明显升高(P<0.05);与GSH干预组比较,CBD干预组ALT水平无明显变化(P>0.05),AST水平降低(P<0.05),见表1。

Tab.1 Comparison of serum ALT and LST levels between five groups of mice表1 5组小鼠血清ALT、AST水平比较 [M(P25,P75)]
2.3 CBD对小鼠肝组织匀浆中SOD、GSH、MDA水平的影响 与对照组比较,模型组SOD、GSH水平明显降低,MDA水平明显升高(均P<0.05);与模型组比较,CBD对照组、GSH干预组、CBD干预组SOD、GSH水平明显升高,MDA水平明显降低(均P<0.05);与CBD对照组比较,GSH干预组MDA水平明显升高(P<0.05),见表2。

Tab.2 Comparison of SOD,GSH and MDA levels in liver tissue homogenates between five groups of mice表2 5组小鼠肝组织匀浆中SOD、GSH、MDA水平比较(n=6)
2.4 CBD对小鼠肝组织PPAR-γ、COX-2蛋白表达水平的影响 与对照组比较,模型组小鼠肝组织PPAR-γ蛋白表达水平降低,COX-2蛋白表达水平升高(均P<0.05);与模型组比较,CBD对照组、GSH干预组、CBD干预组小鼠PPAR-γ蛋白表达水平升高,COX-2蛋白表达水平降低(均P<0.05);对照组、CBD对照组、GSH干预组与CBD干预组间差异均无统计学意义(均P>0.05),见图2、表3。

Fig.2 Expressions of PPAR-γ and COX-2 proteins in liver tissues of mice detected by Western blot assay图2 Western blot法检测小鼠肝组织PPAR-γ、COX-2蛋白的表达
Tab.3 Comparison of relative expression levels of PPAR-γ and COX-2 protein in liver tissues between five groups of mice表3 5组小鼠肝组织PPAR-γ、COX-2蛋白表达水平比较(n=3,%,±s)
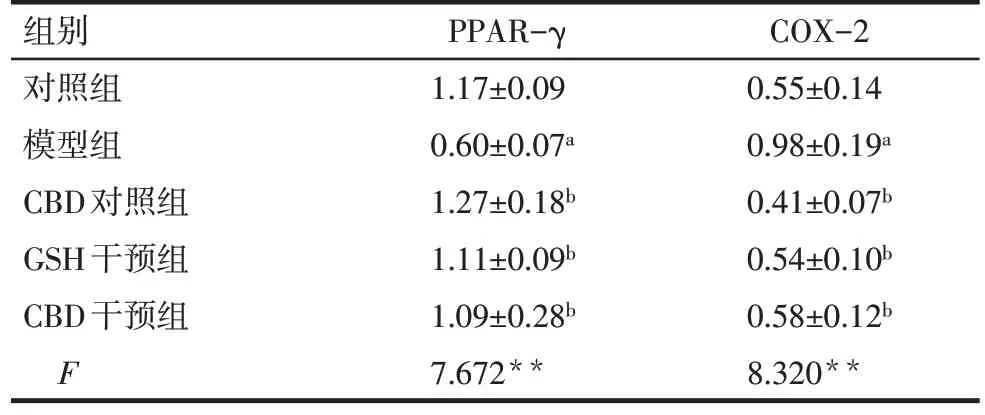
Tab.3 Comparison of relative expression levels of PPAR-γ and COX-2 protein in liver tissues between five groups of mice表3 5组小鼠肝组织PPAR-γ、COX-2蛋白表达水平比较(n=3,%,±s)
**P<0.01;a与对照组比较,b与模型组比较,P<0.05
组别PPAR-γCOX-2对照组1.17±0.090.55±0.14模型组0.60±0.07a0.98±0.19a CBD对照组1.27±0.18b0.41±0.07b GSH干预组1.11±0.09b0.54±0.10b CBD干预组1.09±0.28b0.58±0.12b F 7.672**8.320**
3 讨论
肝脏是人体最大的器官,具有清除有害物质、毒素的重要功能,但也易受生物、化学毒素的攻击[14]。在关于肝损伤的研究中,CCl4诱导小鼠急性肝损伤是经典动物模型,其病理变化与人的肝脏病变有许多相似处[15]。AST和ALT是评估肝功能的敏感指标,正常状态下,ALT、AST主要存在于胞质内,很少出现在血清中。ALT活性升高提示肝细胞受损,细胞膜通透性增强;AST活性升高提示线粒体损伤[16]。本研究结果显示,模型组小鼠血清ALT、AST水平较对照组明显上升,结合病理结果,提示急性肝损伤模型建立成功;与模型组相比,GSH干预组、CBD干预组HE染色显示肝损伤程度明显减轻,血清ALT、AST水平降低,提示CBD对小鼠急性肝损伤具有一定的预防作用。
氧化应激反应在CCl4所诱导的肝损伤中起主要作用,在肝脏中,CCl4在细胞色素P450(CYP450)的作用下,刺激NADPH氧化酶产生大量的活性氧(ROS),突破GSH对ROS的防线,诱导自由基和脂质过氧化,减少抗氧化酶和抗氧化底物,导致氧化应激反应[17]。大量累积的自由基与DNA分子中的嘌呤、嘧啶和脱氧核糖骨架反应,破坏DNA结构,生成脂质过氧化产物MDA,大量MDA破坏肝细胞膜结构,造成肝细胞肿胀坏死,机体抗氧化酶SOD活性下降,引起肝脏损伤[18]。因此,通过检测组织中MDA、SOD、GSH水平可评价CCl4诱导的氧化损伤情况。本研究结果显示,CCl4可导致肝脏MDA水平升高,SOD、GSH水平降低,而CBD可明显下调肝脏MDA水平,上调SOD、GSH水平,与Arbab等[19-20]的研究结果一致。因此,CBD对CCl4所致急性肝损伤的保护作用可能与提高肝组织抗氧化酶活性,减轻肝组织脂质过氧化反应,从而减轻氧化应激反应有关。
为了进一步了解CBD预防CCl4急性肝损伤的机制,本研究采用Western blot法检测了肝组织PPAR-γ、COX-2蛋白的表达。PPAR-γ是核激素受体超家族的成员,其参与细胞的分化、增殖、凋亡和细胞周期等相关生物过程的调控。COX-2是前列腺素生成的限速酶,其催化产生的前列腺素参与机体的炎症反应。有研究表明在相关肝病中PPAR-γ的活性受到抑制[21],上调PPAR-γ能改善急性肺损伤中的炎症反应[22]。在脂肪性肝炎中,COX-2表达上调[23]。本研究结果显示,与对照组比较,模型组小鼠肝组织PPAR-γ蛋白表达水平降低,COX-2蛋白表达水平升高;而CBD预处理明显逆转了上述趋势,提示CBD通过上调PPAR-γ的表达,进而发挥抗炎抗氧化的功能,在改善肝损伤的过程中可能发挥着重要的作用。
综上所述,CBD能通过降低小鼠ALT、AST、MDA水平,减轻炎症反应并提高小鼠的抗氧化能力,改善CCl4致小鼠急性肝损伤,其机制与激活PPAR-γ、降低COX-2的表达有关,但其具体通路仍待进一步研究。
