PCSK9抑制剂在ox-LDL诱导HUVECs损伤中的保护作用研究
2021-08-04许景涵左俊荣韩楚仪李婷婷金冬霞赵福梅丛洪良
许景涵,左俊荣,韩楚仪,李婷婷,金冬霞,赵福梅,丛洪良△
动脉粥样硬化是冠状动脉疾病和脑血管疾病的重要病理基础。在动脉粥样硬化基础上,急性血栓形成导致血管闭塞引起的心肌梗死和脑卒中是全球范围内最常见的死亡原因[1-2]。动脉粥样硬化由多种因素引起,其确切发病机制仍不完全清楚。脂质代谢异常、炎症反应和细胞凋亡在动脉粥样硬化的发生和发展中起重要作用。研究发现,氧化型低密度脂蛋白(ox-LDL)可通过血凝素低密度脂蛋白受体-1(LOX-1)调控表面黏附分子表达,进而影响内皮细胞功能,加速内皮损伤,形成动脉粥样硬化斑块,诱发动脉粥样硬化性心脑血管疾病[3-5]。
人类枯草溶菌素转化酶9(PCSK9)是原蛋白转化酶枯草杆菌蛋白酶/kexin家族的成员,编码神经细胞凋亡调节的转化酶1,与家族性常染色体显性高胆固醇血症有关[6]。PCSK9可通过降低肝细胞上低密度脂蛋白受体(LDLR)的数量,升高低密度脂蛋白胆固醇(LDL-C)水平,导致高胆固醇血症[7-8]。有研究证实PCSK9抑制剂可通过降低脂蛋白a水平来降低静脉血栓的发生风险[9]。其还可阻断LDLR,降低LDL-C水平,起到抗动脉粥样硬化的作用。但是否还具有抗炎、减轻内皮细胞凋亡、改善血管内皮的功能,目前尚不完全明确。本研究采用ox-LDL处理人脐静脉内皮细胞(HUVECs)建立细胞损伤模型,予以不同浓度PCSK9抑制剂处理,旨在探讨PCSK9抑制剂对炎症反应及细胞凋亡的影响。
1 材料与方法
1.1 实验材料HUVECs细胞株购自美国模式培养物集存库(ATCC),DMEM培养基购自Hyclone公司。胎牛血清(FBS)购自美国Gibco公司。CCK-8细胞增殖检测试剂盒、细胞凋亡检测试剂盒均购自Meilunbio公司。PrimeScriptTMRT Reagent Kit(RR037A)、TB Green®Premix Ex TaqTMⅡ(RR820L)、RNAiso Plus(9109)均购自日本TaKaRa公司。ECL发光液(B500014)购自武汉三鹰生物技术有限公司。PCSK9抗体(ab181142)购 自英国Abcam公 司,Bax抗体(YM3619)、Bcl-2抗体(YM3041)、Cleaved-Caspase-3抗体(YM3431)和GAPDH抗体(YM3215)均购自北京Immunoway公司。核因子(NF)-κB抗体(ABP51957)和磷酸化NF-κB(p-NF-κB)抗体(ABP50369)均购自Abbkine公司。IgG二抗购自北京中杉金桥生物技术有限公司。ox-LDL(H7980)、胞浆蛋白和核蛋白提取试剂盒均购自北京Solarbio公司,PCSK9抑制剂(S7976)购自selleck公司。白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α和单核细胞趋化蛋白(MCP)-1酶联免疫吸附测定(ELISA)试剂盒均购自武汉优尔生科技股份有限公司。
1.2 实验方法
1.2.1 细胞培养及分组HUVECs置于含10%FBS和1%双抗的DMEM培养基中培养并于5%CO2、37℃培养箱中孵育;然后使用0.3%的胰酶消化并进行传代培养。取对数生长期的细胞,分为Control组(仅更换培养基),ox-LDL组(50 mg/L ox-LDL诱导24 h),低、中、高剂量PCSK9抑制剂组(分别用5、10、20 μmol/L PCSK9抑制剂预处理24 h,再加入50 mg/L ox-LDL诱导24 h),每组设3个复孔。
1.2.2 CCK-8法检测细胞活性 细胞分组处理24 h后,每孔加入新鲜配制的含10 μL CCK-8的培养基,置于培养箱中继续培养4 h,用酶标仪检测各组细胞在450 nm的光密度(OD)值。计算细胞存活率=(实验组OD/对照组OD)×100%,并绘制细胞生长存活率曲线。
1.2.3 ELISA检测细胞培养上清液中IL-6、TNF-α和MCP-1的含量 收集各组细胞培养液,根据ELISA试剂盒说明书检测细胞培养上清液中IL-6、TNF-α和MCP-1的含量。
1.2.4 qPCR检测细胞中IL-6、TNF-α和MCP-1的转录水平 收集各组处理好的细胞,经PBS洗涤3次,加入1 mL Trizol裂解液提取细胞RNA,反转录为cDNA后进行PCR反应。PCR体系:2×TB Green Premix Ex TaqⅡ10 μL,上、下游引物各0.8 μL,cDNA 2 μL,ROX reference Dye 0.4 μL,灭菌水6 μL。反应条件:95℃30 s;95℃5 s,60℃30 s,40个循环;熔解曲线:95℃15 s,60℃1 min,95℃15 s。采用2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。

Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.2.5流式细胞术检测细胞凋亡情况 取处理好的细胞,吸弃培养基,PBS洗涤2次,用不含EDTA的胰酶消化细胞,加入完全培养基终止消化。500×g离心5 min,弃上清液,细胞收集到管底;结合缓冲液重悬细胞。取100 μL细胞悬液(约1×105个细胞),加入5 μL Annexin V和5 μL PI,轻轻混匀,室温避光孵育15 min。孵育完成后,每管加入400 μL结合缓冲液,混匀后使用流式细胞仪检测(1 h内检测完毕)。
1.2.6 Western blot检 测Bax、Bcl-2、Cleaved-Caspase-3、PCSK9、NF-κB、p-NF-κB蛋白表达 收集处理好的细胞,吸弃培养基,用预冷的PBS洗涤2次,加入RIPA裂解液裂解细胞并提取总蛋白。根据胞浆蛋白和核蛋白提取试剂盒说明书分别进行胞浆蛋白、核蛋白提取。采用BCA试剂盒检测细胞中蛋白浓度,统一上样30 μg进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳条件:80 V 30 min,然后120 V 2 h。电泳结束后17 V恒压转膜30 min,之后室温5%脱脂牛奶封闭3 h,TBST洗膜后添加Bax、Bcl-2、Cleaved-Caspase-3、PCSK9、NF-κB、p-NF-κB和GAPDH一抗(均为1∶1 000稀释)于4℃孵育过夜;次日TBST洗膜3次,加入二抗(1∶10 000稀释),室温孵育2 h后TBST洗膜3次。在暗室中使用ECL显影曝光,扫描软件进行图像采集,Image J软件分析灰度值并计算目的蛋白相对表达水平。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析,符合正态分布的计量数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,组间多重比较时方差齐行LSD-t法,方差不齐行Dunnett’s T3检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞存活率比较 与Control组比较,ox-LDL组HUVECs存活率明显下降;与ox-LDL组相比,中、高剂量PCSK9抑制剂处理后,HUVECs存活率升高(P<0.05),见图1。
2.2 各组细胞TNF-α、IL-6和MCP-1转录及分泌水平变化 与Control组比较,ox-LDL组细胞炎性因子TNF-α、IL-6和MCP-1转录及分泌水平增加(P<0.05)。与ox-LDL组相比,中、高剂量PCSK9抑制剂处理细胞IL-6、TNF-α和MCP-1转录及分泌水平明显下降,低剂量组IL-6和MCP-1转录水平明显下降,见表2。

Fig.1 Changes of cell activity in each group图1各组细胞存活率变化
2.3 各组细胞凋亡水平比较Control组,ox-LDL组,低、中、高剂量PCSK9抑制剂组细胞凋亡率分别为(3.07±0.91)%、(34.25±3.19)%、(23.80±2.84)%、(15.67±2.25)%、(8.93±1.62)%,组间比较差异有统计学意义(F=56.560,P<0.01)。与Control组比较,ox-LDL组中细胞凋亡率明显升高(P<0.05)。与ox-LDL组比较,PCSK9抑制剂处理的细胞凋亡率均降低,中、高剂量PCSK9抑制剂组凋亡率降低更为明显(P<0.05),见图2。
2.4 各组细胞凋亡相关蛋白表达水平变化 与Control组 比 较,ox-LDL组 细 胞 促凋亡蛋白Bax和Cleaved-Caspase-3的表达上调,抗凋亡蛋白Bcl-2表达下调,p-NF-κB水平升高(P<0.05)。与ox-LDL组比较,中、高剂量PCSK9抑制剂处理后,Bax和Cleaved-Caspase-3表达下调,Bcl-2表达上调,同时p-NF-κB水平降低(P<0.05)。见表3、图3。
2.5 各组细胞核及胞质中NF-κB表达变化 与Control组比较,ox-LDL组细胞核中NF-κB表达上调,胞质中表达下调(P<0.05)。与ox-LDL组比较,中、高剂量PCSK9抑制剂处理后,HUVECs细胞质中NF-κB表达上调,细胞核NF-κB表达下调(P<0.05),见表4、图4。
Tab.2 Changes of TNF-α,IL-6 and MCP-1 proteins and their gene levels in each group表2各组细胞中TNF-α、IL-6和MCP-1蛋白及其基因水平变化 (n=3,±s)

Tab.2 Changes of TNF-α,IL-6 and MCP-1 proteins and their gene levels in each group表2各组细胞中TNF-α、IL-6和MCP-1蛋白及其基因水平变化 (n=3,±s)
**P<0.01;a与Control组比较,b与ox-LDL组比较,c与低剂量PCSK9抑制剂组比较,d与中剂量PCSK9抑制剂组比较,P<0.05;表3、4同
组别TNF-αIL-6MCP-1基因 蛋白(ng/L) 基因 蛋白(ng/L) 基因 蛋白(ng/L)Control组1.03±0.2256.65±2.111.06±0.3516.59±2.061.05±0.36149.67±4.39 ox-LDL组9.29±1.20a93.21±8.02a4.91±0.59a34.65±3.44a17.21±1.52a272.81±15.10a低剂量PCSK9抑制剂组8.26±1.00a88.87±8.65a3.15±0.42ab31.50±2.64a7.63±1.73ab238.99±10.93a中剂量PCSK9抑制剂组4.57±1.55abc72.24±6.80ab2.54±0.45ab28.39±2.14ab6.29±0.46ab226.66±7.95ab高剂量PCSK9抑制剂组3.88±1.77abc67.03±9.14abc2.16±1.10bc22.82±2.13ab2.80±0.60bcd207.26±4.77abc F 14.160**119.419**9.760**111.619**65.989**142.917**

Fig.2 Changes of apoptosis levels in each group图2各组细胞凋亡水平变化
Tab.3 The changes of the expressions of apoptosis-related proteins and p-NF-κB in each group表3各组细胞凋亡相关蛋白及p-NF-κB表达变化 (n=3,±s)
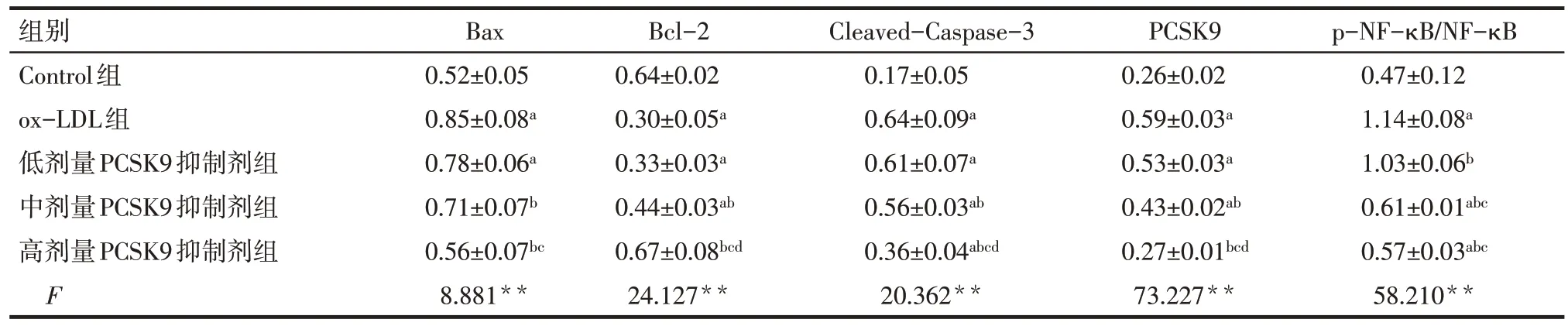
Tab.3 The changes of the expressions of apoptosis-related proteins and p-NF-κB in each group表3各组细胞凋亡相关蛋白及p-NF-κB表达变化 (n=3,±s)
**P<0.01
组别BaxBcl-2Cleaved-Caspase-3PCSK9p-NF-κB/NF-κB Control组0.52±0.050.64±0.020.17±0.050.26±0.020.47±0.12 ox-LDL组0.85±0.08a0.30±0.05a0.64±0.09a0.59±0.03a1.14±0.08a低剂量PCSK9抑制剂组0.78±0.06a0.33±0.03a0.61±0.07a0.53±0.03a1.03±0.06b中剂量PCSK9抑制剂组0.71±0.07b0.44±0.03ab0.56±0.03ab0.43±0.02ab0.61±0.01abc高剂量PCSK9抑制剂组0.56±0.07bc0.67±0.08bcd0.36±0.04abcd0.27±0.01bcd0.57±0.03abc F 8.881**24.127**20.362**73.227**58.210**

Fig.3 Results of Western blot detection of apoptosis-related protein expression level in HUVECs图3 Western blot检测各组细胞凋亡相关蛋白表达水平
Tab.4 The changes of the expressions of NF-κB in nucleus and cytoplasm in each group表4各组细胞核及胞质中NF-κB表达变化(n=3,±s)
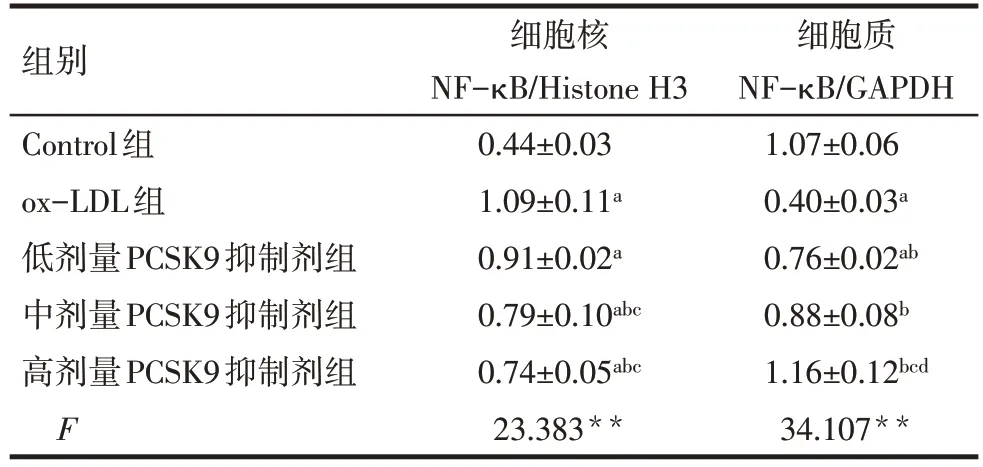
Tab.4 The changes of the expressions of NF-κB in nucleus and cytoplasm in each group表4各组细胞核及胞质中NF-κB表达变化(n=3,±s)
**P<0.01
组别 细胞核 细胞质NF-κB/Histone H3NF-κB/GAPDH Control组0.44±0.031.07±0.06 ox-LDL组1.09±0.11a0.40±0.03a低剂量PCSK9抑制剂组0.91±0.02a0.76±0.02ab中剂量PCSK9抑制剂组0.79±0.10abc0.88±0.08b高剂量PCSK9抑制剂组0.74±0.05abc1.16±0.12bcd F 23.383**34.107**

Fig.4 The protein expression levels of NF-κB in cytoplasm and nucleus of each group detected by Western blot assay图4 Western blot检测各组细胞质及细胞核中NF-κB蛋白表达水平
3 讨论
内皮细胞损伤和功能异常是动脉粥样硬化发生的重要诱发因素。内皮细胞损伤常伴随炎症反应,炎性细胞大量浸润直接影响中性粒细胞对内皮细胞的黏附,诱发炎性因子募集,进而加剧内皮损伤。
PCSK9不仅参与脂代谢,还与细胞炎症反应密切相关。无内毒素的重组PCSK9可使促炎性因子(如IL-1β、TNF-α、MCP-1和IL-6)在初级巨噬细胞和THP-1巨噬细胞中表达增加[10]。此外,PCSK9还可激活TLR4/NF-κB通路,诱发炎症反应[8]。研究发现,心肌缺血后PCSK9表达上调,激活自噬,增加心肌梗死面积,降低心功能,提示PCSK9过表达可能是动脉粥样硬化发病机制之一[11]。在载脂蛋白E基因敲除(apoEKO)小鼠中发现,沉默PCSK9表达可通过减轻血管炎症反应和抑制TLR4/NF-κB信号通路直接抑制动脉粥样硬化[12]。本研究发现,ox-LDL处理的HUVECs中TNF-α、IL-6和MCP-1等炎性因子均明显增加,表明ox-LDL可使内皮细胞炎症反应加剧,而经10、20 μmol/L的PCSK9抑制剂干预后炎性因子的转录和分泌水平明显下降,提示PCSK9抑制剂可以减轻ox-LDL诱导的HUVECs的炎症反应,发挥抗炎作用。
随着动脉粥样硬化的进展,内皮细胞凋亡能够损伤内皮的完整性并增加通透性,诱发血管损伤和斑块形成。本研究结果显示,ox-LDL处理后的HUVECs细胞存活率明显降低,细胞凋亡增加。PCSK9抑制剂干预后,明显逆转ox-LDL导致的HUVECs细胞存活率降低,减少细胞凋亡。研究表明,下调PCSK9表达抑制HUVECs的凋亡主要通过Bcl/Bax-Caspase9-Caspase3线 粒 体 凋 亡 通 路[13]。PCSK9Qβ-003疫苗通过调节胆固醇逆向转运、抑制炎性细胞浸润和凋亡来减缓动脉粥样硬化的发展[14]。本研究结果显示PCSK9抑制剂可以明显下调Cleaved-Caspase-3表达,上调Bcl-2表达。另有研究表明PCSK9通过损伤线粒体DNA加重Caspase-1依赖的细胞凋亡,促炎因子和凋亡可能是治疗PCSK9相关心血管疾病的潜在靶点[15]。此外,笔者发现PCSK9抑制剂通过影响NF-κB入核发挥调节作用,抑制细胞凋亡,但其具体深入的核内调控机制目前还在探索中。
综上所述,本研究初步证实PCSK9抑制剂可抑制ox-LDL导致的HUVECs炎症反应和细胞凋亡,增加细胞活性;但这些效果是否独立于降脂作用尚不完全清楚。PCSK9抑制剂作为新型降脂药在抗动脉粥样硬化中的作用及其机制尚需更多的基础及临床研究来揭示,进而为临床防治心血管疾病提供更加充分的理论依据。
