MicroRNA-141通过PI3K/Akt/mTOR信号通路促进PCOS卵巢颗粒细胞增殖的机制研究
2021-08-04陈娇张妍钟媛媛
陈娇,张妍,钟媛媛
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种常见于育龄期女性的内分泌及代谢紊乱性疾病。其基本特征为卵巢多囊样病理改变、高雄激素血症及排卵生理功能障碍,多数患者同时还伴有胰岛素抵抗、糖尿病、肥胖、高脂血症等代谢异常综合征[1-2]。目前关于PCOS的发病机制仍不清晰,但卵巢颗粒细胞异常增殖与PCOS之间存在密切联系[3]。微小RNA(microRNA,miR)是一类具有高度保守特点的单链非编码RNA,其可在转录后水平对细胞增殖、凋亡、生长、分化等多种生物学功能产生影响[4-5]。近年研究发现,miR-141可有效调控卵巢颗粒细胞的增殖、凋亡等生物学行为[6-7],但其通过何种信号通路发挥上述作用尚未明确。此外还有研究证实,miR-141在磷脂酰肌醇3-激酶(phosphoinositide-3 kinase,PI3K)信号通路调控中发挥着重要作用[8-9];而PI3K信号通路与PCOS胰岛素抵抗有着密切联系,由此推测miR-141可能通过PI3K信号通路影响PCOS的发展过程。本研究拟探讨miR-141通过PI3K/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mamalian target of rapamycin,mTOR)信号通路促进PCOS卵巢颗粒细胞增殖的作用机制,为后续PCOS治疗提供新的靶点和研究思路。
1 材料与方法
1.1 材料 收集2018年2月—2019年12月在武汉市妇幼保健院妇产科确诊为PCOS的20例患者的卵巢组织,患者平均年龄(29.5±7.1)岁。同期从20例因卵巢良性疾病行手术的患者中获取正常卵巢组织作为对照组,患者平均年龄(30.3±7.6)岁。2组年龄差异无统计学意义(t=0.371,P>0.05)。人卵巢颗粒细胞KGN、人正常卵巢上皮细胞IOSE80均购自武汉大学生物典型培养物保藏中心;miR-141 minics及无义序列miR-141 Negative Control均购自上海吉玛制药技术有限公司;TRIzol、Lipofectamine 2000均购自美国Invitrogen公司;BCA蛋白定量及ECL发光检测试剂盒均购自大连宝生物工程有限公司;反转录试剂盒、SYBR premix Ex Taq试剂盒均购自日本TaKaRa公司;mTOR抑制剂雷帕霉素(rapamycin)、PI3K抑制剂LY294002均购自北京百奥莱博科技有限公司;PI3K、p-Akt、p-mTOR鼠抗人单克隆抗体及GAPDH抗体均购自美国Bioworld生物公司;羊抗鼠二抗购自武汉博士德生物公司;miR-141及U6引物由上海生工生物工程合成;荧光定量PCR仪购自韩国BIONEER公司;电泳仪购自北京六一生物科技有限公司。本研究经医院伦理委员会审核批准,所有参与者均知情并签署同意书。
1.2 实时荧光定量PCR(qPCR)检测miR-141mRNA表达水平 采用TRIzol试剂盒分别提取卵巢组织、KGN及IOSE80细胞总RNA,并检测RNA浓度和纯度,确定符合后续实验要求后采用反转录试剂盒合成cDNA。PCR反应总体积20 μL,包括1.5 μL cDNA模板,1 μL miR-141或U6引物,10 μL miRNA SYBR premix Ex Taq,7.5 μL H2O。反应条件:94℃预变性3 min;94℃20 s,60℃20 s,72℃40 s,循环40次。以U6为内参 ,采用2-ΔΔCt法分析卵巢组织及细胞miR-141mRNA的相对表达水平。引物序列见表1。

Tab.1 Primer sequence of qPCR表1 qPCR引物序列
1.3 细胞培养及分组 将KGN细胞置于含10%胎牛血清的RPMI-1640培养基,在37℃,5%CO2培养箱中进行培养。待细胞融合至90%时采用胰蛋白酶溶液消化传代处理,传至第3代时取对数生长期细胞进行实验。以2×105/孔的细胞密度接种至6孔板中继续培养,分为miR-141 minics组(转染miR-141 minics)、LY294002+miR-141 minics组(转染miR-141 minics前1 h采用50 mmol/L LY294002处理)、rapamycin+miR-141 minics组(转染miR-141 minics前1 h采用50 μmol/L rapamycin处理)、NC组(转染miR-141 Negative Control)、对照组(不做任何处理)。
1.4 MTT法检测各组细胞增殖情况 取对数生长期细胞消化成单细胞悬液,计数后制成1.5×105/mL悬液,细胞分组转染后以每孔100 μL加入到96孔板中,37℃、5%CO2细胞培养箱培养24 h,每组设6个平行孔,加入相同体积的溶媒作为空白对照,分别处理24、48、72、96 h后,每孔加入20 μL的MTT溶液,继续培养4 h后,弃去上清,每孔加入150 μL的DMSO溶解MTT,于490 nm处检测光密度(OD)值,以OD值为纵轴,培养时间为横轴,绘制细胞增殖曲线。
1.5 平板克隆实验进行细胞克隆形成能力检测 各组细胞转染后以200个/皿接种细胞培养皿内,置于培养箱中孵育14 d,待肉眼可见培养皿内有细胞克隆形成出现。PBS溶液洗涤干净后采用多聚甲醛溶液固定处理15 min,然后采用结晶紫溶液染色处理20 min,待风干后在荧光显微镜下随机读取5个视野计算细胞克隆数。细胞克隆形成率=细胞克隆数/接种细胞数×100%。
1.6 Western blot检测各组PI3K/Akt/mTOR信号通路相关蛋白表达 各组细胞转染48 h后提取细胞总蛋白,并定量检测蛋白含量,蛋白变性处理后电泳,然后将凝胶上的蛋白转至PVDF膜上,随后置于牛血清白蛋白中封闭4 h,取出PVDF膜后分别置于含PI3K、p-Akt、p-mTOR鼠抗人一抗及内参一抗(1∶500)的平皿中孵育过夜,然后将膜置于含羊抗鼠二抗(1∶500)的平皿中,继续室温环境下孵育处理2 h。最后TBS洗涤后显色、拍照和分析各条带灰度值,以GAPDH作为内参,以相对灰度值表示PI3K、p-Akt、p-mTOR蛋白的相对表达水平。
1.7 统计学方法 采用SPSS 22.0软件进行统计学处理,符合正态分布的计量资料用均数±标准差(±s)表示。多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同卵巢组织和细胞miR-141mRNA表达水平比较PCOS卵巢组织miR-141mRNA表达水平显著高于正常卵巢组织(2.47±0.41vs.1.12±0.30,n=20,t=11.884,P<0.05),人卵巢颗粒细胞KGNmiR-141mRNA表达水平高于人正常卵巢上皮细胞IOSE80(3.19±0.54vs.1.24±0.35,n=3,t=5.249,P<0.05)。
2.2 各组细胞转染后miR-141mRNA表达水平比较miR-141 minics组、LY294002+miR-141 minics组、rapamycin+miR-141 minics组、NC组及对照组miR-141mRNA表达水平分别为5.72±0.69、5.60±0.66、5.76±0.71、1.02±0.11和1.00±0.00,miR-141 minics组、LY294002+miR-141 minics组及rapamycin+miR-141 minics组miR-141mRNA表 达水平均高于NC组和对照组,差异有统计学意义(n=3,F=14.326,P<0.05)。
2.3 各组细胞转染后增殖和克隆形成能力比较LY294002+miR-141 minics组 及rapamycin+miR-141 minics组转染后24、48、72、96 h OD值和克隆形成率均低于miR-141 minics组,但高于NC组和对照组(P<0.05)。NC组、对照组转染后不同时间点OD值及克隆形成率比较差异无统计学意义,见表2、图1。
2.4 各组细胞转染后PI3K/Akt/mTOR信号通路相关蛋白表达水平比较miR-141 minics组、LY294002+miR-141 minics组 及rapamycin+miR-141 minics组PI3K蛋白表达水平比较差异无统计学意义,但均高于NC组和对照组(P<0.05)。LY294002+miR-141 minics组转染后p-Akt、p-mTOR蛋白表达水平低于miR-141 minics组,但高于NC组、对照组(P<0.05)。rapamycin+miR-141 minics组 转 染后p-mTOR蛋白表达水平低于miR-141 minics组,高于NC组、对照组(P<0.05),见表3、图2。
3 讨论
PCOS发病原因及机制极为复杂,具有较高的临床异质性,近些年关于卵巢颗粒细胞在PCOS发生、发展过程中的相关研究越来越多[10-11]。卵巢颗粒细胞可与卵母细胞发生缝隙连接,进而在卵母细胞的成长发育过程中发挥着重要作用,卵巢颗粒细胞明显增殖可导致PCOS的发生发展。miRNA广泛存在于机体各种脏器组织及细胞中,参与较多生物学功能的调节[12]。研究认为,miRNA在多个方面对PCOS发生产生影响,如影响卵泡生长发育或生理学功能、卵巢各种激素的调控作用、颗粒细胞增殖和凋亡等[13]。
Tab.2 Comparison of proliferation and cloning ability after transfection between the five groups表2各组转染后增殖和克隆形成能力比较 (n=3,±s)
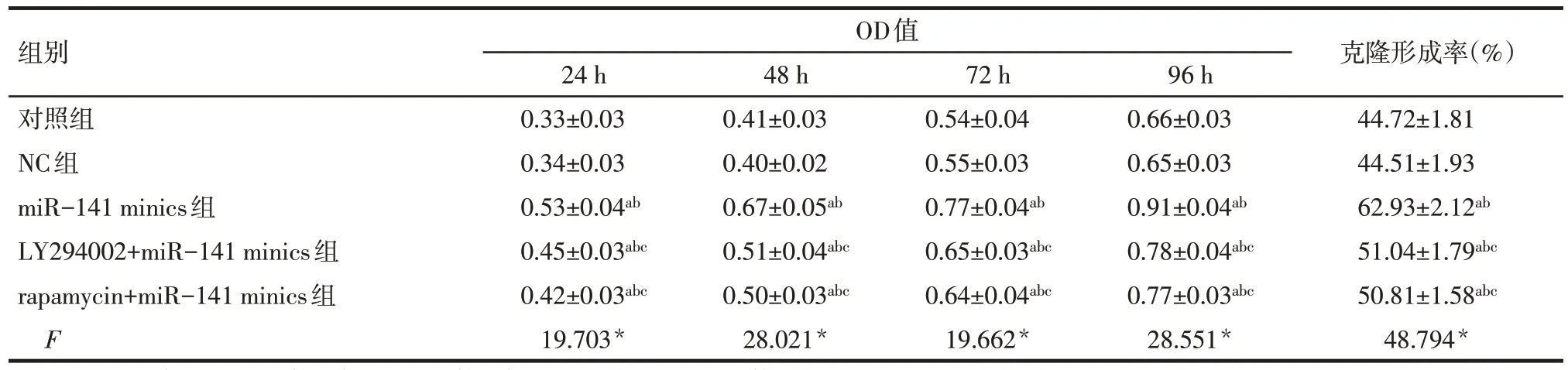
Tab.2 Comparison of proliferation and cloning ability after transfection between the five groups表2各组转染后增殖和克隆形成能力比较 (n=3,±s)
*P<0.05;a与对照组比较,b与NC组比较,c与miR-141minics组比较,P<0.05
组别OD值 克隆形成率(%)24 h48 h72 h96 h对照组0.33±0.030.41±0.030.54±0.040.66±0.0344.72±1.81 NC组0.34±0.030.40±0.020.55±0.030.65±0.0344.51±1.93 miR-141 minics组0.53±0.04ab0.67±0.05ab0.77±0.04ab0.91±0.04ab62.93±2.12ab LY294002+miR-141 minics组0.45±0.03abc0.51±0.04abc0.65±0.03abc0.78±0.04abc51.04±1.79abc rapamycin+miR-141 minics组0.42±0.03abc0.50±0.03abc0.64±0.04abc0.77±0.03abc50.81±1.58abc F 19.703*28.021*19.662*28.551*48.794*

Fig.1 Diagram of clone formation after transfection in each group图1各组转染后克隆形成图
Tab.3 Comparison of related protein expression levels of PI3K/Akt/mTOR signaling pathway after transfection between the five groups表3各组转染后PI3K/Akt/mTOR信号通路相关蛋白表达水平比较 (n=3,±s)

Tab.3 Comparison of related protein expression levels of PI3K/Akt/mTOR signaling pathway after transfection between the five groups表3各组转染后PI3K/Akt/mTOR信号通路相关蛋白表达水平比较 (n=3,±s)
*P<0.05;a与对照组比较,b与NC组比较,c与miR-141minics组比较,d与LY294002+miR-141 minics组比较,P<0.05
组别PI3Kp-Aktp-mTOR对照组0.22±0.060.32±0.080.32±0.09 NC组0.23±0.070.30±0.070.31±0.08 miR-141 minics组1.25±0.16ab1.16±0.16ab1.28±0.17ab LY294002+miR-1411.24±0.16ab0.75±0.11abc0.81±0.13abc minics组rapamycin+miR-1411.28±0.18ab1.18±0.17abd0.78±0.11abc minics组F 9.145*35.626*33.740*

Fig.2 The related protein expressions of PI3K/Akt/mTOR signaling pathway after transfection in each group图2各组转染后PI3K/Akt/mTOR信号通路相关蛋白表达
miR-141属于miR-200家族成员,位于人类染色体12p13.31,是一个全长为22个核苷酸的成熟序列[14]。既往研究发现,miR-141可作为癌基因或抑癌基因,通过调控相应信号转导通路在多种恶性肿瘤中呈异常表达,从而参与恶性肿瘤细胞的增殖、分化和迁移等生物学行为改变[15-17]。但是其在PCOS卵巢组织及卵巢颗粒细胞中表达的相关文献报道相对较少。本研究采用qPCR法检测显示,PCOS卵巢组织及人卵巢颗粒细胞KGN中miR-141mRNA表达水平均分别高于正常卵巢组织和人正常卵巢上皮细胞IOSE80,提示PCOS卵巢组织及卵巢颗粒细胞miR-141呈高表达状态,与既往研究相符[18]。本研究将KGN细胞进行分组研究,结果显示miR-141 minics组、LY294002+miR-141 minics组及rapamycin+miR-141 minics组miR-141mRNA表达水平比较无明显差异,且均高于NC组、对照组,提示miR-141 minics组、LY294002+miR-141 minics组及rapamycin+miR-141 minics组 细 胞 转 染miR-141 minics后miR-141mRNA表达水平均明显升高,且3组之间未因有PI3K/Akt/mTOR信号通路相关抑制剂作用而出现差异性表达。通过MTT法及平板细胞克隆法检测各组细胞转染后增殖和克隆形成能力,结果显示LY294002+miR-141 minics组及rapamycin+miR-141 minics组转染后不同时间点OD值及克隆形成率均明显低于miR-141 minics组,但高于NC组、对照组,提示miR-141mRNA表达水平升高可明显促进细胞的增殖和克隆形成能力,而采用PI3K/Akt/mTOR信号通路相关抑制剂作用后细胞增殖和克隆形成能力均受到明显抑制,miR-141可能通过PI3K/Akt/mTOR信号通路对人卵巢颗粒细胞KGN增殖过程产生影响。
PI3K/Akt/mTOR信号通路是一个参与调控机体内细胞增殖、凋亡最主要的信号传导通路,可参与调节卵母细胞生长,原始卵泡发育及颗粒细胞增殖、分化等生物学行为。PI3K被激活后可催化位于细胞膜内表面上的磷脂酰肌醇-4,5-二磷酸(PIP2),进而生成3,4,5-三磷酸磷脂酰肌醇(PIP3),后者可激活Akt,进而调节Bcl-2家族成员的生物学活性功能,最终发挥促进或抑制细胞凋亡的作用[19]。mTOR则是PI3K-Akt轴下游的丝氨酸-苏氨酸蛋白激酶,可有效促进或抑制细胞增殖,在调节卵泡发育过程中起着重要的作用[20]。本研究结果显示,miR-141 minics组、LY294002+miR-141 minics组及rapamycin+miR-141 minics组PI3K蛋白表达水平比较无明显差异,而LY294002+miR-141 minics组转染后p-Akt、p-mTOR蛋白表达水平明显低于miR-141 minics组,rapamycin+miR-141 minics组转染后p-mTOR蛋白表达水平明显低于miR-141 minics组,提示LY294002作用后可有效抑制p-Akt、p-mTOR蛋白表达水平,而rapamycin作用后可有效抑制p-mTOR蛋白表达水平,提示miR-141可通过激活PI3K/Akt/mTOR信号通路促进卵巢颗粒细胞的增殖。
综上所述,miR-141高水平表达可促进卵巢颗粒细胞的增殖,其作用机制与激活PI3K/Akt/mTOR信号通路有关。miR-141在PCOS卵巢组织中和卵巢颗粒细胞中表达量升高,可能与miR-141促进卵巢颗粒细胞增殖有关,本研究为后续的PCOS治疗提供了新的靶点和思路。
