茶树CsCYP79A1基因克隆及表达分析
2021-08-02何荟如林杰吴叶蝶潘泓静彭志松苏祝成
何荟如 林杰 吴叶蝶 潘泓静 彭志松 苏祝成

摘要:【目的】克隆茶树细胞色素P450(CYP)酶系的CYP79酶基因CsCYP79A1,并进行表达分析,为探究Cs-CYP79A1基因参与茶树防御的响应机制及在乌龙茶制作过程中的调控功能提供理论依据。【方法】克隆CsCYP79A1基因,通过生物信息学软件对其进行分析,用实时荧光定量PCR(qRT-PCR)检测其在不同茶树品种、不同嫩度叶片以及不同摇青次数叶片中的表达特性,并采用气相色谱—质谱联用仪(GC-MS)测定不同处理叶片中的苯乙腈释放量,以分析其与CsCYP79A1基因表达量的相关性。【结果】克隆获得的茶树CsCYP79A1基因编码区(CDS)序列长度为1617 bp,编码538个氨基酸残基,相对分子量为61.07 kD,理论等电点(pI)7.64,为不稳定的脂溶性亲水蛋白。CsCYP79A1蛋白与中华猕猴桃TXG46886.1的氨基酸序列相似性最高,达87%。CsCYP79A1蛋白存在2个跨膜结构,无信号肽,共有40个磷酸化位点,二级结构中α-螺旋、β转角、延伸链和无规则卷曲分别占氨基酸序列的49.07%、4.28%、11.71%和34.94%,三级结构与铁锈醇合酶的晶体结构(5ylw.1.A)相似度為26.61%。在4次摇青处理后,金萱和黄观音第3叶片中的CsCYP79A1基因表达量高于浙农113、白叶1号和福鼎大白茶,说明CsCYP79A1基因在适制乌龙茶的茶树品种中的表达量较高;CsCYP79A1基因在第3叶中的表达量显著高于第1叶和顶芽(P<0.05),且随着摇青次数的增加呈先升高后降低的变化趋势。4次摇青处理后,第3叶会释放大量苯乙腈,而第1叶和顶芽释放少量或不释放苯乙腈。苯乙腈的释放量随摇青处理次数的增加呈逐渐升高趋势。【结论】CsCYP79A1基因表达量与茶树品种、叶片嫩度和摇青次数密切相关,且其表达量和苯乙腈释放量均为第3叶最高,故推测CsCYP79A1基因是苯乙腈合成途径中的关键调控基因。
关键词: 茶树;CsCYP79A1;基因克隆;苯乙腈;生物信息学;表达分析
中图分类号: S571.103.53 文献标志码: A 文章编号:2095-1191(2021)03-0641-10
Cloning and expression analysis of CsCYP79A1 gene in tea plant
HE Hui-ru, LIN Jie, WU Ye-die, PAN Hong-jing, PENG Zhi-song, SU Zhu-cheng*
(College of Agriculture and Food Science, Zhejiang Agriculture and Forestry University,
Linan, Zhejiang 311300, China)
Abstract:【Objective】The CYP79 enzyme gene CsCYP79A1 of tea plant cytochrome P450(CYP) enzyme system was cloned,and its bioinformatics analysis and expression analysis were performed to provide a theoretical basis for in-depth understanding of the mechanism of CsCYP79A1 gene involved in the defense response of tea plant and its function in the production process of oolong tea. 【Method】The CsCYP79A1 gene was cloned using Huangguanyin leaves as materials,and the gene was analyzed by analysis softwares. Real-time fluorescent quantitative PCR(qRT-PCR) was used to detect its expression in different tea varieties ,different tenderness leaves and different shaking times to analyze its expression characteristics. Gas chromatography-mass spectrometry(GC-MS) was used to determine the volatilization of phenylacetonitrile in leaves of different treatments to analyze its relationship with the expression of CsCYP79A1 gene. 【Result】The cloned tea plant CsCYP79A1 gene coding region(CDS) was 1617 bp in length,encoded 538 amino acids,had a relative molecular mass of 61.07 kD and a theoretical isoelectric point(pI) of 7.64,and it was an unstable liposoluble hydrophilic protein. The amino acid sequence of CsCYP79A1 protein had the highest similarity with TXG46886.1 (Actinidia chinensis),reaching 87%. The CsCYP79A1 protein had two transmembrane structures,no signal peptide,and had 40 phosphorylation sites. In the secondary structure,α-helix,β turn,extended chain and random coil accounted for 49.07%,4.28%,11.71%,and 34.94% of the amino acid sequence,respectively. The similarity between the tertiary structure and the crystal structure of rust alcohol synthase(5ylw.1.A) was 26.61%. After four times shaking treatments,the expression of CsCYP79A1 gene in the third leaves of Jinxuan and Huangguanyin was significantly higher than that of Zhenong 113,Baiye No. 1 and Fuding Dabaicha,indicating that the expression level of CsCYP79A1 gene was higher in varieties which were suitable for making oolong tea. The expression level in the third leaves was significantly higher than that in the first leaves and terminal bud(P<0.05) and with the increase of the number of shaking,the expression level first increased and then decreased. After 4 shaking treatments,the third leaf released a large amount of phenylacetonitrile,while the first leaf and apical buds released a little or no phenylacetonitrile. In leaves with different shaking times,the volatilization of phenylacetonitrile increased with the increase of shaking times. 【Conclusion】The expression level of CsCYP79A1 gene is related to tea variety,leaf tenderness and the degree of shaking,and both the expression level and the release of phenylacetonitrile are the highest in the third leaf. Therefore,it is speculated that CsCYP79A1 gene is one of the key genes in the synthesis of phenylacetonitrile.
Key words: tea plant; CsCYP79A1; gene cloning; phenylacetonitrile; bioinformatics; expression analysis
Foundation item: National Natural Science Foundation of China(31800582);Zhejiang Agriculture and Forestry University Student Research Training Project(113-2013200155)
0 引言
【研究意义】茶树[Camellia sinensis(L.) O. Kuntze.]为多年生常绿木本植物,属山茶科山茶属灌木或小乔木,是我国重要的经济作物(刘玉飞等,2020)。苯乙腈(Phenylacetonitrile,PAN)是一种创伤诱导挥发物,在茶树受害虫侵害及乌龙茶做青时均会导致苯乙腈生成(蔡晓明,2009;唐颢等,2015;周春娟等,2015)。有研究证实,细胞色素P450(Cytochrome P450,CYP)酶系中的CYP79家族酶类可催化L-苯丙氨酸合成(E/Z)-苯乙醛肟(PAOx,phenylacetaldoxi-me),而(E/Z)-PAOx是苯乙腈的直接前体,苯乙腈的合成量受CYP79基因表达水平调控(Irmisch et al.,2013;Yamaguchi et al.,2016)。因此,挖掘并研究与苯乙腈合成相关基因对茶树栽培及乌龙茶制作具有重要意义。【前人研究进展】CYP是一类存在于微生物、植物和动物中的膜蛋白超家族酶系(宋展等,2020)。目前,已从不同生物体中分离出超过50000种CYP酶,而植物中的CYP酶主要参与保护性毒素、驱避剂分子和各种信号分子的生物合成(宋廷宇等,2010;宋展等,2020)。Irmisch等(2013)研究发现,在酵母中异源表达的杨树CYP79D6和CYP79D7基因均能产生不同醛肟的混合物。宋傲男等(2013)研究发现,甘蓝型油菜BnCYP79B1基因在高秆品系中的表达量较矮秆品系高,在高硫苷品系中较低硫苷品系高。王红波等(2014)研究发现,转拟南芥CYP79F1基因的西兰花植株过表达可显著增加短链脂肪族芥子油苷的含量。Luck等(2017)在酵母中克隆重组了红豆杉CYP79A118基因,结果发现其能将L-酪氨酸、L-色氨酸和L-苯丙氨酸分别转化为对羟基苯乙醛肟、吲哚-3-乙醛肟和苯乙醛肟,而L-酪氨酸是首选底物。李占省等(2018)研究发现,青花菜CYP79F1基因在根和茎中的表达量较高,叶中表达量最低。胡向阳等(2019)研究发现,菘蓝IiCYP79B2基因的表达受茉莉酸甲酯和葡萄糖信号的诱导,受水杨酸和低温胁迫的抑制。【本研究切入点】目前,鲜见有关茶树CsCYP79A1基因克隆并分析茶树品种、乌龙茶摇青次数和叶片嫩度等对其表达量影响的研究报道。【拟解决的关键问题】克隆CsCYP79A1基因,通过生物信息学软件对其进行分析,用实时荧光定量PCR(qRT-PCR)检测其在不同茶树品种、不同嫩度叶片以及不同摇青次数叶片中的表达特性,并采用气相色谱—质谱联用仪(GC-MS)测定不同处理叶片中的苯乙腈释放量,以分析其与CsCYP79A1基因表达量的相关性,为深入了解CsCYP79A1基因参与茶树的防御反应机制及乌龙茶制作的变化规律提供理论参考。
1 材料与方法
1. 1 试验材料
供试茶树材料为浙江农林大学茗茶园种植的黄观音新梢的顶芽、第1叶和第3叶(图1),以及白叶1号、福鼎大白茶、金萱和浙农113等4个茶树品种新梢的第3叶。黄观音和金萱为适制乌龙茶的茶树品种)。主要试剂:TaKaRa MiniBEST Plant RNA Extraction Kit(柱式法)试剂盒、PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒、TB Green? Premix Ex TaqTM II(Tli RNaseH Plus)及凝胶电泳有关试剂购自宝日医生物技术(北京)有限公司;高保真PCR酶KOD-Plus-Neo购自东洋纺(上海)生物科技有限公司;PCR引物合成和DNA测序由北京擎科生物科技有限公司完成;正己烷和癸酸乙酯试剂购自阿拉丁试剂(上海)有限公司;苯乙腈试剂购自上海麦克林生化科技有限公司。主要仪器设备:Biometra TOne基因扩增仪(耶拿,德国)、NanoDrop ND-2000超微量核酸蛋白测定仪(Thermo,美国)、StepOnePlus实时荧光定量PCR仪(Thermo,美国)和GCMS-QP2010PLUS气相色谱质谱联用仪(岛津,日本)。
1. 2 样品处理
将上述采集的供试材料摊放18 h后进行模拟摇青处理(即创伤处理),其中黄观音的顶芽和第1叶及白叶1号、福鼎大白茶、金萱和浙农113的第3叶均进行4次模拟摇青处理;黄观音的第3叶分别进行0、2、4、6和8次摇青处理(1次摇青处理是指用竹笼以30 r/min的速度對叶片进行7 min摇青),控制总摊青时间一致。处理结束后取部分样品于4 ℃冰箱保存,用于苯乙腈含量检测,剩下样品于-80 ℃冰箱保存,用于基因克隆及基因表达量检测,每份材料重复3次。
1. 3 总RNA提取及cDNA合成
采用TaKaRa MiniBEST Plant RNA Extraction Kit(柱式法)提取样品总RNA,并用1.5%琼脂糖凝胶电泳检测其完整性,用核酸检测仪检测其浓度和质量。待RNA质量检测合格后,按PrimeScriptTM RT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明将总RNA反转录合成cDNA。
1. 4 基因克隆
使用茶树基因组学与生物信息学平台(TPIA)(http://tpia.teaplant.org)上的在线序列比对软件,通过与其他植物中与苯乙腈合成途径有关的催化酶CYP79基因(CYP79D7、CYP79D6和CYP79A61)(Irmisch et al.,2013,2015)进行序列比对,并筛选获得CsCYP79A1基因。使用NCBI数据库的Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast)设计一对特异性扩增CsCYP79A1基因编码区(CDS)序列的引物(表1)。使用高保真PCR酶KOD-Plus-Neo对CsCYP79A1基因进行PCR扩增。扩增程序:94 ℃预变性2 min;98 ℃ 10 s,56 ℃ 30 s,68 ℃ 48 s,进行35个循环。PCR产物经1.5%琼脂糖凝胶电泳检测后,送至北京擎科生物科技有限公司测序。
1. 5 生物信息学分析
使用NCBI数据库的BLASTp查找茶树Cs-CYP79A1蛋白的同源氨基酸序列,并使用DNAMAN 6.0进行多重比对。使用MEGA 7.0的邻接法(Neighbor-joining method)构建系统发育进化树。使用ProtParam(https://web.expasy.org/protparam)对Cs-CYP79A1蛋白进行理化性质预测;使用ProtScale(选择Kyte & Doolittle法)(https://web.expasy.org/protscale)进行疏水性预测;使用TMHMM进行跨膜结构域预测;使用SignalP进行信号肽预测;使用NetPhos 3.1 Server进行磷酸化位点预测;使用SOPMA进行蛋白二级结构预测;使用Swiss-Model构建蛋白的三级结构模型。
1. 6 qRT-PCR检测
使用NCBI数据库的Primer-BLAST在线软件设计茶树CsCYP79A1基因的qRT-PCR引物(表1),以CsGAPDH为内参基因,按TB Green? Premix Ex TaqTM II(Tli RNaseH Plus)进行qRT-PCR,每样品设3次重复。
1. 7 苯乙腈释放量的测定
使用顶空固相微萃取法(HP-SPME)进行香气萃取:将各处理茶叶放入250 mL锥形瓶中,加入5 μL 0.01‰(v/v)的癸酸乙酯(内标),用锡纸和封口膜密封,置于加热器上60 ℃预热10 min,再插入萃取针,萃取20 min。采用GC-MS法测定苯乙腈释放量。GC条件:采用5 ms毛细色谱柱(30 m×0.25 mm×0.25 μm);进样口温度维持在220 ℃;升温程序为:初始柱温为50 ℃,保持5 min,以2 ℃/min升至120 ℃,以20 ℃/min升温至220 ℃,保持5 min,载气(He,纯度>99.999%)流速1.0 mL/min。MS条件:离子源EI,离子源温度200 ℃,电力电压70 eV,扫描质子质量范围(m/z)35~500 amu。苯乙腈峰采用质谱库结合标样来鉴定,峰面积采用内标进行校准。
1. 8 统计分析
使用Excel 2019和SPSS 26.0进行数据整理及分析。用2-ΔΔCt法计算目的基因的相对表达量,用Tukeys HSD法進行显著性分析(P<0.05)。相对表达量柱形图和苯乙腈释放量柱形图使用Origin 2017绘制。
2 结果与分析
2. 1 CsCYP79A1基因克隆结果
在TPIA搜索获得茶树品种舒茶早的CsCYP79A1基因全长3174 bp,CDS序列为1620 bp,编码539个氨基酸残基。本研究克隆获得的黄观音CsCYP79A1基因CDS长为1617 bp,编码538个氨基酸残基(图2),与舒茶早的CsCYP79A1基因相比,有26个位点的氨基酸存在差异。
2. 2 CsCYP79A1蛋白氨基酸序列比对及系统进化分析
通过BLASTp同源比对搜索,获得7条与Cs-CYP79A1蛋白同源性较高的序列,分别是中华猕猴桃(Actinidia chinensis var. chinensis)TXG46886.1、原叶杜鹃(Rhododendron williamsianum)CDP18411.1、红鸡蛋花(Plumeria rubra)KAA3489482.1、蓝果树(Nyssa sinensis)KAA8543655.1、油橄榄(Olea europaea var. sylvestris)XP_007146890.1、小粒咖啡(Coffea arabica)XP_027083154.1和长叶杜茎山(Maesa lanceolata)AHF22089.1,氨基酸序列相似性为78~87%。其中,CsCYP79A1蛋白氨基酸序列与中华猕猴桃TXG46886.1的相似性最高,达87%。使用DNAMAN 6.0对CsCYP79A1蛋白及其7个同源蛋白和1个拟南芥CYP79A2(Arabidopsis thaliana,AAF-70255.1)共9个蛋白进行氨基酸序列同源比对,结果如图3所示。这9个蛋白均具有P450典型的保守序列:K-螺旋(ExxR)、PERF结构域(PxRx)和血红素结合域(FxxGxxxCxG)(曹运鹏等,2016)。
为进一步了解茶树CsCYP79A1与其他植物之间的进化关系,用同源比对得到的水稻(Oryza sativa)XP_015633853.1及上述8个蛋白序列构建系统发育进化树,如图4所示。CsCYP79A1与中华猕猴桃、原叶杜鹃和长叶杜茎山的同源蛋白亲缘关系较近,与拟南芥和水稻的蛋白亲缘关系较远。
2. 3 CsCYP79A1蛋白理化性质预测结果
通过ProtParam预测茶树CsCYP79A1蛋白的理化性质,结果显示,CsCYP79A1蛋白分子式为C2752H4375N7370772S29,相对分子质量为61.07 kD,理论等电点(pI)为7.64,由538个氨基酸残基组成,其中亮氨酸(Leu)占比最高,为11.5%,色氨酸(Trp)和半胱氨酸(Cys)占比较低,均为1.5%;不稳定指数43.37,脂肪指数96.75,总平均疏水性值-0.122,为不稳定的脂溶性亲水蛋白。
使用ProtScale对CsCYP79A1蛋白的疏水性进行预测分析,结果如图5所示。疏水性最大值为2.911,位于第22位氨基酸,疏水性最小值为-2.711,位于第157位氨基酸,第0~50位氨基酸和第450~500位氨基酸均有1个典型的疏水性区域,在这些区域均存在一个跨膜结构,与TMHMM预测的蛋白跨膜结构结果一致。TMHMM预测结果(图6)显示,CsCYP79A1蛋白的1~3位氨基酸位于细胞膜外,4~27位氨基酸之间有一个跨膜螺旋区,28~474位氨基酸位于细胞膜内,474~497位氨基酸有一个跨膜螺旋区,497~538位氨基酸位于细胞膜外,推测CsCYP79A1蛋白是一个与细胞信号传递有关的膜受体蛋白。SignalP预测结果显示,CsCYP79A1蛋白无信号肽。
使用NetPhos 3.1 Server对CsCYP79A1蛋白的磷酸化位点进行预测,结果(图7)显示,CsCYP79A1蛋白多肽链上共有40个磷酸化位点,占氨基酸序列的7.4%,其中21个丝氨酸(Ser)位点,14个苏氨酸(Thr)位点和5个酪氨酸(Tyr)位点,主要能被蛋白激酶C(PKC)、细胞分裂周期蛋白2(cdc2)和酪蛋白激酶Ⅱ(CKⅡ)等蛋白激酶磷酸化。
2. 4 CsCYP79A1蛋白的二、三级结构预测结果
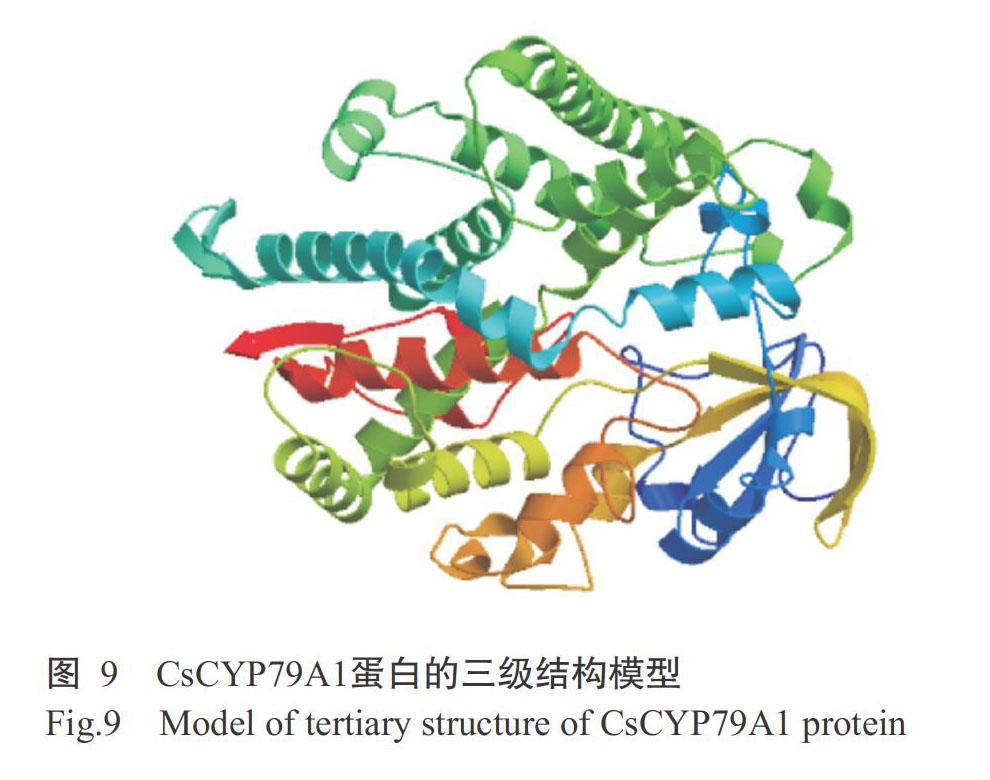
使用SOPMA对CsCYP79A1蛋白进行二级结构预测,结果如图8所示。CsCYP79A1蛋白含有264个α-螺旋、23个β转角、63个延伸链和188个无规则卷曲,分别占氨基酸序列的49.07%、4.28%、11.71%和34.94%。基于铁锈醇合酶的晶体结构(5ylw.1.A)对CsCYP79A1蛋白进行三级结构建模,结果(图9)显示,二者相似度为26.61%。
2. 5 CsCYP79A1基因表达分析结果
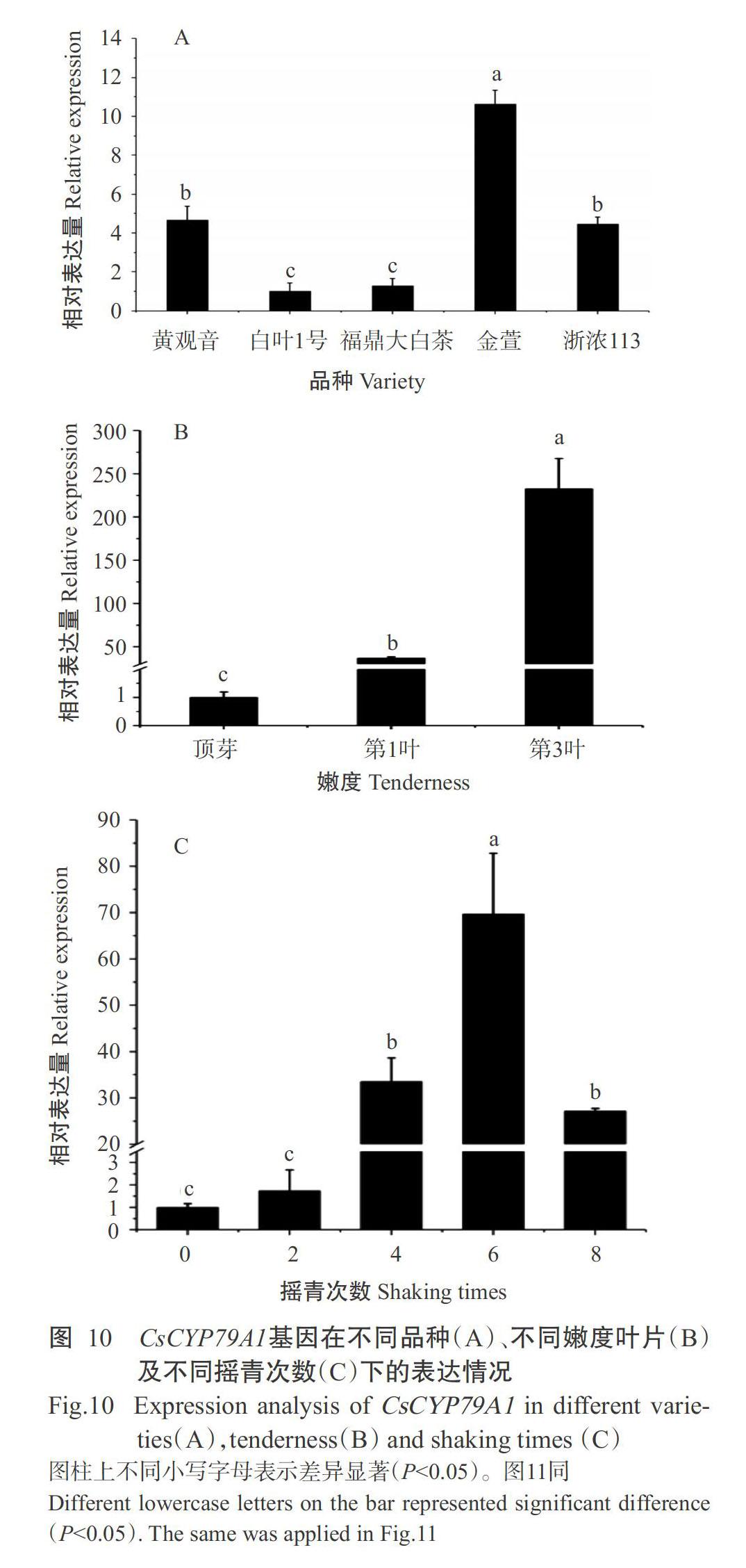
为探究CsCYP79A1基因在茶树叶片受伤害过程中的生物学功能和调控机制,对不同茶树品种的第3叶进行4次摇青处理后,检测其CsCYP79A1基因的相对表达量,结果如图10-A所示。在相同创伤程度下,金萱第3叶中的CsCYP79A1基因表达量显著高于其他品种(P<0.05,下同),其次为黄观音,与浙农113无显著差异(P>0.05,下同),白叶1号和福鼎大白茶第3叶中CsCYP79A1基因的表达量显著低于其他品种,说明CsCYP79A1基因在适制乌龙茶的茶树品种第3叶中的表达量较高。
对不同嫩度的黄观音叶片进行4次摇青处理后,检测CsCYP79A1基因的相对表达量,结果如图10-B所示。在相同创伤程度下,CsCYP79A1基因在第3叶、第1叶和顶芽中的相对表达量均存在显著差异,其中以第3叶的相对表达量最高,以顶芽的相对表达量最低。
对CsCYP79A1基因在不同摇青次数(即不同创伤程度下)叶片中的相对表达量进行检测,结果如图10-C所示。CsCYP79A1基因的表达量随摇青次数的增加呈先升高后降低的变化趋势,6次摇青叶中该基因的相对表达量最高,显著高于其他次数摇青叶;4次摇青叶中该基因的表达量高于8次摇青叶,但无显著差异,2次搖青叶中该基因的表达量高于0次摇青叶,但无显著差异。
2. 6 茶树叶片中苯乙腈的释放量测定结果
对不同嫩度叶片及不同摇青次数叶片中苯乙腈释放量进行测定,结果如图11所示。4次摇青处理后,第3叶会释放大量苯乙腈,峰面积达2.8×106,而第1叶释放少量苯乙腈,顶芽不释放苯乙腈(图11-A),表明苯乙腈在不同嫩度叶片中的释放量与Cs-CYP79A1基因表达特性一致,均为第3叶最高。此外,苯乙腈的释放量随摇青处理次数的增加呈逐渐升高趋势,当摇青次数为8次时,苯乙腈释放量为最大值,峰面积达4.7×106,显著高于其他摇青次数叶片的苯乙腈释放量(图11-B)。
3 讨论
本研究从茶树叶片中克隆获得与苯乙腈合成有关的CsCYP79A1基因,该基因的CDS长度为1617 bp,共编码538个氨基酸,含有CYP酶系特征序列:K-螺旋(ExxR)、PERF结构域(PxRx)和血红素结合域(FxxGxxxCxG)。目前,对CYP79家族基因的研究多集中在硫代葡萄糖苷、生氰糖苷类和腈类的生物合成关键酶的表达调控(Schuler and Werck-Reichhart,2003;宋傲男等,2013;Yuta and Yasuhisa,2014;王军伟等,2019)。CYP79家族基因大多参与氨基酸转化为相应乙醛肟的反应调控,如CYP79A2基因能调控苯丙氨酸向芳香族乙醛肟的转化,CYP79B1、CYP79B2和CYP79B3基因能调控色氨酸转化为3-吲哚-乙醛肟,CYP79F1和CYP79F2基因能调控甲硫氨酸衍生成脂肪族乙醛肟(Chen et al.,2003;宋傲男等,2013);也有研究表明CYP79家族基因中部分基因参与多种乙醛肟类化合物转化(Luck et al.,2017)。虽然本研究已证实CsCYP79A1基因与苯乙腈的合成有关,但是否参与苯丙氨酸向苯乙醛肟的转化还有待深入研究。
乌龙茶是中国六大茶类之一,具有馥郁的花果香气,其特殊香气的形成取决于摇青工艺(王赞和郭雅玲,2017)。本研究发现,随着摇青处理次数的增加,CsCYP79A1基因的表达量呈先升高后降低的变化趋势,6次摇青叶中该基因相对表达量最高。茶树基因表达库数据显示,随着茉莉酸甲酯(MeJA)对叶片处理时间的增加,CsCYP79A1基因表达量也呈先升高后降低的变化趋势,在处理24 h时相对表达量最高(Xia et al.,2019,2020),与本研究结果相似。已有研究表明,连续机械损伤也诱导其他香气相关基因的表达,如橙花叔醇合酶基因CsNES、色氨酸合酶基因CsTSA和芳樟醇合酶基因CsLISs(Zeng et al.,2016;Xin et al.,2017;Zhou et al.,2017)。实际生产中,不同摇青程度(摇青时间和摇青次数)的乌龙茶的香气滋味均存在明显差异,且有研究显示摇青程度加强,苯乙腈相对含量也随之升高(林郑和等,2015),但也有研究显示东方美人茶中苯乙腈相对含量低于冻顶乌龙茶,而冻顶乌龙茶低于文山包种茶,究其原因是这3种茶的摇青程度不同导致,即摇青程度:东方美人茶>冻顶乌龙茶>文山包种茶(廉明等,2015),说明茶叶中苯乙腈相对含量受茶叶原料、制作工艺等多重影响。
本研究分析摇青处理对不同茶树品种叶片CsCYP79A1基因的影响,结果显示,4次摇青处理后,金萱和黄观音叶片中的CsCYP79A1基因表达量高于浙农113、白叶1号和福鼎大白茶,说明在适制乌龙茶品种中的CsCYP79A1基因表达量较高。前人研究结果表明,不同嫩度叶片中的创伤防御体系不同(林毅芳和许信泉,2008;Ant?nio et al.,2013;Fang et al.,2016)。本研究发现,CsCYP79A1基因在第3叶中的相对表达量显著高于第1叶和顶芽,该结果从分子层面证实乌龙茶的制作原料应为具有一定成熟度的叶片。一般认为,茶树品种是茶叶品质特征形成的基础,不同品种加工成同类的茶叶也存在差异。对茶树品种的适制性研究主要集中于茶树嫩梢的物理特性和化学特性,乌龙茶适制品种评价指标包括叶宽、叶厚、栅栏组织厚度等8项性状(杨伟丽等,1993;张续周和周艳华,2020)。今后应深入挖掘参与茶树防御响应机制的基因,研究其在乌龙茶制作过程中的变化规律。
4 结论
CsCYP79A1基因表达量与茶树品种、叶片嫩度和摇青次数密切相关,且其表达量和苯乙腈释放量均为第3叶最高,故推测CsCYP79A1基因是苯乙腈合成途径中的关键调控基因。
参考文献:
蔡晓明. 2009. 三种茶树害虫诱导茶树挥发物的释放规律[D]. 北京:中国农业科学院. [Cai X M. 2009. The emission of tea plant volatiles induced by three herbivore insect pests[D]. Beijing:Chinese Academy of Agricultural Sciences.]
曹运鹏,程曦,程俊,闫冲冲,林毅,郭宁,蔡永萍. 2016. 砀山酥梨细胞色素P450的基因组学分析[J]. 核农学报,30(2):259-266. doi:10.11869/j.issn.100-8551.2016.02.0259. [Cao Y P,Cheng X,Cheng J,Yan C C,Lin Y,Guo N,Cai Y P. 2016. Genomics analysis of cytochrome P450 monooxygenase genes in Pyrus bretschneideri Rehd.[J]. Journal of Nuclear Agricultural Sciences,30(2):259-266.]
胡向阳,屈新运,吴格格,秦苗苗,刘蕊,高天娥,李焘. 2019. 菘蓝IiCYP79B2基因的克隆与表达分析[J]. 华北农学报,34(5):23-29. doi:10.7668/hbnxb.201751719. [Hu X Y,Qu X Y,Wu G G,Qin M M,Liu R,Gao T E,Li T. 2019. Cloning and expression analysis of IiCYP79B2 from Isatis indigotica Fort.[J]. Acta Agriculturae Boreali-Sinica,34(5):23-29.]
李占省,劉玉梅,方智远,杨丽梅,庄木,张扬勇,吕红豪. 2018. 青花菜P450CYP79F1全长克隆、表达及其与不同器官中莱菔硫烷含量的相关性分析[J]. 中国农业科学,51(12):2357-2367. doi:10.3864/j.issn.0578-1752.2018. 12.012. [Li Z S,Liu Y M,Fang Z Y,Yang L M,Zhuang M,Zhang Y Y,Lü H H. 2018. Full length cloning,expression and correlation analysis of P450 CYP79F1 gene with sulforaphane content in different broccoli organs[J]. Scientia Agricultura Sinica,51(12):2357-2367.]
廉明,吕世懂,吴远双,周降生,贺宜龙,王晨,孟庆雄. 2015. 三种不同发酵程度的台湾乌龙茶香气成分对比研究[J]. 食品工业科技,36(3):297-302. doi:10.13386/j.issn1002-0306.2015.03.054. [Lian M,Lü S D,Wu Y S,Zhou J S,He Y L,Wang C,Meng Q X. 2015. Comparative analysis of aroma characteristics of three kinds of Taiwan oolong tea from different fermentation degree[J]. Science and Technology of Food Industry,36(3):297-302.]
林毅芳,许信泉. 2008. 不同鲜叶嫩度与高香型铁观音品质形成的比较试验[J]. 茶叶科学技术,(2):18-19. doi:10. 3969/j.issn.1007-4872.2008.02.006. [Lin Y F,Xu X Q. 2008. Comparative test on the quality formation of diffe-rent fresh leaf tenderness and high-flavor Tieguanyin[J]. Tea Science and Technology,(2):18-19.]
林郑和,钟秋生,陈常颂,陈志辉,游小妹. 2015. 不同晒青和摇青程度对茶树新品系玉琼茶(606)制茶品质的影响[J]. 中国茶叶,37(11):17-19. doi:10.3969/j.issn.1000-3150.2015.11.007. [Lin Z H,Zhong Q S,Chen C S,Chen Z H,You X M. 2015. The effect of different degrees of drying and shaking on the tea quality of new tea strain Yuqiongcha(606)[J]. China Tea,37(11):17-19.]
刘玉飞,庞丹丹,李友勇,蒋会兵,陈林波. 2020. 茶树PIN基因家族的鉴定及表达分析[J]. 分子植物育种,18(23):7700-7710. doi:10.13271/j.mpb.018.007700. [Liu Y F,Pang D D,Li Y Y,Jiang H B,Chen L B. 2020. Identification and expression analysis of PIN family gene in Camellia sinensis[J]. Molecular Plant Breeding,18(23):7700-7710.]
宋傲男,程文财,刘彩霞,赵云,王茂林. 2013. 甘蓝型油菜BnCYP79B1基因的克隆与表达[J]. 西北植物学报,33(6):1085-1090. doi:10.3969/j.issn.1000-4025.2013.06. 003. [Song A N,Cheng W C,Liu C X,Zhao Y,Wang M L. 2013. Molecular cloning and expression analysis of BnCYP79B1 gene from Brassica napus L.[J]. Acta Botanica Boreali-Occidentalia Sinica,33(6):1085-1090.]
宋廷宇,侯喜林,吳春燕,何启伟,霍雨猛. 2010. 薹菜CYP79B_5基因的克隆及原核表达[J]. 南京农业大学学报,33(3):31-36. doi:10.7685/j.issn.1000-2030.2010. 03.006. [Song T Y,Hou X L,Wu C Y,He Q W,Huo Y M. 2010. Molecular cloning and prokaryotic expression of CYP79B_5 from tai-tsai[J]. Journal of Nanjing Agricultural University,33(3):31-36.]
宋展,高鑫,吴冕,路福平,秦慧民. 2020. 细胞色素P450酶的结构、功能与应用研究进展[J]. 微生物学通报,47(7):2245-2254. doi:10.13344/j.microbiol.china.200302. [Song Z,Gao X,Wu M,Lu F P,Qin H M. 2020. Structure,function,and application of cytochrome P450 enzymes[J]. Microbiology China,47(7):2245-2254.]
唐颢,唐劲驰,操君喜,周波,黎健龙,蔡娇. 2015. 凤凰单丛茶品质的海拔区间差异分析[J]. 中国农学通报,31(34):143-151. doi:10.11924/j.issn.1000-6850.casb15060056. [Tang H,Tang J C,Cao J X,Zhou B,Li J L,Cai J. 2015. Analysis of quality differences among Fenghuang Dancong tea in different altitude ranges[J]. Chinese Agricultural Science Bulletin,31(34):143-151.]
王红波,李成,曹阳理惠,李晶. 2014. CYP79F1基因对西兰花的遗传转化的研究[J]. 植物研究,34(4):516-523. doi:10.7525/j.issn.1673-5102.2014.04.015. [Wang H B,Li C,Cao Y L H,Li J. 2014. Genetic transformation of CYP79F1 gene in Brassica oleracea var. italica[J]. Bulletin of Botanical Research,34(4):516-523.]
王军伟,黄科,黄英娟,毛舒香,柏艾梅,刘明月,吴秋云. 2019. 十字花科蔬菜硫代葡萄糖苷合成相关转录因子调控研究进展[J]. 园艺学报,46(9):1752-1764. doi:10. 16420/j.issn.0513-353x.2019-0462. [Wang J W,Huang K,Huang Y J,Mao S X,Bai A M,Liu M Y,Wu Q Y. 2019. The research progress of transcription factors regulating glucosinolates biosynthesis in Cruciferous vegetables[J]. Acta Horticulturae Sinica,46(9):1752-1764.]
王赞,郭雅玲. 2017. 做青工艺对乌龙茶特征香气成分影响的研究进展[J]. 食品安全质量检测学报,8(5):1603-1609. doi:10.3969/j.issn.2095-0381.2017.05.013. [Wang Z,Guo Y L. 2017. Research progress on influence of green-making process on characteristic aroma components of oolong tea[J]. Journal of Food Safety and Quality,8(5):1603-1609.]
杨伟丽,何文斌,张杰,朱先明. 1993. 论适制乌龙茶品种的特殊性状[J]. 茶叶科学,13(2):93-99. doi:10.13305/j.cnki.jts.1993.02.003. [Yang W L,He W B,Zhang J,Zhu X M. 1993. Discussion on the special characters of suitable oolong tea varieties[J]. Journal of Tea Science,13(2):93-99.]
張续周,周艳华. 2020. 茶树新品种北茶36选育报告[J]. 中国茶叶,42(2):32-34. [Zhang X Z,Zhou Y H. 2020. Bree-ding report on a new tea variety ‘Beicha 36[J]. China Tea,42(2):32-34.]
周春娟,郭守军,庄东红,马瑞君,朱慧,吴清韩,李妙清,陈协忠. 2015. SDE-GC-MS与P & T-TD-GC-MS提取分析不同香型凤凰单丛茶香气比较[J]. 食品科学,36(18):137-142. doi:10.7506/spkx1002-6630-201518025. [Zhou C J,Guo S J,Zhuang D H,Ma R J,Zhu H,Wu Q H,Li M Q,Chen X Z. 2015. Comparison of simultaneous distillation extraction(SDE) with purge and trap thermal desorption(P & T-TD) for the analysis of aroma compounds in tea made from two cultivars of Fenghuang Dancong by gas chromatpraphy-mass spectrometry(GC-MS)[J]. Food Science,36(18):137-142.]
Ant?nio C M Q,Fernanda V C,Frederico S N,Marcílio F. 2013. Does leaf ontogeny lead to changes in defensive strategies against insect herbivores?[J]. Arthropod-Plant Interactions,7(1):99-107. doi:10.1007/s11829-012-9224-1.
Chen S X,Glawischnig E,J?rgensen K,Naur P,J?rgensen B,Olsen C E,Hansen C H,Rasmussen H,Pickett J A,Hal-kier B A. 2003. CYP79F1 and CYP79F2 have distinct functions in the biosynthesis of aliphatic glucosinolates in Arabidopsis[J]. The Plant Journal,33(5):923-937. doi:10.1046/j.1365-313X.2003.01679.x.
Fang Y J,Mei H L,Zhou B H,Xiao X H,Yang M,Huang Y C,Long X Y,Hu S N,Tang C R. 2016. De novo transcriptome analysis reveals distinct defense mechanisms by young and mature leaves of Hevea brasiliensis(para rubber tree)[J]. Scientific Reports,6(1):33151. doi:10.1038/srep33151.
Irmisch S,McCormick A C,Boeckler G A,Schmidt A,Reichelt M,Schneider B,Block K,Schnitzler J,Gershenzon J,Unsicker S B,K?llner T G. 2013. Two herbivore-induced cytochrome P450 enzymes CYP79D6 and CYP79D7 catalyze the formation of volatile aldoximes involved in poplar defense[J]. The Plant cell,25(11):4737-4754. doi:10.1105/tpc.113.118265.
Irmisch S,Zeltner P,Handrick V,Gershenzon J,K?llner T G. 2015. The maize cytochrome P450 CYP79A61 produces phenylacetaldoxime and indole-3-acetaldoxime in hetero-logous systems and might contribute to plant defense and auxin formation[J]. BMC Plant Biology,15(1):128-141. doi:10.1186/s12870-015-0526-1.
Luck K,Jia Q D,Huber M,Handrick V,Wong G K,Nelson D R,Chen F,Gershenzon J,K?llner T G. 2017. CYP79 P450 monooxygenases in gymnosperms:CYP79A118 is associated with the formation of taxiphyllin in Taxus ba-ccata[J]. Plant Molecular Biology,95(1-2):169-180. doi:10.1007/s11103-017-0646-0.
Schuler M A,Werck-Reichhart D. 2003. Functional genomics of P450s[J]. Annual review of plant biology,54:629-667. doi:10.1146/annurev.arplant.54.031902.134840.
Xia E H,Li F D,Tong W,Li P H,Wu Q,Zhao H J,Ge R H,Li R P,Li Y Y,Zhang Z Z,Wei C L,Wan X C. 2019. Tea plant information archive(TPIA):A comprehensive genomics and bioinformatics platform for tea plant[J]. Plant Biotechnology Journal,17(10):1938-1953. doi:10. 1111/pbi.13111.
Xia E H,Tong W,Hou Y,An Y L,Chen L B,Wu Q,Liu Y L,Yu J,Li F D,Li R P,Li P H,Zhao H J,Ge R H,Huang J,Mallano A I,Zhang Y R,Liu S R,Deng W W,Song C K,Zhang Z L,Zhao J,Wei S,Zhang Z Z,Xia T,Wei C L,Wan X C. 2020. The reference genome of tea plant and resequencing of 81 diverse accessions provide insights into genome evolution and adaptation[J]. Mole-cular Plant,13(7):1013-1026. doi:10.1016/j.molp.2020. 04.010.
Xin M,Liu X Y,Ying Z,Wang X Q,Zeng L T,Fu X M,Li J L,Tang J C,Fang D,Yang Z Y. 2017. Formation and emission of linalool in tea(Camellia sinensis) leaves infested by tea green leafhopper(Empoasca(Matsumurasca) onukii Matsuda)[J]. Food Chemistry,237:356-363. doi:10.1016/j.foodchem.2017.05.124.
Yamaguchi T,Noge K,Asano Y. 2016. Cytochrome P450 CYP71AT96 catalyses the final step of herbivore-induced phenylacetonitrile biosynthesis in the giant knotweed,Fallopia sachalinensis[J]. Plant Molecular biology,91(3):229-239. doi:10.1007/s11103-016-0459-6.
Yuta M,Yasuhisa A. 2014. Biosynthetic pathway for the cyanide-free production of phenylacetonitrile in Escherichia coli by utilizing plant cytochrome P450 79A2 and bacterial aldoxime dehydratase[J]. Applied and Environmental Microbiology,80(21):6828-6836. doi:10.1128/AEM. 01623-14.
Zeng L T,Zhou Y,Gui J D,Fu X M,Mei X,Zhen Y P,Ye T X,Du B,Dong F,Watanabe N,Yang Z Y. 2016. Formation of volatile tea constituent indole during the oolong tea manufacturing process[J]. Journal of Agricultural & Food Chemistry,64(24):5011-5019. doi:10.1021/acs.jafc. 6b01742.
Zhou Y,Zeng L T,Liu X Y,Gui J D,Mei X,Fu X M,Dong F,Tang J C,Zhang L Y,Yang Z Y. 2017. Formation of (E)-nerolidol in tea(Camellia sinensis) leaves exposed to multiple stresses during tea manufacturing[J]. Food Chemistry,231:78-86. doi:10.1016/j.foodchem.2017.03. 122.
(責任编辑 陈 燕)
