红花生育酚环化酶基因的克隆及表达分析
2016-11-19官丽莉崔琪韩雨彤武云云胡人阁顾
官丽莉+崔琪+韩雨彤+武云云+胡人阁+顾天瑶+李海燕+李校堃
[摘要]生育酚环化酶(tocopherol cyclase, TC)是植物Vit E生物合成途径的关键酶之一。该研究根据红花转录组数据,利用RT-PCR(reverse transcription-PCR)方法从药用植物红花种子中克隆得到生育酚环化酶基因序列,命名为CtTC, 对其进行生物信息学分析,结果表明该基因开放阅读框(ORF)为1 524 bp,编码507个氨基酸,相对分子质量为62.9 kDa,等电点(theoretical pI)为5.01。跨膜结构分析表明TC存在跨膜结构。蛋白糖基化位点分析表明TC蛋白含有1个丝氨酸糖基化位点以及1个苏氨酸糖基化位点。亚细胞定位表明其定位于叶绿体中。利用荧光定量PCR检测红花不同发育时期种子以及干旱胁迫不同时间的红花叶片中TC基因的表达量,结果表明TC基因在红花的开花后50 d的种子中表达量最高,干旱胁迫6 d时TC基因的表达量达到最高值,随后下降,为TC基因在红花Vit E合成以及抵抗逆境胁迫中的功能研究奠定基础。
[关键词]红花;生育酚环化酶;克隆;表达分析
[Abstract]The tocopherol cyclase was one of the key enzymes in plant vitamin E biosynthesis pathway. According to the study of Carthamus tinctorius transcriptome data,the Tocopherol cyclase gene was obtained using RT-PCR techniques and named CtTC . Bioinformatics analysis showed theopen reading frame (ORF)of CtTC was 1 524 bp. The putative protein contained 507 amino acids with a predicted molecular mass of 62.9 kDa and theoretically isoelectric point was 5.01.Signal peptide analysis showed that it was a non secretory protein, and there was no signal peptide. The subcellular localization showed that the CtTC protein was located in the chloroplast. The expression of CtTC gene in safflower seeds at different development stages was determined by quantitative real-time PCR, it was found that the highest expression level of CtTC gene was detected in 50 DAF.Quantitative RT-PCR analysis suggested that expression of CtTC is induced and strengthened by drought stresses. This research provided a candidate gene for metabolic engineering of vitamin E and resisting stress.
[Key words]Carthamus tinctorius; tocopherol cyclase; clone; expression analysis
doi:10.4268/cjcmm20162005
红花Carthamus tinctorius L, 又称草红花或刺红花, 为一年生或两年生菊科植物[1], 在中国大部分地方均有栽培, 主要分布于河南、 四川、 新疆、 浙江等地。红花籽,又称“白平子”,是传统中药红花的种子,李时珍在《本草纲目》中称其“功能与花同”[2]。红花籽中富含Vit E、不饱和脂肪酸等,被广泛应用于食品、保健品等领域。
红花中有效成分有黄酮类物质、不饱和脂肪酸、Vit E等,红花有效成分种类以及药理作用的研究已有大量报道[3-4]。近年来,随着新一代测序技术的广泛应用,人们从基因组、转录组角度对红花进行研究。刘秀明等[5]应用454测序技术对红花C. tinctorius初花期和盛花期2个样本进行转录组测序, 获得黄酮合成途径的关键酶基因包括查尔酮合酶(chalcone synthase, CHS;EC2.3.1.74)、查尔酮异构酶(chalcone isomerase, CHI;EC 5.5.1.6)和花青素合成酶(anthocyanidin synthase,ANS;EC 1.14.11.19)。Li等[6]以红花种子、花瓣、叶片为材料,进行了转录组分析,共注释了153 769条 unigene其中23 条unigene参与黄酮类化合物的合成8条unigene参与油体蛋白的合成。本课题组前期从红花C. tinctorius中克隆到一个红花Vit E 合成相关关键酶 2-甲基-6-叶绿基-1,4-苯醌甲基转移酶(MPBQ MT)基因[7]。
Vit E又名“生育酚”(tocopherol),是植物和光合微生物合成的一类脂溶性维生素,在人类和动物的日常膳食中起着不可或缺的作用Vit E包括生育酚和生育三烯酚2类共8种化合物,即α,β,γ,δ-生育酚(tocopherol)和α,β,γ,δ-生育三烯酚(tocotrinol),具有显著的抗氧化、抗肿瘤、抗衰老、预防心血管疾病、提高免疫力等多种功能[7]。获取Vit E所需的油料作物种子中虽然Vit E含量较多,但提取困难成本很大,市场上对天然Vit E的需求越来越大,并且植物的种子中主要的Vit E成分是δ-生育酚,但δ-生育酚生物活性很低,且不易于被人体吸收;生物活性高的Vit E成分为α-生育酚和γ-生育酚。因此,利用基因工程的方法提高作物中Vit E的含量,改进天然Vit E提取方法,成为目前植物Vit E代谢研究的热点。随着生物合成关键酶基因的克隆,生物工程已经成为提高植物Vit E含量的有效途径。生育酚环化酶(tocopherol cyclase,TC)是生育酚合成途径中的倒数第2个酶,它可以以MPBQ,DMPBQ为底物,分别生成易被人体吸收的α-生育酚和γ-生育酚;也可以以MGGBQ,DMGGBQ为底物[8],分别生成α-生育三烯酚和γ-生育三烯酚,是Vit E生物合成下游的关键酶之一。目前,TC的cDNA序列已在拟南芥Arobidopsis thalina L.、油菜Brassica campestris L.、大豆Glycine max等多种植物中得到克隆[9-15]。因此,TC基因的表达及活性对决定植物Vit E的组成起着重要作用,对培育高γ-生育酚和α-生育酚的新品系具有重要的指导意义。
本研究以红花种子为材料,利用课题组前期转录组测序文库中高表达的Uingene700为基础[6],利用RT-PCR技术克隆红花CtTC基因的cDNA序列,并对其序列进行生物信息学分析及表达分析,为人们深入了解TC基因在植物Vit E代谢途径的表达调控研究奠定基础。
1 材料
1.1 样品 红花C. tinctorius样品采自吉林农业大学种植基地,由吉林农业大学胡全德教授进行物种鉴定。取开花后5,15,30,50 d的新鲜种子用于表达分析,用开花后50 d种子(成熟种子)用于TC基因克隆。剪取花苞,取新鲜种子,迅速放于液氮中,锡箔纸包好后于-80 ℃保存备用。15% PEG 8000模拟干旱条件,对四叶期红花进行干旱胁迫,分别取胁迫0,2,4,6,8,10 d后的叶片,迅速放于液氮中,锡箔纸包好后于-80 ℃保存备用。
1.2 仪器与试剂 限制性内切酶、RNAiso Plus试剂、LA Taq 酶、高纯质粒小量制备试剂盒、 DNA 连接试剂盒、 DNA 纯化回收试剂盒、反转录试剂盒、 SYBR@Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)均购自宝生物工程(大连)有限公司,pEASY-T1载体、DH5α感受态细胞(Trans-T1)购自北京全式金生物技术有限公司。其他常规试剂均为国产或进口分析纯级。
2 方法
2.1 转录组数据分析 根据红花种子转录组数据分析结果,依据基因注释寻找TC基因对应的2个unigene(Unigene700l和Unigene54146)。通过NCBI ORF Finder在线预测,发现Unigene700_All对应的序列具有完整的开放阅读框。
2.2 RNA提取和cDNA合成 取红花各组织置于液氮中研碎,总RNA提取方法按照RNAiso Plus试剂说明书进行,提取后进行纯度及浓度测定;并于-80 ℃保存备用。cDNA合成根据宝生物工程(大连)有限公司反转录试剂盒操作进行,反转录产物分离纯化后置于-20 ℃保存备用。
2.3 红花TC基因的克隆 根据具有完整ORF的TC基因序列设计引物TC-F和TC-R。以反转录后的cDNA为模板进行TC基因ORF克隆。反应条件为:94 ℃预变性5 min;94 ℃ 30 s,62 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 10 min,4 ℃终止反应。获得目的基因的全长cDNA。对PCR产物进行回收,连接pEASY-T1 Vector,并转化DH5α感受态细胞,通过蓝白斑筛选后,挑取白色菌落过夜培养,提取质粒,PCR、双酶切鉴定重组子,然后测序(由上海生工生物工程公司完成)。
2.4 生物信息学分析 ORF Finder在线软件MPBQ MT基因cDNA的开放阅读框(ORF)与相应的氨基酸序列。将获得TC基因全长序列通过BLAST搜索NCBI的蛋白质和核苷酸数据库,并通过DNAMAN软件翻译成氨基酸序列,利用DNAMAN软件对来源于各种植物的生育酚环化酶(tocopherol cyclase, TC)的相关氨基酸序列进行同源比对。使用ChloroP服务器v1.1(http://www.cbs.dtu.dk/ services/ChloroP)进行叶绿体转运肽预测。相对分子质量与理论等电点(pI)预测采用ExPASy 在线服务器的Compute Pi/Mw 工具,二级结构预测使用 Dublin 大学的Porter 服务器,结构功能域分析采用ExPASy在线务器Prosite Scanprosite。
2.5 红花CtTC基因表达分析 提取开花后5,15,30,50 d的新鲜种子及干旱处理的红花叶片的RNA,并反转录为cDNA用于Real-time PCR分析。定量PCR反应体系为:SYBR Premix Ex Taq(Tli RNaseH Plus)(2×)10 μL;上下游引物(表1)各0.4 μL;ROX Reference Dye Ⅱ(50×);DNA模板2 μL;ddH2O 6.8 μL。反应条件为:95 ℃预变性30 s;95 ℃ 变性5 s, 60 ℃退火30 s, 40个循环。
3 结果分析
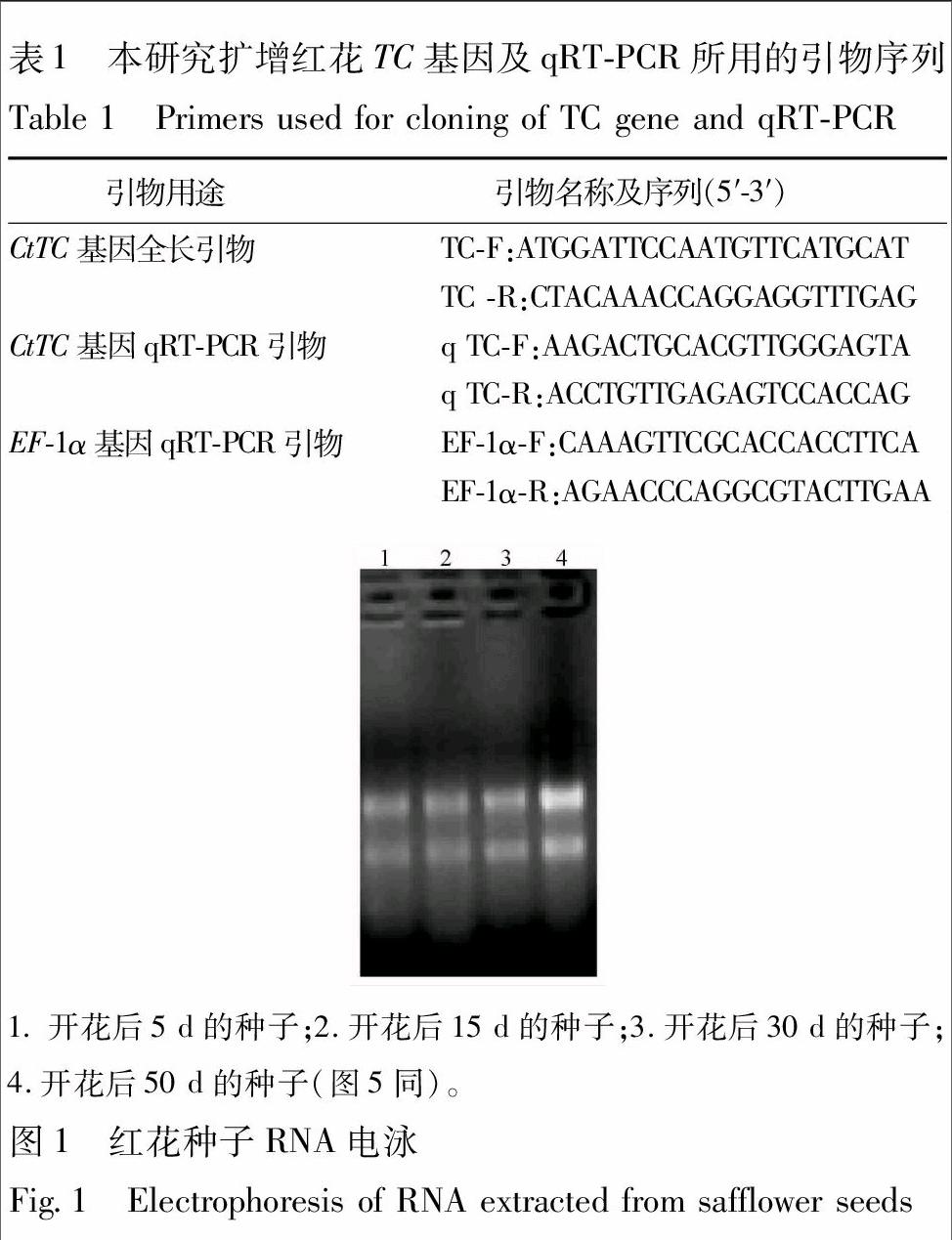
3.1 RNA提取 对不同发育时期的红花种子的总RNA进行浓度和纯度检测,得到的RNA质量浓度分别为150~210 mg·L-1,A260 /A280的比值为1.8~2.0,表明所提取的总RNA 完整性和纯度较好,可用于下一步实验(图1)。
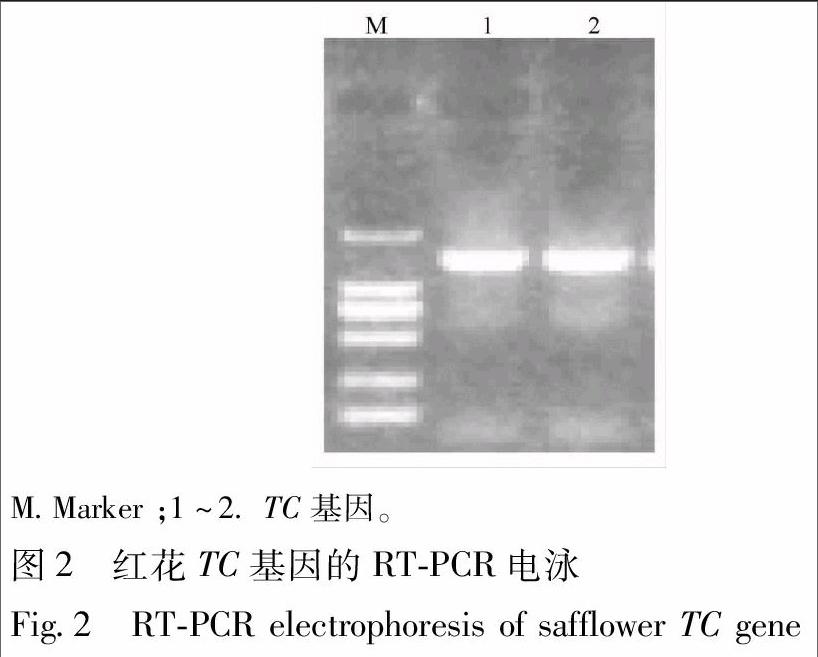
3.2 红花TC基因的克隆 根据CtTC基因编码区序列特异引物(TC-F,TC-R),以红花种子cDNA为模板扩增出一条1 524 bp的条带(图2A)。经回收
纯化后,PCR 产物与pEASY-T1载体连接, 通过菌液PCR验证(图2B) 和质粒的SpeⅠ和EcoRⅤ双酶切验证(图2C),测序结果正确,命名该基因为CtTC (Genbank登陆号 KX501215)。
3.3 CtTC蛋白理化性质分析 TC基因ORF长1 524 bp,利用 ExPASy Proteomics Server的在线软件 Protparam预测 CtTC编码蛋白的理化性质。CtTC蛋白包含507个氨基酸, 分子式为C4606H7690N1524O1944S298,总原子数为16 062。相对分子质量为62.905 kDa;理论等电点pI 5.01,带正电残基(Arg+Lys)为0,带负电残基 (Asp+Glu)为0。该蛋白的不稳定系数为43.08,表明CtTC编码蛋白不稳定。
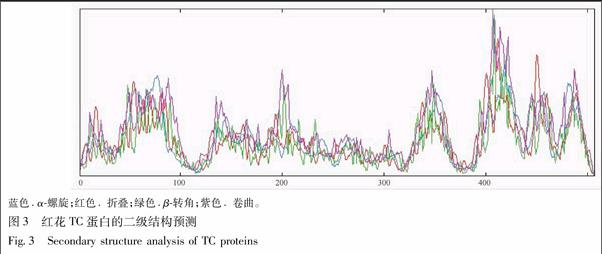
3.4 CtTC蛋白二级结构、跨膜区、亚细胞定位、糖基化位点预测分析 采用SWISS-MODEL(http://npsa-pbil.ibcp.fr/cgi-bin/secpred_sopm.pl) SOPMA 进行CtTC基因的编码蛋白二级结构分析和结构域预测(http://npsa-pbil.ibcp.fr/cgi-bin/ npsa_automat.pl?page=npsa_sopm.html)。CtTC的编码蛋白二级结构中α-螺旋 (alpha helix) 占20.9%、延伸链 (extended strand)占24.26%、β-折叠(beta turn)占14.4%、无规卷曲 (random coil)占40.43%(图3)。
跨膜螺旋分析(http://www.cbs.dtu.dk/services/TMHMM-2.0/)表明该蛋白为膜外蛋白。在线工具WOLF PSORT (http://wolfpsort.org/)预测该蛋白的亚细胞定位情况如下:chlo:8.0, cyto:3.0, nucl:2.0;表明该蛋白可能定位于叶绿体。使用ChloroP在线软件对叶绿体转运肽进行预测,结果表明CtTC蛋白含有叶绿体转运肽,为第1~57个氨基酸,推测该蛋白合成后运送到叶绿体并在此行使功能。
3.5 CtTC蛋白同源性及系统进化树分析 利用DNAMAN软件,将红花TC蛋白与Genbank中已公布的白梨(XP 009367482.1)、苹果(XP 008393882.1)、野草莓(XP 0094291189.1)、大豆(XP 003526485.1)、苜蓿(XP 013462012.1)、荷花(XP 010254049.1)、胡桃(AHH29648.1)、巨桉(XP 010049096.1)、古尼桉(AAP97931.1)、麻疯树(XP 012077416.1)、可可(XP 007012099.1)、木本棉(XP
KHF98490.1)、陆地棉(XP 012436528.1)、向日葵(ABB52812.1)、生菜(ADC91914.1)、芝麻(NP 001291340.1)、烟草(AIC85301.1)、林烟草(XP 009770568.1)的TC氨基酸序列进行同源比对,结果发现克隆到的红花TC基因与生菜Lactuca sativa的同源性最高,高达83%。从NCBI上搜索到其他19个物种的TC蛋白序列,利用MEGA5.1软件进行多重序列比对, 并构建系统发生树(图4)。结果表明,结果显示红花与向日葵、生菜的亲缘关系相对较近,而与芝麻、烟草亲缘关系相对较远。
3.6 红花TC基因的表达分析 分别取开花后5,15,30,50 d的新鲜种子提取RNA,反转录为cDNA。以18s rRNA为内参基因,采用Real-time PCR方法分析TC基因在红花种子不同发育时期的表达量。结果表明(图5),TC基因的表达量随着种子的发育逐渐升高,在开花后50 d(成熟种子)中达到最高。干旱胁迫条件下,发现干旱胁迫6 d时TC基因的表达量达到最高值,随后下降(图6)。
4 结论
生育酚环化酶是Vit E生物合成途径中的关键酶之一。本研究成功从红花中克隆得到一个TC基因,ORF长长度为1 524 bp,编码蛋白由507个氨基酸组成, 并且与其他植物TC蛋白具有较高的相似
性,所有的生物信息学分析表明CtTC属于生育酚环化酶家族。CtTC基因的分离鉴定为分子水平上深入了解该基因在Vit E生物合成途径中的作用奠定基础,为培育富含高活性Vit E转基因植物提供优质候选基因。
目前,大量的TC蛋白已在多种植物中发现。CtTC蛋白中的N端叶绿体转运肽的预测说明TC合成后运送到叶绿体并在此行使功能,这与Vidi等发现的生育酚是在植物的叶绿体中合成是一致的[16]。将不同植物的TC蛋白构建系统进化树,CtTC与同为菊科的生菜、向日葵TC蛋白聚为一类。研究表明,TC能够通过提高的α-生育酚含量和降低脂质过氧化水平,增强植物对干旱胁迫的耐受性[17]。大量的证据表明生育酚含量与植物对低温、干旱、盐胁迫呈现正相关关系[18-20]。胁迫条件下诱导Vit E合成途径基因的表达能够增强生育酚的积累,而这些基因包括TC基因对于不同的胁迫可能引起不同的反应[21-22]。荧光定量PCR结果表明,CtTC基因的表达量随着种子的发育逐渐升高,在红花开花后50 d的种子中表达丰度最高;干旱胁迫6 d时TC基因的表达量达到最高值,随后下降,说明更多的生育酚环化酶积累并参与Vit E的合成,Vit E可做为一种抗氧化剂,有效减弱干旱胁迫等条下件植物细胞膜与蛋白的氧化损伤。本研究对CtTC基因在氧化应激条件下的表达谱进行分析,结合上述蛋白序列的生物信息学分析,结果揭示CtTC在一定程度上应答氧化应激的潜在功能。
然而,有关CtTC参与Vit E生物合成的分子调控机制还有待进一步深入研究。在后续研究中,通过原核表达、超表达或抑制CtTC基因在植物中的表达,结合Vit E含量变化、红花抗逆性的研究等对该基因进行功能验证,为后续红花Vit E的代谢调控研究奠定基础。
[参考文献]
[1]江苏新医学院. 中药大辞典[M]. 上海:上海科学技术出版社,1986.
[2]李时珍. 本草纲目. 上册[M]. 北京:人民卫生出版杜,1977.
[3]易善勇,官丽莉,杨晶,等. 红花药理作用及其开发与应用研究进展[J]. 北方园艺,2015(5):191.
[4]Matthaus B, Ozcan M M, Juhaimi F Y. Fatty acid composition and tocopherol profiles of safflower(Carthamus tinctorius L. ) seed oils [J]. Nat Prod Res, 2015, 29(2):193.
[5]刘秀明, 张宇,姚娜,等. 红花(Carthamus tinctorius L. )不同开花时期的转录组测序及黄酮合成相关基因的验证[J]. 中国细胞生物学杂志,2015,37(9):1207.
[6] Li Haiyan, Dong Yuanyuan, Yang Jing, et al. De novo transcriptome of safflower and and the identification of putative genes for oleosin and the biosynthesis of flavonoids [J]. PLoS ONE, 2012, 7:1.
[7]代斯宁, 王文玲, 韩怡来, 等. 红花2-甲基-6-叶绿基-1,4-苯醌甲基转移酶基因的克隆及表达分析[J]. 中草药, 2015,46(18):2774.
[8]Rebeiz C A,Benning C,Bohnert H J, et al. Advances in photosynthesis and respiration (volume 31):the chloroplast:basics and applications [M]. Dordrecht:Springer, 2010.
[9]Shintani D K, Cheng Z, DellaPenna D. The role of 2-methyl-6-phytylbenzoquinone methyltransferase in determining tocopherol composition in Synechocystis sp. PCC6803[J]. FEBS Lett, 2002, 511:1.
[10] Porfirova S, Bergmuller E, Tropf S, et al. Isolation of an Arabidopsis mutant lacking vitamin E and identification of a cyclase essential for all tocopherol biosynthesis[J]. Proc Natl Acad Sci USA, 2002,99:12495.
[11] Alison L, Van E, Kim L, et al. Engineering vitamin E content:from Arabidopsis mutant to soy oil [J]. Plant Cell, 2003, 15:3007.
[12] Dahnhardt D, Falk J, Appel J, et al. The hydroxyphenylpyruvate dioxygenase from Synechocystis sp. PCC 6803 is not required for plastoquinone biosynthesis [J]. FEBS Lett, 2002, 523:177.
[13] 徐妙云, 周建, 张兰, 等. 大豆2-甲基-6-植基-1,4-苯醌甲基转移酶基因(GmVTE3)的克隆及对转基因烟草种子中生育酚组成的影响[J]. 中国农业科学, 2010,43(10):1994.
[14]郭安强, 万勇善, 刘风珍, 等. 花生 2-甲基-6-植基-1,4-苯醌甲基转移酶基因VTE3的克隆及多态性分析[J]. 中国农业科学,2012,45(9):1685.
[15]王灿灿, 杨克强, 孙翠, 等. 核桃Vit E代谢相关基因jrVTE3的克隆与分析[J]. 山东农业大学学报:自然科学版,2013,44(2) :159.
[16]Vidi P A, Kanwischer M, Baginsky S, et al. Tocopherol cyclase (VTE1) localization and vitamin E accumulation in chloroplast plastoglobule lipoprotein particles[J]. J Biol Chem, 2006, 281:11225.
[17]Liu X, Hua X, Guo J, et al. Enhanced tolerance to drought stress in transgenic tobacco plants overexpressing VTE1 for increased tocopherol production from Arabidopsis thaliana[J]. Biotechnol Lett,2008,30:1275.
[18]Yamaguchi-Shinozaki K,Shinozaki K. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought, low-temperature, or high-salt stress[J]. Plant Cell,1994,6:251.
[19]Guo J, Liu X, Chen S, Jin Z, et al. Overexpression of VTE1 from Arabidopsis resulting in high vitamin E accumulation and salt stress tolerance increase in tobacco plant[J]. Appl Environ Biol,2006,12:468.
[20]Munne B S, Schwarz K,Alegre L. Enhanced formation of alpha-tocopherol and highly oxidized abietane diterpenes in water-stressed rosemary plants[J]. Plant Physiol, 1999, 121:1047.
[21]Kanwischer M, Porfirova S, Bergmuller E, et al. Alterations in tocopherol cyclase activity in transgenic and mutant plants of Arabidopsis affect tocopherol content, tocopherol composition, and oxidative stress[J]. Plant Physiol, 2005,137:713.
[22]Abbasi A R, Hajirezaei M, Hofius D, et al. Specific roles of alpha- and gamma- tocopherol in abiotic stress responses of transgenic tobacco[J]. Plant Physiol,2007,143:1720.
[责任编辑 吕冬梅]
