桃叶珊瑚苷通过AMPK/NLRP3通路对心肌梗死大鼠心功能的影响及机制*
2021-08-02马蒂达吴洋王显苏玉强顾勇
马蒂达, 吴洋, 王显, 苏玉强, 顾勇
(1.陕西中医药大学 第一临床医学院, 陕西 西安 710024; 2.北京中医药大学 第一临床医学院, 北京 100029; 3.北京中医药大学东直门医院 心内科, 北京 100700; 4.西安医学院 临床医学院, 陕西 西安 710021; 5.苏州大学 临床医学院, 江苏 苏州 215021)
心肌梗死(myocardial Infarction,MI)引起的心源性猝死是心脏疾病患者常见的死亡原因,梗死所致缺血缺氧可引起心肌细胞功能及代谢紊乱、氧自由基大量产生、细胞凋亡等病理变化,导致心肌细胞形态变化及心室重塑,在心力衰竭的发生和发展中占有重要地位[1-2]。桃叶珊瑚苷为传统中药杜仲和玄参等的提取物,具有抗氧化、抗凋亡、抗炎等作用[3]。细胞实验表明,桃叶珊瑚苷可以改善血管内皮细胞炎症损伤、抑制心肌细胞凋亡、减少心肌纤维细胞胶原合成[4-6]。动物实验表明,桃叶珊瑚苷可调节氧化应激、减少活性氧的积累、减轻MI小鼠心脏重塑[7]。由于中药具有多靶标的特点,因此推测桃叶珊瑚苷还可能通过其他方式发挥心脏保护作用。NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体在MI中具有重要作用,且抑制NLRP3可减轻炎症反应,并改善急性MI动物模型中的心肌功能障碍和重塑[8]。另有研究显示,抑制AMP活化的激酶(AMP-activated protein kinase,AMPK)通路可促进NLRP3/半胱氨酸酶(caspase1)小体活化,启动细胞焦亡[9]。为探讨桃叶珊瑚苷对NLRP3/caspase1小体介导的细胞焦亡的影响,本研究采用冠状动脉左前降支结扎法建立大鼠MI模型,观察模型鼠心功能、组织学及某些炎症因子的表达水平,报告如下。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级SD大鼠,雄性,体质量220~250 g,购自江苏百奥赛图生物公司,许可证[SCXK(苏)2016-0004]。饲养温度(25±1)℃、湿度(55±5)%,12 h光照12 h黑暗条件下适应饲养1周。本研究经医院实验动物伦理委员会批准(批准文号19001-6)且操作过程遵循动物保护3R原则。
1.1.2主要试剂及仪器 桃叶珊瑚苷(纯度99.01%)、AMPK抑制剂Dorsomorphin(Compound C,CC,纯度99.82%),购自Selleck chemicals公司;小鼠源凋亡相关斑点样蛋白(apotosis-associated speck-like protein,ASC)及β-actin抗体,购自Santa cruz公司;DAPI试剂、兔源AMPK、pro-caspase-1、胃泌素D-N(GSDMD-N)、NLRP3、p-AMPK抗体、羊源NLRP3抗体、驴抗羊IgG Alexa Fluor®488及羊抗兔IgG(Alexa Fluor®594)抗体,均购自Abcam公司;兔源cleaved-caspase-1购自Affinity Biosciences公司;羊抗兔、马抗小鼠IgG(辣根过氧化物酶)抗体、兔源TXNIP抗体购自CST公司;红四氮唑(TTC)、苏木素伊红(HE)染色试剂、伊文思蓝(EB)、大鼠乳酸脱氢酶(LDH)、白介素(IL)-1β和IL-18 ELISA购自上海生工生物公司;荧光显微镜购自Olympus公司;酶标仪、电泳和转膜系统均购自美国BioRad公司;MyLab 30CV超声成像仪购自Biosound Esaote公司。
1.2 研究方法
1.2.1模型制备 参照文献[10]构建大鼠MI模型。采用腹腔注射1%戊巴比妥钠(60 mg/kg)将大鼠麻醉,监测心电图并连接呼吸机(潮气量15 mL/kg,呼吸频率70次/min),打开左侧胸廓,暴露冠状动脉左前降支,采用5.0丝线结扎冠状动脉和静脉,观察到左心室前壁心肌由红变白、心电图ST段抬高,代表成功复制MI模型。心脏迅速复位,缝合皮肤手术切口并消毒,连续3 d注射青霉素抗炎治疗,正常喂养。若造模大鼠因死亡导致数量不足,则取备用大鼠补充,保证每组大鼠至少15只。另取15只大鼠仅暴露冠状动脉不结扎,为假手术(Sham)组。
1.2.2大鼠分组及给药 将MI大鼠分组为:MI组、MI+桃叶珊瑚苷组和MI+桃叶珊瑚苷+抑制剂组,每组15只。术后第4天,开始对MI组、MI+桃叶珊瑚苷组和MI+桃叶珊瑚苷+抑制剂组大鼠分别给予生理盐水灌胃、100 mg/kg桃叶珊瑚苷灌胃、100 mg/kg桃叶珊瑚苷灌胃+0.2 mg/kg CC尾静脉注射治疗[11],Sham组给予生理盐水灌胃,1次/d,连续14 d,进行后续实验。
1.2.3超声心动图检查 麻醉大鼠后,彩色超声心动图记录左室射血分数(left ventricular ejection fraction,LVEF)、左室收缩压(LV systolic pressure,LVSP)、左室收缩末期容积(LV end-systolic volume,LVESV)、左室短轴缩短率(LV fractional shortening,LVFS)、左室舒张压(LV end-diastolic pressure,LVEDP)、左室舒张末期容积(LV end-diastolic volume,LVEDV)各项指标,测量3个连续心动周期,计算平均值。
1.2.4TTC-EB检测 各组大鼠均随机取5只过量麻醉处死,经颈总动脉逆行注射0.5% EB溶液1 mL,分离取出心脏,于-20 ℃过夜保存。第2天,横向将左心室切为5片(厚约2 mm)浸没于37 ℃ 1%、TTC溶液孵育20 min,用4%多聚甲醛固定后采用ImageProPlus分析各心脏切片梗死面积、计算梗死体积(正常心肌组织呈蓝色,缺血心肌组织呈红色,梗死心肌组织呈白色)。
1.2.5HE染色观察 过量麻醉处死各组剩余10只大鼠,分离取出心脏,摘除脂肪等非心肌组织,于心室直径最大处(包括梗死部分)取心肌组织,用4%多聚甲醛固定24 h,石蜡包埋,切成5 μm切片待测;另取余下梗死处及边缘心肌组织切碎,经液氮速冻后移至-80 ℃保存。
1.2.6免疫荧光法检测 采用1.2.5中的心肌切片经脱蜡、抗原修复、通透后,采用2%山羊血清封闭,加入兔源cleaved-caspase1(1 ∶300)和羊源NLRP3(1 ∶200)一抗溶液4 ℃孵育过夜,避光加入羊抗兔IgG Alexa Fluor®594(1 ∶500)和驴抗羊IgG Alexa Fluor®488(1 ∶500)二抗溶液孵育50 min,避光加入DAPI试剂孵育5 min,加入封闭液封片后在荧光显微镜下观察并记录焦亡心肌数量,计算焦亡心肌细胞比例,每组至少10张切片,每个切片至少5个视野。
1.2.7心肌组织匀浆中IL-1β、IL-18及LDH水平 采用酶联免疫吸附试验(ELISA)检测 取“1.2.5”项下中心肌冷冻样品,制备匀浆液,加入IL-1β、IL-18及LDH的 ELISA试剂盒中相应工作液、终止液后,于酶标仪450 nm处检测各反应孔吸光值,计算心肌匀浆液中IL-1β、IL-18及LDH水平。
1.2.8心肌相关蛋白表达水平 采用Western blot法检测,取1.2.5中心肌组织(80 mg)在液氮中研磨,与RIPA试剂孵育后分离上清,使用BCA试剂盒定量上清中蛋白质含量。均取30 μg蛋白经过SDS-PAGE处理电泳分离后转移到硝酸纤维素膜上,5%牛血清蛋白封闭膜,在4 ℃下于AMPK(1 ∶2 000)、p-AMPK(1 ∶2 000)、GSDMD-N(1 ∶2 000)、pro-caspase1(1 ∶4 000)、NLRP3(1 ∶4 000)、ASC(1 ∶3 000)、cleaved-caspase1(1 ∶3 000)及β-actin(1 ∶5 000)抗体中孵育过夜;洗膜并在室温下于抗兔或小鼠IgG二抗(1 ∶5 000)中孵育60 min。使用ECL试剂显色后经软件分析条带灰度值,以β-actin作为内参照,计算AMPK、p-AMPK、pro-caspase1、NLRP3、ASC、cleaved-caspase1及GSDMD-N蛋白相对表达水平。
1.3 统计学分析
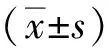
2 结果
2.1 心功能指标
与Sham组相比,MI组、MI+桃叶珊瑚苷+抑制剂组LVEF、LVSP及LVFS降低,LVESV、LVEDP、LVEDV升高(P<0.05);与MI组相比,MI+桃叶珊瑚苷组LVEF、LVSP、LVFS升高,LVESV、LVEDP、LVEDV降低(P<0.05);与MI+桃叶珊瑚苷组相比,MI+桃叶珊瑚苷+抑制剂组LVEF、LVSP、LVFS降低,LVESV、LVEDP、LVEDV升高(P<0.05)。见表1。

表1 各组大鼠心功能指标比较Tab.1 Comparison of cardiac function indexes among rats in each
2.2 心肌梗死体积
结果显示,Sham组心肌无梗死;与Sham组相比,MI组、MI+桃叶珊瑚苷+抑制剂组心肌梗死体积增加(P<0.05);与MI组相比,MI+桃叶珊瑚苷组心肌梗死体积减少(P<0.05);与MI+桃叶珊瑚苷组相比,MI+桃叶珊瑚苷+抑制剂组心肌梗死体积增加(P<0.05)。见图1和表2。
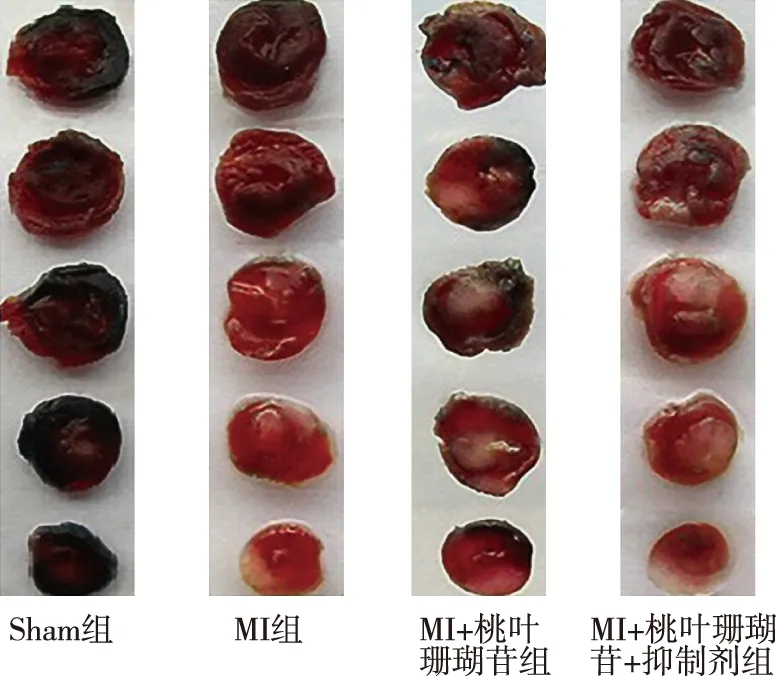
图1 大鼠心肌TTC-EB染色结果Fig.1 TTC-EB staining results of myocardium in rats

表2 各组大鼠心肌梗死体积比较Tab.2 Myocardial infarction size of rats among rats in each
2.3 心肌组织学
如图2所示,Sham组心肌细胞排列正常,形态结构清晰,无坏死和炎症细胞浸润;MI组、MI+桃叶珊瑚苷+抑制剂组心肌细胞增大且排列混乱,可见大量炎症细胞和部分血管扩张充血;MI+桃叶珊瑚苷组心肌形态结构较MI组、MI+桃叶珊瑚苷+抑制剂组清晰,心肌损伤程度较MI组、MI+桃叶珊瑚苷+抑制剂组减轻。

注:箭头为炎性浸润,蓝色箭头为血管充血。图2 各大鼠心肌细胞形态(HE,×200)Fig.2 Cardiomyocyte morphology among rats in each group (HE, ×200)
2.4 心肌细胞焦亡情况
结果显示,Sham组几乎没有焦亡心肌细胞;与Sham组相比,MI组、MI+桃叶珊瑚苷+抑制剂组心肌细胞焦亡比例增加(P<0.05);与MI组相比,MI+桃叶珊瑚苷组心肌细胞焦亡比例降低(P<0.05);与MI+桃叶珊瑚苷组相比,MI+桃叶珊瑚苷+抑制剂组心肌细胞焦亡比例增加(P<0.05)。见表3和图3。

表3 各组大鼠焦亡心肌细胞比例Tab.3 Ration of pyroptotic cardiomyocytes among rats in each
2.5 心肌匀浆中LDH及炎症因子水平
与Sham组相比,MI组、MI+桃叶珊瑚苷+抑制剂组IL-1β、IL-18及LDH水平增高,差异均有统计学意义(P<0.05);与MI组相比,MI+桃叶珊瑚苷组IL-1β、IL-18及LDH水平降低,差异均有统计学意义(P<0.05);与MI+桃叶珊瑚苷组相比,MI+桃叶珊瑚苷+抑制剂组IL-1β、IL-18及LDH水平增加,差异均有统计学意义(P<0.05)。见表4。

表4 各组大鼠心肌匀浆中LDH、IL-1β及IL-18水平Tab.4 LDH,IL-1β,and IL-18 levels in myocardial homogenates among rats in each
2.6 AMPK/NLRP3通路相关蛋白表达
与Sham组相比,MI组、MI+桃叶珊瑚苷+抑制剂组ASC、NLRP3、cleaved/pro-caspase1及GSDMD-N蛋白水平增高,p-AMPK/AMPK蛋白水平降低(P<0.05);与MI组相比,MI+桃叶珊瑚苷组ASC、NLRP3、cleaved/pro-caspase1及GSDMD-N蛋白水平降低,p-AMPK/AMPK水平增高(P<0.05);与MI+桃叶珊瑚苷组相比,MI+桃叶珊瑚苷+抑制剂组ASC、NLRP3、cleaved/pro-caspase1及GSDMD-N蛋白水平增加,p-AMPK/AMPK蛋白水平降低(P<0.05)。见表5和图4。

表5 各组大鼠心肌组织AMPK/NLRP3通路相关蛋白表达水平Tab.5 The expression levels of AMPK/NLRP3 pathway related proteins in myocardial tissues among rats in each

注:箭头所指为焦亡心肌细胞。图3 各组大鼠心肌免疫荧光结果(DAPI,×200)Fig.3 Results of immunofluorescence of myocardium among rats in each group(DAPI,×200)
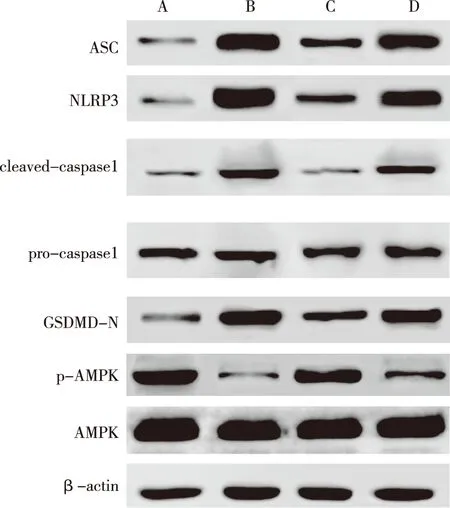
注:A为Sham组,B为MI组,C为MI+桃叶珊瑚苷组,D为MI+桃叶珊瑚苷+抑制剂组。图4 各组大鼠心肌组织AMPK/NLRP3通路相关蛋白表达水平Fig.4 The expression levels of AMPK/NLRP3 pathway related proteins in myocardial tissues among rats in each group
3 讨论
本研究通过结扎冠状动脉左前降支复制MI模型,结果显示,MI模型大鼠LVEF、LVSP、LVFS降低,LVESV、LVEDP、LVEDV升高,心肌梗死体积约为(39.81±5.47)%,提示结扎冠状动脉左前降支可阻断心肌供血,造成心肌缺血性坏死损伤和心功能下降。MI通常伴随炎症细胞的积累及炎症细胞因子和趋化因子的产生,进一步加重心肌损伤,导致心肌功能障碍和重塑[11-12]。细胞焦亡是一种炎症相关的细胞程序性死亡方式,发生焦亡时,细胞体积膨大,细胞膜破裂形成孔洞、导致细胞内容物释放,形成活化焦亡小体,释放炎性因子,又可进一步加重炎症反应,导致组织损伤等病理变化[13-14]。本研究发现,MI后心肌匀浆液中LDH水平升高,表明心肌细胞膜受损;心肌组织中焦亡细胞比例及IL-1β、IL-18增多,可能引起心肌细胞死亡并促进心肌炎性损伤;HE染色显示心肌细胞增大且排列混乱,有大量炎症细胞和部分小血管扩张充血坏死,呈现明显的炎性损伤,是导致心肌梗死和心功能下降的原因之一。Duan等[15]研究显示,在脂多糖诱发的心脏损伤小鼠中,桃叶珊瑚苷可减轻心脏中炎症,氧化应激和细胞凋亡,改善其心脏功能。本研究结果显示,MI后给予桃叶珊瑚苷可以提高大鼠心功能,减轻心肌组织中炎性损伤和细胞焦亡,并可抑制IL-1β、IL-18、LDH等释放,提示桃叶珊瑚苷对MI损伤具有保护作用。
炎性小体的装配是激活细胞焦亡过程中关键酶caspase-1的前提,细胞感受到危险信号后,NLRP3、衔接子ASC和pro-caspase-1会相互作用组装为NLRP3炎性小体复合物,导致pro-caspase-1裂解为活性形式cleaved-caspase-1[16]。cleaved-caspase-1可以将非活性pro-IL-1β加工为成熟的IL-1β并促进其分泌,诱导炎症反应和组织损伤[17];同时将GSDMD催化裂解为GSDMD-N和GSDMD-C,GSDMD-N可以与细胞质膜中磷酸肌醇结合,形成内径为10~20 nm的低聚致死孔,导致与炎症相关的细胞焦亡[18]。上述过程受到AMPK的调节作用[19-20]。本研究发现,与Sham组相比,MI模型大鼠心肌组织中p-AMPK、AMPK蛋白水平降低,ASC、NLRP3、cleaved/pro-caspase1、GSDMD-N蛋白水平增高,可能启动NLRP3炎性小体复合物组装,从而诱导心肌细胞炎性损伤和焦亡。MI后给予桃叶珊瑚苷可以提高p-AMPK/AMPK蛋白水平,降低ASC、NLRP3、cleaved/pro-caspase1、GSDMD-N蛋白水平,同时减轻心肌炎性损伤和细胞焦亡,提示桃叶珊瑚苷可以促进AMPK活化,抑制NLRP3小体形成,从而发挥对MI所致心肌损伤和心功能障碍的缓解作用。在桃叶珊瑚苷基础上,应用AMPK抑制剂,心肌匀浆中IL-1β、IL-18、LDH水平、焦亡细胞比例及心肌损伤程度升高,提示桃叶珊瑚苷可能通过调控AMPK/NLRP3通路降低炎性因子释放和细胞焦亡,从而发挥对MI所致心肌损伤和心功能障碍的保护作用。
综上所述,桃叶珊瑚苷可能通过活化AMPK,抑制NLRP3小体形成,减轻心肌细胞炎症和焦亡,实现对MI大鼠心功能的改善。本文首次探究AMPK/NLRP3通路在桃叶珊瑚苷对MI大鼠心功能保护中的作用,进一步丰富了桃叶珊瑚苷的药理机制。但是,中药提取物作用靶点多样,亦可能涉及别的机制,值得进一步完善。
