胃癌组织中α肌动蛋白4表达及其对胃癌AGS细胞迁移的影响*
2021-08-02杜洪夏英金泳韦四喜夏万松李红羽袁婷黄海
杜洪, 夏英, 金泳, 韦四喜,, 夏万松, 李红羽, 袁婷, 黄海*
(1.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 2.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 3.贵州中医药大学第一附属医院 检验科, 贵州 贵阳 550001)
胃癌(gastric cancer, GC)是全球高发肿瘤之一,2020年全球癌症统计报告显示GC发病率为5.6%、排第5位,死亡率为7.7%、排第4位[1]。我国GC发病率居亚洲首位,也是我国仅次肺癌的第2大高发肿瘤[2-4]。GC的侵袭和迁移往往伴随着患者病情的恶化,同时也是GC患者生存率低、预后较差的主要原因之一[5-6]。因此,寻找介导GC发生发展的关键因素,并确定其作为新的预后生物标志物或治疗靶点成为当务之急。α肌动蛋白4(actinin alpha 4,ACTN4)定位于人染色19q13.2,基因跨度38647649~38731589,可通过与丝状肌动蛋白(actin-filament,F-actin)相互作用从而维持细胞骨架的完整性并调控细胞运动[7]。有研究报道,ACTN4与肺癌、乳腺癌等肿瘤的发生、发展及侵袭转移密切相关[8-13],认为ACTN4可通过上皮间质转化而促进GC细胞的转移,有促癌作用[14],但机制尚不清楚。因此,本研究通过生物信息学分析GC中ACTN4基因的表达和意义,并对ACTN4进行GC细胞系及组织验证,检测ACTN4敲低对GC细胞迁移的影响,为研究ACTN4在GC发生发展、转移中的作用和机制提供线索,现将结果汇报如下。
1 材料与方法
1.1 实验材料
1.1.1细胞系和组织来源 GC细胞系AGS、MKN45、HGC-27、MGC803及正常胃黏膜细胞系GES-1购自中国科学院细胞库,293T细胞由上海交通大学金卫林教授实验室惠赠。选取胃肠外科手术20例GC患者GC组织,同时取相邻癌组织间隔5 cm以上癌旁组织作为对照;患者男13例、女7例,年龄38~85岁、平均(61.15±13.43)岁;组织标本均有唯一识别标记,留存于液氮中;本研究获得医院伦理道德委员会授权批准(2020伦审第106号)。
1.1.2主要试剂和仪器 UNlQ-10 柱式Trizol总RNA抽提试剂盒(上海生工生物),PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒和TB Green®Premix Ex TaqTMⅡ (Tli RNaseH Plus,日本Takara),聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白定量试剂盒和高效蛋白裂解液(radio immunoprecipitation assay,RIPA;北京索莱宝),慢病毒包装质粒(中山大学孙逸仙纪念医院赠予);LightCycler480荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪(瑞士罗氏),凝胶成像分析仪(美国BIO-RAD),台式冷冻离心机和普通PCR仪(美国Thermo Fisher),倒置显微镜(日本NIKON)。
1.2 研究方法
1.2.1细胞培养 GC细胞系AGS、MKN45、HGC-27、MGC-803及正常胃黏膜细胞系GES-1细胞系生长于含10%胎牛血清、1%青霉素-链霉素抗生素的RPMI-1640培养基中,293T生长于含10%胎牛血清、1%青霉素-链霉素抗生素的DMEM培养基中,细胞系置于含5%CO2、37 ℃恒温恒湿培养箱培养。
1.2.2生物信息学分析 亚拉巴马大学癌症数据库(university of alabama cancer database,UALCAN)网站[15]分析癌症基因组图谱(the cancer genome atlas,TCGA)数据库ACTN4相关基因的差异表达,同时数据库分析ACTN4与GC淋巴结转移和分期之间的相关性。
1.2.3RNA的提取及定量PCR UNlQ-10柱式Trizol总RNA抽提试剂盒提取细胞和组织总RNA,并使用Nanodrop 2000进行定量及纯度测定,所提取RNA保存于-80 ℃。cDNA第一链合成用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit试剂盒,保存于-20 ℃。TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)用于定量分析,荧光定量PCR仪反应扩增,以HPRT基因为内参,ACTN4基因扩增引物为ACTN4-F:5′-TGGAGGTCATATCAGGGGAGC-3′,ACTN4-R:5′-GAGACCAGCTTGACGCCTTT-3′, 采用荧光定量PCR技术(real-time quantitative PCR,qRT-PCR) 检测正常胃黏膜细胞系GES-1,GC细胞系AGS、MKN45、HGC-27、MGC803及20对GC组织和癌旁组织中ACTN4基因的表达量。
1.2.4ACTN4慢病毒敲低模型的构建 将公司合成的短发夹RNA(short hairpin RNA,shRNA)质粒、慢病毒包装质粒进行扩增。准备293T细胞,包病毒前1天更换新鲜无双抗的培养基,配制转染体系:opti-MEM 1.2 mL中加目的基因的质粒和包装质粒摩尔比为1 ∶1,psPAS2 ∶Pmd2.G ∶shRNA plasmid为2(10 μg) ∶1(5 μg) ∶2(10 μg)制备质粒混合液,opti 1.2 mL中按1 ∶6 的比例加PEI 150 μL,静置20 min。将上述混合液加无抗培养基5 mL,6~8 h后换液,加培养基10 mL;于转染24、36、48及72 h各收1次病毒,0.45 μm滤头过滤;GC AGS细胞铺6孔板密度为60%~80%,设置非感染组和感染组,非感染组细胞加polybrene 2 μL、感染组细胞加病毒和polybrene 2 μL,24 h换液,细胞筛选、培养24 h,更换新鲜培养基,36 h加嘌呤霉素筛选;非感染组细胞全部被嘌呤霉素杀死则判断慢病毒稳转株构建成功。
1.2.5划痕实验 先用marker笔于6孔板背后做好标记,细胞按5×105个/孔接种使其均匀分布,5%CO2、37 ℃恒温恒湿培养24 h,待细胞长满后用10 μL枪头垂直于直尺,于6孔板孔内划2条垂直相交划痕;磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗细胞3次,去除悬浮细胞,加入含有1%血清培养基;置于5%CO2、37 ℃恒温恒湿培养箱培养,分别于0、24及36 h采用倒置显微镜观察、拍照。
1.3 统计学分析
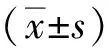
2 结果
2.1 生物信息学分析
课题组前期通过TCGA数据库进行生物信息学分析发现ACTN4在GC中高表达,ACTN4高表达与肿瘤的淋巴结转移和分期相关;同时Kaplan-Meier Plotter数据库分析显示ACTN4增高提示患者预后不良(P<0.05),综合分析提示在GC中肿瘤细胞的淋巴结转移及肿瘤分期与ACTN4表达相关,差异有统计学意义(P<0.05)。见图1。
2.2 ACTN4 mRNA和蛋白的表达
结果显示,AGS细胞系中ACTN4 mRNA的表达量明显高于GES-1细胞系,差异有高度统计学意义(P<0.001);与GES-1细胞系相比,AGS细胞系中ACTN4蛋白表达量上调,差异有统计学意义(P<0.05);qRT-PCR检测结果表明,20例GC组织中ACTN4 mRNA表达量较癌旁组织高表达,差异有统计学意义(P<0.05)。见图2。
2.3 敲低ACTN4后对AGS细胞迁移的影响
运用shRNA慢病毒干扰技术构建AGS细胞系ACTN4基因低表达细胞模型,Western blot检测ACTN4蛋白表达,结果显示sh-KD1组和sh-KD2组AGS细胞ACTN4蛋白表达水平分别低于sh-NC组(P<0.05);划痕实验表明sh-KD1组和sh-KD2组AGS细胞24、36 h细胞划痕愈合率均分别较sh-NC组降低(P<0.05或P<0.01)。
3 讨论
ACTN4基因定位于染色体19q13.2,在肿瘤的转移中扮演着重要的角色[16],课题组前期通过对公共数据库的分析结果显示,ACTN4基因在GC中高表达。数据库分析结果显示ACTN4基因高表达与肿瘤组织的淋巴结转移呈正相关,显示其与GC细胞的转移等密切相关,生物信息学分析结果与已报道文献大致相符[16]。此外,通过对TCGA数据库进行进一步生物信息学分析显示ACTN4在肿瘤组织中的高表达与分期呈正相关,但是不同分期之间差异无统计学意义(P>0.05);在生存预后分析中,结果显示ACTN4高表达与预后呈负相关,表明ACTN4高表达可能提示患者预后不良。

注:A为TCGA数据库中ACTN4在GC组织和正常组织中的表达,B为Kaplan-Meier Plotter数据库分析中ACTN4基因与GC患者生存预后的关系,C、D为TCGA数据库分析ACTN4表达与GC分期和淋巴结转移的关系;与正常组织或Normal组比较,(1)P<0.001,(2)P<0.05。图1 ACTN4生物信息学分析Fig.1 Bioinformatics analysis of ACTN4

注:A、B分别为GC组织和GC细胞系中ACTN4 mRNA水平定量结果,C和D分别GC细胞系中ACTN4蛋白表达和定量结果;(1)与癌旁组织比较,P<0.05;与GES-1细胞比较,(2)P<0.001,(3)P<0.05。图2 GC细胞系、GC组织及癌旁组织中ACTN4 mRNA和蛋白的表达Fig.2 Expression of ACTN4 mRNA and protein in gastric cancer cell lines and tissues

注:A、B分别为ACTN4蛋白表达和定量结果,C、D分别为细胞划痕愈合面积和划痕愈合率结果;与同时点sh-NC组比较,(1)P<0.01,(2)P<0.05。图3 敲低ACTN4后对AGS细胞迁移的影响Fig.3 Effect of ACTN4 knockdown in migration of AGS cells
通过qRT-PCR对肿瘤GC细胞系和GC组织ACTN4 mRNA和蛋白表达情况进行检测,结果佐证ACTN4在GC中表达失调,与生物信息学分析结果相契合。ACTN4基因的表达失调往往预示着一些肿瘤侵袭转移的发生和病情的恶化,有研究显示ACTN4参与肿瘤细胞上皮间质转化(epithelial mesenchymal transition,EMT)过程,进一步显示其与肿瘤侵袭迁移的关系[14,17-20]。肿瘤细胞EMT过程能够促进细胞的侵袭、迁移行为,而肿瘤细胞侵袭和迁移往往提示患者病情较重、预后较差。EMT是指细胞由上皮细胞向间质细胞过渡的一个生物学行为和状态,主要表现为细胞形态由上皮样多边形向间质细胞样长梭形过渡,细胞间粘附连接破坏,上皮标志物E钙黏蛋白表达下调,间质细胞标志物N钙黏蛋白、波形蛋白及相关转录因子锌指E-box结合同源框1、Snail等表达上调,且EMT主要报道由Wnt/β-catenin等信号通路参与调节,进而促进细胞变形运动[10,21-25]。因此肿瘤细胞EMT被认为是肿瘤重要的生物学行为,是癌细胞转移的前置状态。本研究体外敲低ACTN4基因构建了AGS细胞系ACTN4敲低模型,并采用划痕实验对该模型迁移能力进行检测,结果显示敲低ACTN4后AGS细胞迁移能力减弱(P<0.05)。虽然研究中未检测EMT相关指标的表达变化,但是在敲低ACTN4后细胞迁移能力减弱,变形运动能力减低则有力佐证了ACTN4促进GCAGS细胞的转移。
结合生物信息学大数据预测结果分析表明,ACTN4在GC细胞系AGS中高表达,ACTN4高表达能够促进AGS细胞系的迁移,与GC患者的生存预后呈负相关关系。本研究主要优势在于通过生物信息学分析预测,并结合组织和细胞模型验证以及构建慢病毒稳转细胞系对GC中ACTN4基因的功能进行探索,但也存在一些不足,如未深入探索ACTN4的功能机制。
