脑型糖原磷酸化酶对胃癌细胞凋亡的影响及机制*
2021-08-02袁婷韦四喜夏英夏万松李红羽杜洪金泳黄海
袁婷, 韦四喜, 夏英, 夏万松, 李红羽, 杜洪, 金泳, 黄海,***
(1.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 2.贵州中医药大学第一附属医院 检验科, 贵州 贵阳 550001; 3.贵州省第二人民医院 检验科, 贵州 贵阳 550004; 4.贵州医科大学 医学检验学院, 贵州 贵阳 550004)
消化系统最常见的恶性肿瘤之一是胃癌(gastric cancer,GC),据2020年全球癌症数据统计GC发病率排名第5,死亡率排名第4[1]。当前,对GC发病机制的深入研究表明GC进展与多种分子水平变化有关,包括癌基因与抑癌基因的异常表达、非编码RNA表达失调、肿瘤微环境改变及相关信号通路异常调节等[2],使分子靶向治疗在GC治疗中具有重要作用。目前常用的靶向药物是抗表皮生长因子受体抗体、抗血管内皮细胞生长因子抗体及靶向程序性死亡受体-1(programmed cell death protein-1,PD-1)单克隆抗体等[3]。尽管国内外研究已在这些靶向药物治疗中取得一定进展,但由于GC具有高度异质性,仍有许多分子机制尚未进行深入研究,目前相关研究进展依然有限[4]。因此,寻找新的早期标志物对GC治疗具有重要作用,亦对研发治疗GC新型药物和靶向药物具有重要意义。糖原代谢在肿瘤进展过程中具有重要作用,糖原是细胞中葡萄糖的贮存形式,其对能量供应和体内葡萄糖平衡至关重要[5]。调节糖原动员的关键酶是糖原磷酸化酶(glycogen phosphorylase,GP),其有3种亚型,即脑型、肝型及肌型糖原磷酸化酶[6-9]。脑型糖原磷酸化酶(brain-type glycogen phosphorylase,PYGB)主要在成人大脑及胎盘组织中表达,一般认为在人体应激状态(如缺氧、麻醉)时提供能量[10-12];Xia等[13]研究发现PYGB在GC组织中表达显著升高,沉默PYGB,可通过Wnt/β-连环蛋白(β-catenin)途径抑制GC细胞生长和上皮间质转化。然而,PYGB对GC细胞凋亡的影响及其机制目前尚不清楚。因此,本研究选择GC细胞AGS为研究对象,主要探讨PYGB对GC细胞凋亡的影响及其机制,从而能够为PYGB开发为GC治疗的新靶点提供理论和实验基础。
1 材料与方法
1.1 实验材料
1.1.1组织来源 收集2019年6月—2020年6月于胃肠外科接受手术治疗的29例初诊GC患者的癌组织及距肿瘤边缘>5 cm的癌旁组织,GC患者在术前未进行放疗和化疗。29例GC组织中,男19例、女10例,年龄43~80岁、平均年龄(60.3±9.6)岁,据美国癌症联合委员会 (American Joint Committee on Cancer,AJCC) GC 肿瘤淋巴结转移(tumor node metastasis,TNM)病理分期标准Ⅰ期3例、Ⅱ期5例、Ⅲ期14例及Ⅳ期7例。
1.1.2细胞来源 GC细胞系HGC-27(未分化)、MGC-803(低分化)、MKN45(低分化)、AGS(高分化)及人胃黏膜上皮细胞GES-1购自中国科学院上海生命科学研究院细胞资源中心。
1.1.3主要试剂和仪器 乌拉圭xy-cell胎牛血清(上海赛笠),LipofectamineTM3000(美国Invitrogen),Trizol试剂(上海生工),逆转录(reverse transcription, RT)试剂和实时荧光定量 PCR(reverse transcription-quantitative PCR,RT-qPCR)试剂TB Green®Premix Ex TaqTMⅡ(日本TaKaRa),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate ddehydrogenase,GAPDH)兔源多克隆抗体(南京巴傲得),PYGB兔源多克隆抗体(美国Abcam),细胞周期检测试剂盒(江苏凯基),细胞凋亡检测试剂盒(上海七海),活性氧检测试剂盒(南京建成);PYGB、次黄嘌呤磷酸核糖基转移酶(hypoxanthine phosphoribosyl transferase,HPRT)引物由本课题组设计,上海生工生物工程股份有限公司合成,HPRT的引物序列为5′-ATGGCGACCCGCAGCCCT-3′(forward)和5′-CCATGAGGAATAAACACCCT-3′(reverse),PYGB的引物序列为5′-CAGAACACGATGGTGAACCT-3′(forward)和5′-AGGTAGCCATTGAGTCAAGG-3′(reverse),根据GenBank数据库中PYGB基因已知序列(ID5834)由上海吉玛公司设计合成3对si-RNA序列,si-PYGB1序列为5′-GGAACUCGAGGAGAUAGAATT-3′(sense)和5′-UUCUAUCUCCUCGAGUUCCTT-3′(antisense),si-PYGB2序列为5′-CCAGGGUCCUGUAUCCAAATT-3′(sense)和5′-UUUGGAUACAGGACCCUGGTT-3′(antisense),si-PYGB3序列为5′-CCCUGUACAAUCGAAUCAATT-3′(sense)和5′-UUGAUUCGAUUGUACAGGGTT-3′(antisense);同时设计乱序无意义阴性序列si-NC做为阴性对照,其序列为5′-UUCUCCGAACGUGUCACGUTT -3′(sense)和5′- ACGUGACACGUUCGGAGAATT-3′(antisense),CO2恒温培养箱(美国Thermo Scientific),Light Cycler 480TMRT-qPCR仪(瑞士Roche公司),台式冷冻离心机(美国Beckman Coulter),FACS Calibur型流式细胞仪(美国Becton,Dickinson)。
1.2 研究方法
1.2.1一般临床资料收集 收集 29例GC患者性别、年龄、肿瘤侵袭、淋巴结转移、远处转移和TNM分期等一般临床资料。
1.2.2细胞培养 从液氮罐内取出GC细胞AGS、MKN45、HGC-27、MGC-803及人胃黏膜上皮细胞GES-1,快速融化,800 r/min离心3 min,弃上清;用含10%胎牛血清的RPMI-1640培养基3 mL重悬细胞,转移至直径60 mm细胞培养皿,放细胞培养箱中培养;48 h传代,传代比例1 ∶3;取对数生长期细胞用冻存液(含90%胎牛血清和10% DMSO溶液)冻存,4 ℃、 30 min,-20 ℃、 30 min,-80 ℃、 48 h,液氮罐内长期保存。
1.2.3RT-qPCR检测GC组织和细胞中PYGB的表达 GC组织和癌旁组织与GC细胞AGS、 MKN45、HGC-27、MGC-803及人胃黏膜上皮细胞GES-1中总RNA的提取根据Trizol试剂盒说明书操作;根据TaKaRa逆转录试剂盒说明书将RNA逆转录成cDNA,实时荧光定量PCR通过Light Cycler 480TM实时荧光定量PCR仪进行,用HPRT作为内参基因,人胃黏膜上皮细胞GES-1作为对照,用2-ΔΔCt法于计算GC细胞中PYGB的相对表达量;癌旁组织作为对照组,用2-ΔCt法于计算GC组织中PYGB的相对表达量。将GC组织与其癌旁组织相比,检测PYGB的表达,并以PYGB表达量的中位数作为临界值,高于临界值时视为高表达,低于临界值时视为低表达[14]。
1.2.4蛋白印迹法(Western blot)检测细胞内PYGB的表达 收集GC细胞AGS、 MKN45、HGC-27、 MGC-803及人胃黏膜上皮细胞GES-1,提取细胞总蛋白,经10%SDS-PAGE凝胶电泳分开后,转移至0.45 μm的PVDF膜上,5%牛奶室温封闭2 h,一抗GAPDH(1 ∶20 000)和PYGB(1 ∶1 000)于4 ℃摇床孵育过夜;TBST溶液洗膜3次、5 min/次,室温孵育HPR标记的羊抗兔IgG(1 ∶20 000)二抗1 h,TBST溶液洗膜3次,5 min/次;用化学发光成像系统采集图像,拍照保存。
1.2.5RT-qPCR和Western blot检测AGS细胞转染si-NC和si-PYGB 1~3后PYGB的表达 按“1.2.2”项下方法培养胃癌细胞AGS,待细胞长至对数生长期时接种于6孔板,根据RNA干扰技术合成的si-RNA序列将实验分为Control组(空白对照)、si-NC组(阴性对照)、si-PYGB 1组(si-PYGB 1)、si-PYGB 2组(si-PYGB 2)和si-PYGB 3组(si-PYGB 3),次日按LipofectamineTM3000转染试剂说明书进行转染,转染至48 h,分别收集各组细胞提取总RNA和总蛋白,采用RT-qPCR和Western blot检测AGS细胞内转染si-NC和si-PYGB 1~3后对PYGB表达的影响。根据转染si-NC和si-PYGB 1~3后对PYGB表达的影响,在后续实验中,si-PYGB 1~3对序列仅保留干扰效果最好的si-PYGB 2组,即后续实验中仅有si-NC组和si-PYGB 2组。
1.2.6流式细胞术检测细胞周期、凋亡及细胞内活性氧(reactive oxygen species, ROS)水平 按“1.2.2”项下方法培养胃癌细胞AGS,待细胞长至对数生长期时接种于6孔板,实验分为si-NC组(阴性对照)和si-PYGB 2组(si-PYGB 2),次日按LipofectamineTM3000转染试剂说明书进行转染,转染至48 h,收集2组细胞,1 000 r/min离心5 min,取细胞沉淀,分别根据细胞周期试剂盒、细胞凋亡试剂盒和ROS检测试剂盒说明书染色,1 h内上机检测。
1.3 统计学分析
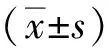
2 结果
2.1 PYGB mRNA和蛋白的表达
RT-qPCR和Western blot结果显示,与人正常胃黏膜上皮细胞GES-1相比,在GC细胞AGS和MKN45中PYGB mRNA和蛋白的表达上调、而在HGC-27和MGC-803中表达下调,差异均有统计学意义(P<0.05)。RT-qPCR结果显示,与癌旁组织相比,GC组织中PYGBmRNA表达上调(P<0.05)。见图1。
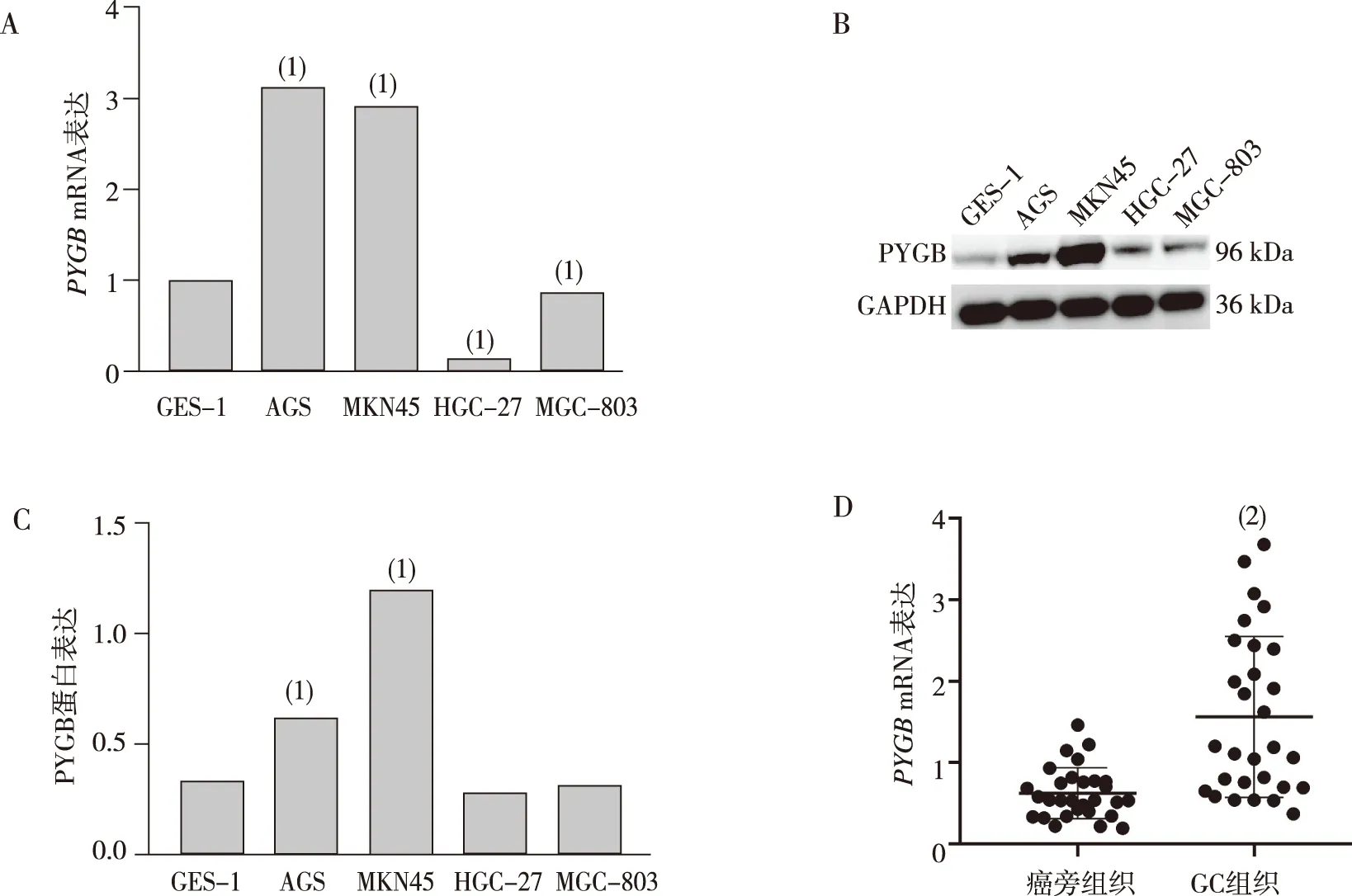
注:A为GES-1和GC细胞系的RT-qPCR检测结果,C为GES-1和GC细胞系的Western blot检测结果,D为GC组织和癌旁组织的RT-qPCR检测结果;(1)与GES-1比较,P<0.05; (2)与癌旁组织比较,P<0.05。图1 GC细胞株、GC组织及癌旁组织中PYGB mRNA和蛋白的表达Fig.1 Expression of PYGB mRNA and protein in GC cell strains, GC tissues, and adjacent tissues
2.2 PYGB表达与GC患者临床病理特征的关系
χ2检验结果显示PYGB的表达水平与GC患者性别、年龄、肿瘤侵袭、淋巴结转移、远处转移及TNM分期无关(P>0.05)。见表1。
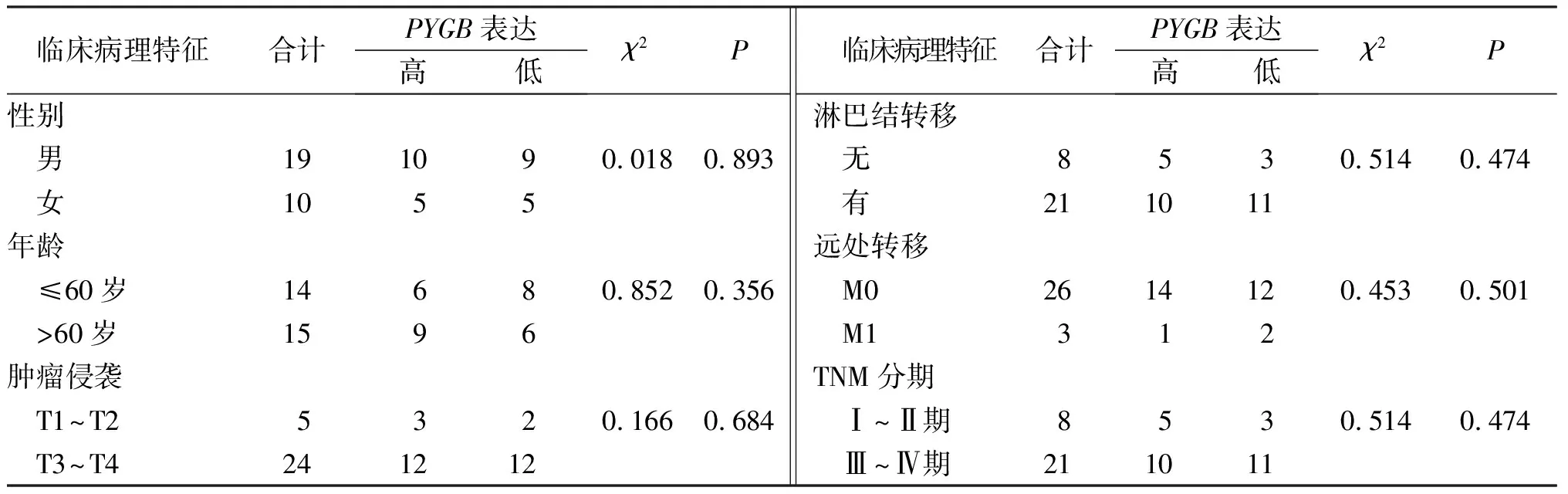
表1 PYGB表达与GC患者临床病理特征的关系(n)Tab.1 Relationship between PYGB expression and clinicopathological characteristics of GC patients(n)
2.3 AGS细胞内转染si-NC和si-PYGB 1~3后PYGB的表达
RT-qPCR和Western blot结果显示,与si-NC组比较,si-PYGB 1组、si-PYGB 2组和si-PYGB 3组PYGB mRNA和蛋白表达水平下降(P<0.05),而si-NC组与Control组比较、差异无统计学意义(P>0.05)。由于si-PYGB 2组的干扰效果最好,因此后续实验用si-PYGB 2组。见图2。

注:A为RT-qPCR检测PYGB mRNA表达,B、C为Western blot检测PYGB蛋白表达;(1)与si-NC组比较,P<0.05。图2 各组细胞中PYGB mRNA和蛋白的表达Fig.2 Expression of PYGB mRNA and protein levels in each group of cells
2.4 细胞周期
与si-NC组相比,si-PYGB 2组AGS细胞S期比例下降、G2/M期比例上升(P<0.05),提示敲低PYGB诱导AGS细胞周期阻滞在G2/M期;si-NC组与si-PYGB 2组AGS细胞 G0/G1期比较,差异无统计学意义(P>0.05)。见图3。
2.5 细胞凋亡
与si-NC组相比,si-PYGB 2组AGS细胞凋亡率上升(P<0.05),提示敲低PYGB可诱导AGS细胞凋亡。见图4。
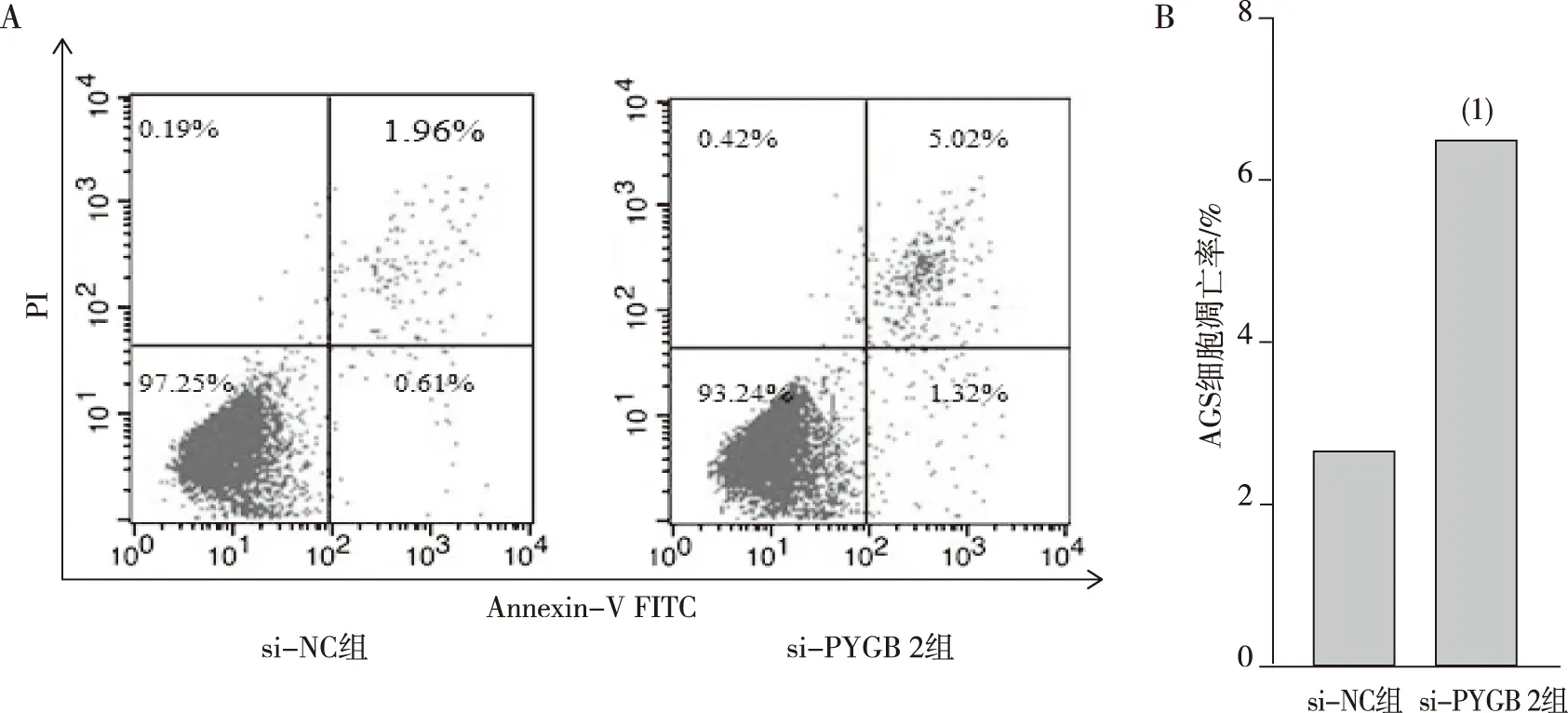
注:A为AnnexinⅤ-FITC和PI荧光分布,B为细胞凋亡定量结果;(1)与si-NC组比较,P<0.05。图4 敲低PYGB后各组AGS细胞凋亡Fig.4 Apoptosis of AGS cells in each group after knockdown of PYGB
2.6 ROS水平
与si-NC组比较,si-PYGB 2组AGS细胞内ROS水平增加,差异有统计学意义(P<0.05),提示敲低PYGB,诱导AGS细胞内ROS水平增加。见图5。

注:A为DCFH荧光分布,B为ROS含量占比;(1)与si-NC组比较,P<0.05。图5 敲低PYGB后各组AGS细胞内ROS水平Fig.5 ROS levels in AGS cells of each group after knockdown of PYGB
3 讨论
GC是消化道最常见的恶性肿瘤之一,目前常规治疗(如手术、化疗及靶向治疗)对患者疗效有限,且根据不同分子类型及不同病理特征给予个体化治疗,才能在GC患者治疗上取得新进展[15-16]。因此,研究GC新的治疗靶点具有重要意义。PYGB在多种肿瘤中异常表达,与肿瘤发生发展、肿瘤细胞增殖、凋亡、侵袭、迁移及预后不良相关[13,17-18]。本研究结果显示PYGB在GC细胞AGS和MKN45及GC组织中表达上调,提示PYGB可能与GC发生有关。然而,χ2检验显示PYGB高表达与GC患者性别、年龄、肿瘤侵袭、淋巴结转移、远处转移及TNM分期无关(P>0.05),这与Xia等[13]研究发现PYGB在GC组织中表达显著升高,并与GC患者的临床病理特征(包括肿瘤大小、淋巴结受累及肿瘤和淋巴结转移)呈正相关不一致,这可能与研究的样本数量较少有关,需要收集更多GC组织来验证这一结果。
肿瘤发生发展与肿瘤细胞的过度增殖、凋亡减少及细胞周期调控异常密切相关[19]。细胞周期遵循G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)及M期(分裂期)的发展规律[20]。本研究通过RNAi干扰技术下调AGS细胞中PYGB基因的表达后,发现可诱导AGS细胞周期阻滞在G2/M期并导致AGS细胞凋亡,提示PYGB可能成为GC治疗的新靶点。Wang等[17]研究发现PYGB在前列腺癌组织中表达上调,沉默PYGB可能通过影响核因子(nuclear factor κB,NF-κB)/核因子-类胡萝卜素相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)信号传导途径进而抑制PC3细胞的细胞活力,且PYGB沉默还可增加PC3细胞中的ROS含量,进而促进PC3细胞凋亡。Zhang等[18]研究发现PYGB在骨肉瘤组织及骨肉瘤细胞系MG63和HOS中高表达,沉默PYGB可通过阻断含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)/B淋巴细胞瘤(b-cell lymphoma,Bcl)和细胞周期蛋白依赖性激酶1(cyclin dependent kinase 1,CDK1)信号传导途径,抑制骨肉瘤细胞增殖、侵袭和迁移,导致骨肉瘤细胞周期阻滞,促进骨肉瘤细胞凋亡。Wu等[21]研究发现沉默PYGB可通过激活蛋白激酶B(protein kinase B,Akt)/缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)信号传导途径显著减弱H9c2心肌细胞中高葡萄糖诱导的细胞凋亡和氧化应激,并改善心肌细胞中的葡萄糖代谢,如糖原含量增加、葡萄糖消耗和葡萄糖转运增加。Zhou等[22]研究发现PYGB在卵巢癌组织中表达上调,且PYGB高表达与卵巢癌患者预后差显著相关,沉默PYGB可通过调节Wnt/β-catenin信号通路显著抑制卵巢癌细胞增殖、侵袭、迁移及异种移植肿瘤形成;Xiao等[23]研究发现PYGB在非小细胞肺癌细胞系和组织中表达上调,过表达PYGB通过调节Wnt/β-catenin信号通路促进非小细胞肺癌细胞增殖、迁移及侵袭,但抑制细胞凋亡,而这些作用可通过沉默PYGB有效逆转。此外,Zhan等[24]研究发现沉默PYGB可通过激活磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)/Akt信号通路抑制非小细胞肺癌的细胞活力、迁移及侵袭,并促进细胞凋亡,而这些作用可通过PYGB的过表达而有效逆转。这些发现均表明,沉默PYGB可诱导细胞凋亡,提示PYGB可能成为肿瘤治疗的新靶点。
本研究还发现RNAi干扰技术下调AGS细胞中PYGB基因的表达后,可诱导AGS细胞内ROS水平增加。ROS是正常代谢和异源生物暴露的产物,过量ROS可诱导细胞大分子的氧化修饰,抑制蛋白质功能并促进细胞死亡[25]。有文献报道,细胞内ROS水平增加时,促进细胞凋亡[26-27]。其机制可能是ROS形成促进线粒体释放细胞色素c,导致细胞活力丧失,进而诱导细胞死亡;另一方面,ROS的产生可激活鞘磷脂酶,该酶作用于鞘磷脂产生神经酰胺,进而激活细胞凋亡途径[28]。因此,本研究提示沉默PYGB,可能是通过促进细胞内ROS水平增加,进而诱导细胞凋亡。
总之,本研究表明PYGB在GC细胞AGS、MKN45及GC组织中表达上调,沉默PYGB可诱导AGS细胞周期阻滞在G2/M期,导致AGS细胞凋亡;沉默PYGB导致的AGS细胞凋亡与细胞内ROS水平增加密切相关,提示PYGB可能成为GC治疗的新靶点,也为GC治疗提供新思路。在今后的研究中,应该深入探讨沉默PYGB,诱导GC细胞凋亡的作用机制,以期为GC治疗提供理论和实验基础。
