长基因间非编码RNA963不同可变剪接体在胃癌细胞系中的表达和作用*
2021-08-02杜洪夏万松韦四喜夏英金泳李红羽袁婷黄海
杜洪, 夏万松, 韦四喜,, 夏英,3, 金泳, 李红羽, 袁婷, 黄海,***
(1.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 2.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 3.贵州中医药大学第一附属医院 检验科, 贵州 贵阳 550001)
胃癌(gastric cancer,GC)是世界上常见的恶性肿瘤之一[1]。由于GC起病隐匿,无典型临床表现,导致GC被发现时常常已是中晚期,患者往往错失了最佳手术治疗时机[2]。因此,迫切需要深入挖掘GC发生发展的分子机制,以期寻找有效的GC早期诊断分子标志物及相应的治疗靶点。长链非编码核糖核酸(long noncoding ribonucleic acid,lncRNA )是由RNA聚合酶Ⅱ转录生成的一类转录本长度超过200 nt的RNA分子[3],研究表明lncRNA在肿瘤的发生发展中发挥重要作用[4-5],本课题组前期研究也表明小核仁RNA宿主基因16(small nucleolar RNA host gene 16,SNHG16)和GC增殖增强转录本1(gastric carcinoma proliferation enhancing transcript 1,GHET1)可促进GC的恶性进程[6-8]。长基因间非编码RNA963(long intergenic non-protein coding RNA 963,LINC00963)定位于人染色体9q34.11,国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库报道仅有1个可变剪接体(alternative splice variant,V),有研究显示该基因在肺癌、乳腺癌等肿瘤中高表达,可参与肿瘤的恶性进程[9-11],但LINC00963基因是否调控以及如何调控GC发生发展机制却报道较少。因此,本研究通过克隆测序检测LINC00963存在的多个V,分析其蛋白编码能力、并检测其在GC细胞系中的表达量,同时利用基因沉默技术进一步研究LINC00963不同V的功能,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 GC细胞系AGS、MKN45、HGC-27、MGC-803及胃正常黏膜细胞系GES-1购自中国科学院细胞库。
1.1.2主要试剂和仪器 UNlQ-10柱式Trizol总RNA抽提试剂盒(上海生工生物),PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)、TB Green®Premix Ex TaqTMⅡ (Tli RNaseH Plus)及PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(日本,Takara),FirstChoice RLM-RACE Kit和Lipofectamine®RNAiMAX Reagent(美国Invitrogen),BCL2相关X凋亡调节因子(BCL2 associated X apoptosis regulator, Bax)、BCL2凋亡调节因子(BCL2 apoptosis regulator,Bcl-2)及半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartate-specific protease 3,Caspase-3;美国Abcam);LightCycler480荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(瑞士罗氏),凝胶成像分析仪(美国BIO-RAD),台式冷冻离心机和普通PCR仪(美国Thermo Fisher),DYY-Ⅲ2型稳压稳流电泳仪(北京六一仪器),化学发光仪(上海培清)。
1.1.3引物和小干扰RNA(small interfering RNA,siRNA)合成 实验所用引物及siRNA均由上海生工生物股份有限公司合成,以次黄嘌呤磷酸核糖基转移酶1(hypoxanthine phosphoribosyl transferase 1,HPRT)为内参,具体序列见表1和表2。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequence

表2 si-RNA序列Tab.2 si-RNA sequence
1.2 实验方法
1.2.1细胞培养 GC细胞系AGS、MKN45、HGC-27、MGC-803及胃黏膜细胞系GES-1培养于含有10%胎牛血清、1%青霉素-链霉素抗生素的RPMI-1640培养基中,含5%CO2、37 ℃恒温恒湿培养箱培养。
1.2.2常规PCR及实时荧光定量PCR(real-time quantitative PCR,qRT-PCR) 常规PCR反应采用3步法:95 ℃ 30 s,68 ℃ 30 s、72 ℃ 1 min,扩增40个循环扩增GC细胞系AGS、MKN45、HGC-27、MGC-803及胃黏膜细胞系GES-1,产物经琼脂糖凝胶电泳后送生工生物工程(上海)股份有限公司进行克隆测序。qRT-PCR扩增反应采用两步法:95 ℃ 10 s、60 ℃ 30 s,扩增40个循环。采用2-△△Ct分析GC细胞系AGS、MKN45、HGC-27、MGC-803及胃黏膜细胞系GES-1中基因的相对表达量,进行3次生物学重复。
1.2.3cDNA末端快速扩增(rapid amplification of cDNA ends,RACE)实验 取“1.2.2”项下已提取的RNA按试剂盒说明书操作进行RACE实验,RACE产物进行逆转录反应成cDNA后用于常规PCR反应下游引物用LINC00963-R1557。PCR反应采用3步法:95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,扩增40个循环。PCR产物经1%琼脂糖凝胶分离后切胶送生工生物工程(上海)股份有限公司进行克隆测序。
1.2.4蛋白编码潜力预测 测序数据采用SnapGene软件读取,并应用基础比对搜索工具(basic local alignment search tool,BLAST)进行序列比对分析,采用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)开放阅读框查找工具(https://www.ncbi.nlm.nih.gov/orffinder/)分析V蛋白质编码潜力。
1.2.5免疫印迹分析 GC细胞HGC-27培养于6孔板中,设置si-NC、si-V1-a、si-V1-b及si-V1-a+b组。50%密度转染siRNA 72 h后,提取蛋白,经电泳后转印于聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,使用牛奶封闭、相应一抗孵育过夜,最后孵育二抗并采用辣根过氧化物酶化学发光剂曝光,收集并分析结果。
1.3 统计学分析
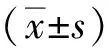
2 结果
2.1 未见报道的LINC00963 V
LINC00963-F598/R739引物扩增时发现该扩增产物大小与理论不符,测序发现该基因转录本第2外显子5′端多出59个碱基、且与第1内含子3′端59个碱基完全匹配。应用LINC00963-F503/R1557扩增发现存在多个扩增产物,切胶测序证实至少存在3个NCBI未收录的V,分别命名为LINC00963-V1(第三外显子缺失、第2外显子多59个碱基,且R711引物设在其中)、LINC00963-V2(第3外显子缺失)及LINC00963-V3(第2、3外显子缺失)。见图1。

注:A为LINC00963可变剪接电泳图,1、2泳道表示HPRT理论长度125 bp,3、4泳道表示LINC00963-F687/R807理论长度121 bp,5、6泳道表示LINC00963-F687/R1557理论长度871 bp,7、8泳道表示LINC00963-F598/ R711理论长度123 bp;B为LINC00963可变剪接电泳图,LINC00963-F503/R1557理论长度1 054 bp;C为LINC00963可变剪接体示意图,数字代表引物开始第一个碱基在野生型序列的碱基位置,方框代表外显子,线段代表内含子。图1 LINC00963V的电泳结果及示意图Fig.1 Schematic diagram of LINC00963 V
2.2 LINC00963不同V在GC细胞系中的表达
设计引物使得引物可扩增单一V,与胃黏膜上皮细胞GES-1相比,qRT-PCR检测发现LINC00963-V1、LINC00963-V2主要在GC细胞系HGC-27中高表达(P<0.05),并将qRT-PCR产物进行琼脂糖凝胶电泳。见图2。

注:A为在GC细胞株中全部V和V1、V2的相对表达量;B为琼脂糖凝胶电泳分析结果,1~5泳道为内参基因,6~10泳道为全部V,11~15泳道为V1,16~20泳道为V2,第1、6、11、16泳道模板为GES-1,第2、7、12、17泳道模板均为AGS,第3、8、13、18泳道模板为MKN45,第4、9、14、19泳道模板为HGC-27,第5、10、15、20泳道模板为MGC803;与GES-1细胞比较,(1)P<0.001,(2)P<0.01。图2 GC细胞系中LINC00963 V基因的表达Fig.2 Expression of LINC00963 V in GC cell lines
2.3 LINC00963不同V的5′RACE表征
测序结果进行BLAST比对分析表明前期所发现未见报道V明确存在,且该基因转录本5′端发现比NCBI已收录转录本更短;通过NCBI开放阅读框查找器对新发现V的蛋白编码能力进行分析,结果显示LINC00963多个V蛋白编码能力较弱或不具备蛋白编码能力,该基因新发现的V极有可能也是非编码RNA。见图3。

注:A为5′RACE产物运用LINC00963-R1557引物扩增后克隆测序分析,NR_038955.1为NCBI已收录转录本,其余5个为LINC00963 5′RACE扩增发现的不同转录起始位点,数字代表起始位点;B为NCBI 开放阅读框查找器分析结果,红色表示可能存在的开放阅读框,蓝色方框表示所预测结果中开放阅读框最长的一段,白色箭头代表翻译方向。图3 LINC00963不同V的5′RACE克隆测序分析Fig.3 Cloning and sequencing of LINC00963 V by 5′RACE
2.4 HGC-27细胞凋亡蛋白的表达
蛋白免疫印迹检测结果表明,与si-NC组比较,si-V1-a组、si-V1-b组及si-V1-a+b组敲低LINC00963-V1后,HGC-27细胞凋亡蛋白Caspase-3表达增加、BCL-2表达降低,差异有统计学意义(P<0.05);si-V1-a组、si-V1-b组敲低LINC00963-V1后,HGC-27细胞凋亡蛋白Bax表达增加,差异有统计学意义(P<0.05)。见图4。

注:A为免疫印迹法检测结果,B为凋亡相关蛋白的定量结果;与NC组比较,(1)P<0.01,(2)P<0.05,(3)P<0.001。图4 敲低LINC00963-V1后HGC-27细胞的凋亡相关蛋白表达变化Fig.4 Expression of apoptosis related proteins in HGC-27 cells after knockdown of LINC00963-V1
3 讨论
本研究结果表明LINC00963存在多个未见报道的V,为了进一步深入分析LINC00963存在于GC中的V,本研究进行了5′RACE、克隆测序及qRT-PCR实验,并检测到LINC00963明确存在多个未见报道或NCBI尚未收录的V在GC中表达,研究结果表明LINC00963存在新的V且V1、V2在GC细胞系中高表达。
LINC00963基因定位于染色体9q34.11,研究表明LINC00963基因在肿瘤的转移中扮演着重要的角色[12-13]。LINC00963基因的表达失调往往预示着一些肿瘤侵袭转移的发生,病情的恶化[14-16],越来越多的研究表明LINC00963与miRNA相互作用,充当分子海绵的作用,促进肿瘤的发生发展[9,17-21]。本研究结果显示,在GC中LINC00963基因存在多个未见报道的新的V,蛋白质编码能力较弱、表达失调,可能参与GC的恶性进程。真核生物基因表达是一个极为精细及复杂的过程,研究表明人类的基因数量范围2~3万个,但是蛋白质的类型却远远多于基因,很大原因与RNA可变剪接修饰相关[22]。同一基因可产生不同的V,从而翻译出不同的蛋白质发挥不同的功能[23-24]。也有研究指出LINC00963在肺癌中存在NCBI尚未收录的V,仅5′端减少了部分碱基且在肺癌的发生发展中发挥着重要的作用,参与肺癌的增殖、转移等分子机制[9]。也有研究显示LINC00963在乳腺癌中发挥重要功能,但通过BLAST比对文章所提供引物,发现引物无法与模板匹配,或许在其他肿瘤中还存在其他V形式[25]。依据NCBI已收录LINC00963基因RNA序列设计引物扩增时,本研究发现在GC细胞系中存在多个未见报道的V;运用qRT-PCR检测不同V发现主要在HGC-27细胞株中高表达,提示可能参与GC更为重要的分子机制。5′RACE实验发现LINC00963-V1是一类存在多个转录起始位点的V,但未见V2、V3,可能与V2、V3表达相对较低有关;同时NCBI开放阅读框查找器分析LINC00963多个V,结果显示该基因蛋白编码较弱,提示LINC00963基因在发生可变剪接后依然以非编码RNA的形式参与细胞功能。
本研究结果表明,在胃癌细胞系HGC-27中LINC00963-V1表达最高,后选择V1作为主要研究对象。敲低LINC00963-V1后观察到细胞密度较NC组低且死细胞较多,怀疑LINC00963-V1可能参与GC细胞抗凋亡的机制。此外,本研究中发现敲低LINC00963-V1后促进了细胞的凋亡,Caspase-3被激活,促进细胞凋亡的发生,Bcl-2家族蛋白中Bcl-2表达降低,Bax表达增加,诱导促进细胞凋亡。Bcl-2、Bax及Caspase-3蛋白分子在细胞凋亡的机制中扮演着非常重要的角色,研究报道Bcl-2家族蛋白在线粒体上对细胞凋亡发挥着对凋亡形成因子的释放调节功能,Bcl-2表达增加则抑制凋亡形成因子释放,抑制细胞凋亡;Bax表达增加则促进凋亡形成因子释放,促进细胞凋亡;Caspase-3更是凋亡机制中重要的功能执行者[26-27]。本研究的结果表明LINC00963-V1可以通过影响Bcl-2家族蛋白和Caspase-3蛋白直接或间接抑制细胞凋亡蛋白的表达,在肿瘤细胞的恶性进程中发挥着促进作用。
综上所述,本研究结果表明LINC00963在GC中存在的多个未见报道的V,且LINC00963可能通过诱导凋亡相关蛋白的表达促进GC凋亡。
