抗癌活性肽对胆囊癌GBC-SD细胞作用前后的基因表达谱研究
2009-05-08云强苏秀兰欧阳晓晖
云 强 苏秀兰 欧阳晓晖
【摘要】 目的 研究抗癌活性肽对人胆囊癌细胞系GBC-SD细胞作用前后的基因表达谱,筛选与抗癌活性肽作用相关的基因表达改变。方法 将1152条人类全长基因的PCR产物按微矩阵排列点样于特殊处理的玻片上制备成表达谱芯片;按一步法抽提抗癌活性肽作用前后体外培养的胆囊癌细胞的RNA并纯化mRNA,通过逆转录用两种荧光Cy3-dUTP和Cy5-dUTP标记对照和实验组胆囊癌细胞cDNA,制成cDNA探针并与表达谱芯片杂交,用ScanArray4000扫描仪扫描芯片上两种荧光信号,计算机分析判定差异表达的基因。结果 在1152条基因中筛选出有差异表达的基因245条,其中上调的121条,下调的124条。结论 利用本基因表达谱芯片可同时研究数以千计的基因表达水平,从而在基因水平上探讨抗癌活性肽对胆囊癌GBC-SD细胞作用的机制。
【关键词】 抗癌活性肽;胆囊癌;细胞系;基因芯片;基因表达谱
Analysis of gene expression pattern in gallbladder carcinoma cells treated by anti-cancer bioactive peptide (ACBP) YUN Qiang,SU Xiu-lan,OU YANG Xiao-hui.Inner Mongolia Hospital,Inner Mongolia 100027,China
【Abstract】 Objective To investigate gene expression pattern of human gallbladder carcinoma cell line treated by anti-cancer bioactive peptide (ACBP),and in the identification of novel cance rassociated genes.Methods The cDNA retro-transcribed from equal quantity mRNA from the gallbladder carcinoma cell line (GBC-SD) which were labeled with Cy5 and Cy3 fluorescence as a probes.The mixed probe was hybridized with cDNA microarray which representing a set of 1152 human genes.It was scanned by laser scanner.The acquired image was analyzed by software.Results 245 differentially expressed genes were identified that further identified 121 upregulated and 124 downregulated gene.Conclusion cDNA microarray for analysis of gene expression patterns is a powerful method to identify nove cancer as sociated genes.
【Key words】 Anti-cancer bioactive peptide (ACBP);Gallbladder carcinoma;Cell line;Gene chip;Gene expression pattern
本研究将通过基因芯片技术比较分析抗癌活性肽对胆囊癌GBC-SD细胞的基因表达谱的影响,了解作用前后基因表达的变化,深入探讨这种新型生物活性制剂的分子机制,为肿瘤治疗提供新方法。
1 材料与方法
1.1 细胞株 人胆囊癌GBC-SD细胞由山东大学齐鲁医院肿瘤研究所保存并提供。
1.2 主要试剂与耗材
1.2.1 细胞培养相关试剂
1.2.2 细胞总RNA提取、分析试剂
1.2.3 基因芯片标记、杂交试剂盒 上海博星(BioStar)基因芯片有限责任公司。
1.3 实验方法
1.3.1 细胞培养与药物作用 胆囊癌细胞按适当密度接种于培养瓶内常规培养,当达到80%融合时,加入活性肽使终浓度达到8 mg/ml继续培养48 h开始有形态的改变时终止。
1.3.2 探针制备 用改进的Trizol试剂一步法抽提培养细胞总RNA。
1.3.3 芯片杂交洗涤 按杂交试剂盒说明操作。
1.3.4 检测与分析 用ScanArray4000扫描仪扫描芯片,用GenePix Pro3.0图象分析软件分析Cy3和Cy5两种荧光信号的强度和比值。
2 结果
2.1 总RNA抽提结果 所提两组细胞(GBC-SD细胞对照组、GBC-SD细胞实验组)RNA OD260/OD280:1.8~2.0;1%琼脂糖凝胶电泳28 s、18 s条带清晰,无DNA杂带,证明已抽提高纯化的细胞总RNA。
2.2 芯片杂交结果分析
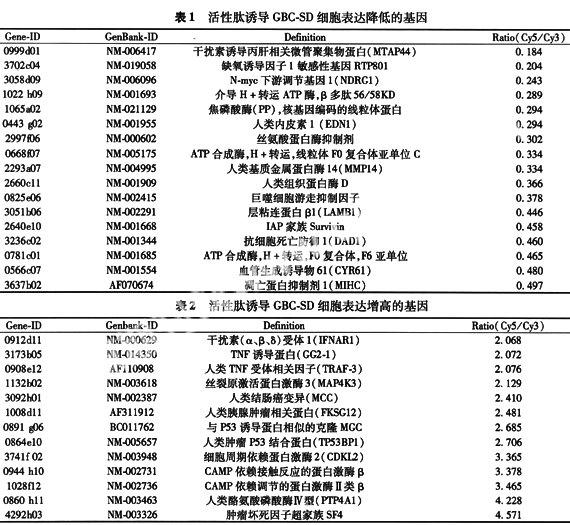
2.3 基因芯片检测结果 总基因位点1152条,归一化选择后基因总数1010条,有差异表达的基因245条,占基因总数的21.27%。其中经活性肽诱导后表达降低的124条,表达增高的121条。
3 讨论
利用基因芯片技术可以大规模、高通量、快速高效的对大量基因进行同时研究。表达谱基因芯片是用于基因功能研究的一种芯片,对来源于不同下的细胞内的mRNA或逆转录后产生的cDNA与表达谱基因芯片进行杂交、洗涤,用特有的荧光波长扫描芯片,计算机分析检测结果,对基因表达进行综合的分析和判断,将某个或几个基因与疾病联系起来。
肿瘤的发生、发展是多因素、多阶段、多基因参与的复杂过程,利用基因芯片技术可以平行检测数千条基因,了解药物对基因表达的影响,从而推测药物作用的基因靶点及机制,有利于发挥生物制剂特异性靶向调节作用。
3.1 缺氧诱导因子-1(HIF-1)反应性基因RTP801和内皮素1(ET-1)表达降低 HIF-1在多数肿瘤细胞中高表达,上调参与肿瘤增殖和代谢通路的靶基因。其机制主要是通过提高葡萄糖转运、糖酵解速率及形成多血管体系来使肿瘤细胞适应缺氧的环境[2]。其功能可分为:①促进糖酵解:能使肿瘤细胞适应不利环境,减少有氧代谢中氧自由基对DNA复制的破坏;②促进新生血管生成,给瘤细胞的侵袭和转移创造条件[3];③慢性缺氧状态下,HIF-1α可能参与诱导细胞凋亡。Nip是Bcl-2凋亡家族的凋亡前成员,它的启动子中包含HIF-1反应元件。在慢性缺氧及强制表达HIF-1α时均可使Nip3表达活跃,启动Bcl-2诱导细胞凋亡[4];④其他:HIF-1还可诱导各种促红细胞生成因子(如EPO、转铁蛋白)、扩血管因子(如诱导型一氧化氮合酶)、内皮素1等的表达来增加组织氧的运输和利用能力。拮抗HIF-1能抑制血管增生和肿瘤生长。RTP801是一个新克隆的HIF-1反应性基因,在体外和体内缺血性动物模型都可以检测到RTP801表达增高,将含有RTP801cDNA的脂质体导入小鼠肺内可导致大量细胞死亡[5]。内皮素是由内皮细胞和血管平滑肌细胞产生的含有21个氨基酸残基的短肽,有四种亚型,有强烈的缩血管作用,ET-1作用最强。现已证实,多数肿瘤能产生ET-1并表达内皮素受体,内皮素可通过多种途径参与肿瘤的血管生成[6]。推测活性肽能通过抑制肿瘤血管形成和影响肿瘤细胞能量代谢,促进凋亡而起到抗肿瘤效应。
3.2 参与H+转运的ATP合成酶表达下降 细胞能量代谢最重要过程三羧酸循环和氧化磷酸化都在线粒体内进行,而细胞凋亡时最早发生的改变就是线粒体内跨膜电位改变。本实验中ATP5G1和ATP5J表达下降提示活性肽可能通过干扰线粒体正常功能诱导凋亡。
3.3 Survivin和凋亡抑制蛋白1(IAP-1/MIHC)表达下调 Survivin是一种凋亡抑制因子,是凋亡抑制蛋白(IAP)家族的成员。Survivin主要通过抑制Caspases-3和Caspases-7阻断细胞凋亡。另外Survivin 也通过p21间接抑制Caspases,其机制是Survivin 与细胞周期调控因子CDK4形成复合体,使得p21从CDK4的复合体中释放出来,p21进一步与线粒体Caspases 结合,抑制其活性,阻碍凋亡[7]。有研究报道[8]Survivin可能是血管形成中生长因子诱导的保护性基因,维持血管内皮细胞的正常增殖。Survivin在肿瘤组织中表达的相对特异性,使抗Survivin疗法具有良好的靶向特异性,对正常组织损害小[9]。MIHC作为IAP家族成员通过阻断Caspases级联反应而抑制细胞凋亡。
3.4 与细胞外基质有关的基质降解酶人类基质金属蛋白酶(MMP)、组织蛋白酶D、纤溶酶原激活物抑制剂Ⅰ型(丝氨酸蛋白酶抑制剂)和层粘连蛋白以及血管生成诱导剂CYR61表达均下调。恶性肿瘤组织通过产生或诱导产生各种蛋白酶降解ECM而向周围浸润和转移。MMPs的蛋白溶解作用可能有3个后果:①允许内皮细胞降解并浸润血管基底膜;②产生ECM降解产物,趋化内皮细胞;③激活并固定ECM中的生长因子。MMPs可调节细胞与细胞间及细胞与基质间的粘附,调节新生血管的生成,促进肿瘤细胞的转移和浸润[10]。此外,MMP11有抑制肿瘤细胞凋亡的作用[11]。组织蛋白酶D(CD)是一种天冬氨酸类溶酶体肽链内切酶,分泌到细胞外后便降解细胞外基质成分。有研究表明CD在侵透胃壁,淋巴结转移阳性胃癌组织中表达增加,有更强的腹膜转移倾向。而且发现浸润到肌层的胃癌细胞CD强表达,表现出更强的侵袭能力[12]。层粘连蛋白(LN)是细胞外基质的重要成分之一,生理情况下细胞通过LN介导其与细胞外基质、细胞与细胞间粘附和信息传递,影响细胞的附着、游走、增殖和分化。CYR61是一个细胞外基质相关的信号分子,作为整合素受体的配体能促进细胞黏附,游走,增殖和蛋白质合成[13]。此外,作为一个血管生成素诱导剂能促进肿瘤生长和血管形成。因此,活性肽可能通过影响细胞黏附和血管形成从而抑制肿瘤细胞浸润和转移。
3.5 肿瘤坏死因子诱导蛋白(GG2-1)、肿瘤坏死因子受体相关因子3(TRAF-3)、肿瘤坏死因子超家族成员4(TNFSF4)和干扰素(α、β、δ)受体1(IFNAR1),TGF-βRⅡ表达均增高。肿瘤坏死因子对肿瘤细胞有细胞毒作用和生长抑制作用,可诱导许多不同来源肿瘤细胞凋亡;损伤肿瘤血管内皮细胞和堵塞血管引起肿瘤缺血、坏死并介导免疫调节。干扰素是具有生物活性的细胞因子,参与调节免疫反应;促进成熟单核巨噬细胞的吞噬作用,加强对肿瘤细胞的杀伤力;干扰素还可以上调肿瘤细胞MHC抗原和黏附分子的表达,促进机体对肿瘤细胞的识别和加强抗肿瘤免疫反应;TGF-β对细胞增殖与分化、细胞外基质的产生、血管的生成、细胞凋亡及机体免疫系统均起着重要的调节作用[14]。推测抗癌生物活性肽可能通过促进TNF、TGF-β和IFN生成来攻击、杀伤肿瘤细胞,增强人体免役防御能力,发挥免疫调节作用。
通过基因芯片技术对活性肽作用前后胆囊癌GBC-SD细胞基因表达谱的研究,可以发现有很多表达差异的基因。一方面能初步了解活性肽作用的分子机制,另一方面能发现更多的与活性肽作用有关的基因、蛋白产物,为进一步的研究提供新思路。测定结果说明活性肽抗肿瘤的机制可能是多种多样的,多途径的。通过多种途径抑制肿瘤新生血管形成,抑制糖酵解从而影响肿瘤细胞的能量代谢;影响线粒体能量代谢触发凋亡;下调多种基质降解酶,防止肿瘤细胞向细胞外基质和基底膜浸透,降低肿瘤细胞的局部浸润能力和远处转移能力。
总之,抑制肿瘤生长的基因表达下调,促进肿瘤凋亡的基因表达上调,两者协同作用诱导肿瘤细胞死亡。因此提示抗癌生物活性肽是一个多作用靶点的新型生物制剂,具有良好的应用、开发前景。但目前的研究还仅限于动物脏器的粗提物,还须以后进一步深入探讨其具体的表达产物,利用基因工程技术纯化,扩增,用于肿瘤治疗。
参 考 文 献
[1] Semenza GL,Agani F,Booth G,et al.Structural and functional analysis of hypoxia-inducible factor 1.Kidney Int,1997,51:553-555.
[2] Stubbs M,Bashford CL,Griffiths JR.Understanding the tumor metabolic phenotype in the genomic era.Curr Top Med Chem,2003,3(1):49-59.
[3] Mazure NM,Brahimi-Horn MC,Pouyssegur J.Protein kinases and the hypoxia-inducible factor-1,two switches in angiogenesis.Curr Pharm Des,2003,9(7):531-541.
[4] Bruick RK.Expression of the gene encoding the proapoptotic Nip3 protein is induced by hypoxia.Proc Natl Acad Sci USA,2000,97(16):9082-9087.
[5] Shoshani T,Faerman A,Mett I,et al.Identification of a novel hypoxia-inducible factor 1-responsive gene,RTP801,involved in apoptosis.Mol Cell Biol,2002,22(7):2283-2293.
[6] Salani D,Taraboletti G,Rosan L,et al.Endothelin-1 Induces an Angiogenic Phenotype in Cultured Edothelial Cells and Stimulates Neovascularization In Vivo.Am J Pathol,2000,157(5):1703-1711.
[7] Suzuki A,Ito T,Kawano H,et al.Survivin initiates ptrocapases 3/P21 complex formation as a result of interaction with CDK4 to resist Fas-mediated cell death.Onocogene,2000,19(10):1346-1353.
[8] OConnor DS,Schechner JS,Adida C,et al.Control of apoptosis during angiogenesis by survivin express in endothelial cell.Am J Pathol,2000,156(2):393-398.
[9] Rohayem J,Diestelkoetter P,Weigle B,et al.Antibody response to the tumor-associated inhibitor of apoptosis protein survivin in cance patients.Cance Res,2000,60(7).
[10] FangJ,Shing Y,WiederschainD,et al.Matrixmetalloproteinase-2 is required for the switch to the angiogenic phenotype in a tumor model.Proc Natl Acad Sci USA,2000,97(8):3884-3889.
[11] Boulay A,Masson R,Chenard MP,et al.High cancer cell death in syngeneic tumors developed in host mice deficient for the stromelysin- matrix metalloproteinase.Cancer Res,2001,61(5):21.
[12] 冯众一,徐惠锦,等.基质金属蛋白酶-2和组织蛋白酶D与胃癌生物学行为及腹膜转移关系.中国肿瘤临床,2002,29(10):720-722.
[13] Mo FE,Muntean AG,Chen CC,et al.CYR61 (CCN1) is essential for placental development and vascular integrity.Mol Cell Biol,2002,22(24):8709-8720.
[14] Blobe GC,Schiemann WP,Lodish HF.Role of transforming growth factor in human disease.N Engl J Med,2000,342(18):1350-1358.
