TLR9 基因及-1237T/C 位点多态性与心血管疾病关联研究
2021-08-01李喜龙周璐瑾崔思瑶刘俊杰王瑾洁王文栋常晓彤
李喜龙 周璐瑾 崔思瑶 刘俊杰 闫 珂 王瑾洁 王文栋 常晓彤
河北北方学院医学检验学院,张家口,075000,中国
心血管疾病(cardiovascular diseases,CVD)是心脏和脑血管疾病的统称,是世界上发病率和死亡率最高的疾病[1]。CVD 主要包括了大多数心肌梗死、中风以及致残性外周动脉疾病[2],其主要病状是动脉粥样硬化(atherosclerosis,AS),即动脉壁纤维化病变的形成。近年,人们对心血管疾病的研究不断深入,但许多机制仍未阐明。挖掘CVD 生物标记物,对于CVD 的预防、早期发现、提高治疗效果和整体存活率方面具有重要意义[3]。Toll 样受体(toll-like receptors,TLRs)属于模式识别受体家族的一类跨膜信号受体,当微生物突破机体的物理屏障(皮肤、黏膜等)时可被TLRs 识别,并激活机体产生免疫细胞应答,是机体抵抗感染性疾病的第一道屏障[4-6]。另外,TLRs 与慢性低度炎症反应也密切相关[7]。TLR9 是TLRs 家族成员之一,通过识别病毒和细菌上未甲基化的胞嘧啶-磷酸-鸟嘧啶(CpG DNA)基序,激活信号通路,引发先天性和适应性免疫应答[8]。
近年来,以小鼠为研究对象的许多研究表明TLR9与心血管疾病有关联。有研究表明,TLR9 是血栓后综合征(post-thrombotic syndrome,PTS)潜在的细胞和介质治疗靶点之一[9]。高剂量CpG 寡脱氧核苷酸(oligodeoxynucleotide,ODN)全身性刺激TLR9 会损害载脂蛋白E 缺陷型小鼠急性血管损伤后的内皮再形成,并增加动脉粥样硬化斑块的形成[10]。在不同类型的心力衰竭中,包括TLR9 在内的TLR 和干扰素调节因子在强烈的炎症过程起着重要作用[11]。TLR9 抑制性寡核苷酸作为潜在的新型凝血治疗药物,可用于预防急性冠状动脉疾病和脓毒症等可能大量存在细菌DNA的病理中的凝血现象[12]。
TLR9 在自身免疫和炎症过程中有重要作用,其基因的多态性与系统性红斑狼疮、肺癌和胃癌的发生、发展密切相关[13-15]。但TLR9 基因与心血管疾病发生的关联机制尚不完全明确。因此本文利用生物信息学方法,对TLR9 基因的基本组成、理化性质、单核苷酸多态性(single nucleotide polymorphism,SNP)位点、蛋白质互作和功能注释进行分析,研究了TLR9 基因SNP 位点-1237T/C 的多态性,以丰富TLR9 和心血管疾病的关联机制。
1 材料与方法
1.1 实验材料
从河北北方学院附属第一医院收集189 份血浆标本,其中健康对照组121 例,心血管疾病组68 例。本研究经医学伦理委员会同意,且所有纳入者均知情同意。
1.2 实验方法
1.2.1 TLR9 的基本组成和理化性质分析
利用DNAstar 软件[16]分析从美国生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库(https://www.ncbi.nlm.nih.gov/nucleotide/)[17]中获取的TLR9 的CDS(coding sequences)序列(DQ 019999.1),寻找开放阅读框并翻译成蛋白序列。使用Bioedit 软件分析TLR9 蛋白的氨基酸组成;采用ExPASy 的Protparam 数据库(https://web.expasy.org/protparam/)[18]分析TLR9 蛋白的基本理化性质;使用ExPASy 的ProtSale 数据库(https://web.expasy.org/protscale/)[19]分析TLR9 蛋白的亲疏水性。
1.2.2 TLR9 蛋白的信号肽及线性B 细胞表位分析
使用SignalP-5.0 数据库(http://www.cbs.dtu.dk/services/SignalP/)寻找TLR9 信号肽区域;使用NetNES数据库(http://www.cbs.dtu.dk/services/NetNES)寻找TLR9 核定位信号区域;使用Bepipred(http://tools.immuneepitope.org/bcell)挖掘TLR9 的线性B 细胞表位。
1.2.3 TLR9 基因的SNP 位点分析
利用NCBI 的SNP 数据库[20](https://www.ncbi.nlm.nih.gov/snp/)分析TLR9 的SNP 位点多态性。
1.2.4 TLR9 蛋白的结构预测以及功能域分析
使用SOPMA[21]预测TLR9 编码蛋白的二级结构;使用SWISS-MODEL(https://www.swissmodel.expasy.org/)[22]预测TLR9 蛋白的三级结构;用Pfam(https://pfam.xfam.org/)[23]寻找TLR9 蛋白的功能域。
1.2.5 TLR9 的关联蛋白互作及其功能注释
以TLR9 蛋白作为中心节点,联合使用STRING在线分析工具(https://string-db.org/)[24]和Cytoscape 3.6.1 软件[25]筛选与TLR9 互作的蛋白并构建蛋白质-蛋白质互作(protein-protein interaction,PPI)网络。使用DAVID 数据库(www.david.abcc.ncifcrf.gov/)[26]对TLR9 及与其发生互作的蛋白基因进行功能注释。
1.2.6 提取基因组DNA 并鉴定浓度和纯度
采用IANGEN BIOTECH 公司DNA 提取试剂盒,使用离心柱法提取外周血DNA;采用SAM4000UV-Vis超微量紫外分光光度计测定提取的DNA 含量和浓度。
1.2.7 针对SNP 位点(rs5743836)设计引物
本研究选定TLR9 基因SNP 位点rs5743836(-1237T/C),设计上、下游引物为:正向:5′-GTTTGTAAG AAGGCTGGATGGC-3′;反向:5′-GGACCTGCCACCC GCTGT-3′,理论扩增片段长度为221 bp。
1.2.8 RFLP-PCR 扩增目的基因
用PCR 仪对基因进行扩增,反应体系(50 µL)为:10×PCR Buffer 5 µL(10 mmol·L-1)、dNTP Mixture 4 µL(2.5 mmol·L-1)、上游引物(10 µmol·L-1)2 µL、下游引物(10 µmol·L-1)2 µL、Taq酶(5 U·µL-1)0.25 µL、模板DNA(400 ng/DNA 的浓度)、灭菌蒸馏水补足至50 µL。PCR 条件:95 ℃预变性 5 min;94 ℃变性40 s,55 ℃退火40 min,72 ℃延伸 1 min,共进行35 个循环;72 ℃补平10 min。目的条带为221 bp,1%琼脂糖凝胶电泳,检测扩增结果是否为目的条带。
1.2.9 酶切目的条带
酶切体系(20 µL)为:PCR 产物12 µL、10×buffer 2 µL、灭菌蒸馏水5 µL、BstNI 酶(10 U·µL-1)1 µL,放到37 ℃恒温金属浴中3 h 后,行3.5%的琼脂糖凝胶电泳,根据所得结果进行基因分型。将PCR 产物进行测序,电泳结果比对测序结果,确定最终分型。
1.3 统计学处理
用SPSS23.0 进行统计,P<0.05 有统计学差异。
2 结果
2.1 TLR9 蛋白的氨基酸组成
应用Bioedit 软件对TLR9 蛋白的氨基酸组成进行分析发现,TLR9 蛋白由859 个氨基酸残基组成,其中Leu(157 个,18.3%)、Ser(68 个,7.9%)、Ala(62 个,7.2%)和Arg(59 个,6.9%)含量较多;所含碱性氨基酸和酸性氨基酸总数分别为83 和74,分别占总氨基酸数的9.7%和8.6%。
2.2 TLR9 蛋白理化性质分析
利用ProtParam 工具分析TLR9 蛋白的基本理化参数,该蛋白残基总数为859 个,原子总数为13 622个,分子总质量理论为 96 844.50 Da,总分子式为C4355H6795N1225O1211S36,其中占比最高的残基为Leu(18.3%),占比最低的残基为Ile(1.5%)。TLR9蛋白的理论等电点为8.58,为碱性蛋白质。TLR9 蛋白的不稳定性指数(instability index,II)为41.73,是不稳定蛋白质。亲水性的平均值(grand average of hydropathicity,GRAVY)为-0.071,推断TLR9 蛋白为亲水性蛋白质。
2.3 TLR9 蛋白亲/疏水性、信号区域和线性B 细胞表位分析
运用ProtScale 中Kyte-Doolittle 法预测TLR9 蛋白亲水性/疏水性结果表明,在整个肽链中,亲水性氨基酸多于疏水性氨基酸,TLR9 为亲水性蛋白(Fig.1A),与理化性质分析结果一致;应用SignalP-5.0 对TLR9蛋白进行信号肽分析,预测值为0.001 5,远小于cutoff值0.5,显示TLR9 为非分泌性蛋白。用NetNES 进行核定位信号分析,有4 个分数值超过阈值(Fig.1B),提示该蛋白可能含有4 个核定位信号;运用Bepipred 法预测B 细胞线性表位,结果显示TLR9 蛋白平均抗原性指数为-0.349,分子内共有多个可能的抗原表位区域(Fig.1C)。其中,分值最高的表位区域为第278~295 位氨基酸残基区段,分值高达2.156(阈值0.350);其次为第853~859、684~696、824~831、252~275、521~527 位氨基酸区段。
2.4 TLR9 的SNP 位点分析
SNP 位点分析结果显示,rs5743836 位于3 号染色体的52226766 位置,属于TLR9 基因上游的点突变(Fig.2)。
2.5 TLR9 的二、三级结构特征及功能域分析
SOPMA 结果显示(Fig.3A),TLR9 的二级结构主要为α螺旋(48.89%)、无规则卷曲(33.99%)、延伸链(12.22%)、β转角(4.89%);采用SWISS-MODEL 在线预测工具同源建模法预测了TLR9 的三级结构。亚基预测结果得到了以PDBID 5y3m 为模板的较高质量预测模型(Fig.3B),相似度为76.9%,是预测模型中相似度最高的。全局模型质量评估得分为0.65,明显高于其他预测模型。另外,QMEAN 得分为-2.34,比其他预测模型更接近0;用Pfam 预测TLR9 的功能域,共有14 个功能域,其中8 个重要功能域(Fig.3C),6 个为不重要的功能域。在8 个重要的功能域中,第27 到82位氨基酸的功能域、第111 到172 位氨基酸的功能域、第303 到342 位氨基酸的功能域、第336 到383 位氨基酸的功能域、第445 到492 位氨基酸的功能域和第528 到589 位氨基酸的功能域属于LRR8 家族,第220到249 位氨基酸的功能域属于LRR12 家族,第697 到857 位氨基酸的功能域属于TIR 域。
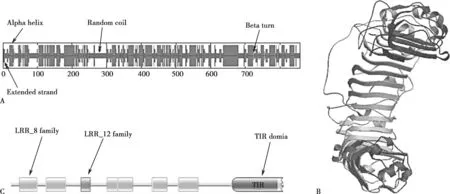
Fig.3 Secondary structure prediction,tertiary structure prediction and functional domain prediction of TLR9
2.6 TLR9 蛋白互作网络编码基因功能注释
以TLR9 蛋白作为中心节点,利用STRING 在线分析工具和Cytoscape3.7.2 构建蛋白质互作网络。与TLR9 互作的蛋白分别为肿瘤坏死因子受体超家族成员5(tumor necrosis factor receptor superfamily member 5,CD40)、肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素10(interleukin 10,IL10)、IL6、脾相关酪氨酸激酶(spleen tyrosine kinase,SYK)、天然免疫信号转导适配器(MYD88)、白细胞介素1 受体相关激酶1(interleukin 1 receptor associated kinase,IRAK1)、UNC9(innexin,UNC-9)、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)和TANK 结合激酶1(TANK binding kinase 1,TBK1)(Fig.4A)。在互作网络图中,TLR9、MYD88、TBK1 属于中心蛋白,发挥重要作用。

Fig.4 Interaction network and functional annotation diagram of TLR9 and its associated genes
利用DAVID 数据库对TLR9 蛋白互作网络关联基因进行功能注释(Fig.4B)。结果显示显著(P<0.05,Count≥4)的生物学过程包括:TLRs 信号通路(toll-like receptor signaling pathway),含IRAK1、MYD88、TRAF6、TLR9 四个基因;TLR9 信号通路(toll-like receptor 9 signaling pathway),含IRAK1、MYD88、TRAF6、TLR9 四个基因;免疫球蛋白分泌的调节(regulation of immunoglobulin secretion),含TNF、CD40、TRAF6 三个基因;Ⅰ型干扰素生产的正调控(positive regulation of type I interferon production),含IRAK1、MYD88、TBK1、SYK 四个基因;RNA聚合酶Ⅱ启动子转录的正调控(positive regulation of transcription from RNA polymerase Ⅱ promoter),含IL6、TNF、TBK1、CD40、TRAF6、IL10、TLR9 七个基因;平滑肌细胞增殖的正调控(positive regulation of smooth muscle cell proliferation),含IRAK1、IL6、TNF、MYD88、TRAF6 五个基因;NF-κB 转录因子活性的正调控(positive regulation of NF-kappa B transcription factor activity),含IRAK1、IL6、TNF、MYD88、CD40、TRAF6、TLR9 七个基因;IL6 产生的正调控(positive regulation of interleukin-6 production),含IL6、TNF、MYD88、TLR9 四个基因;I-kappa B 激酶/NF-kappa B信号的正调控(positive regulation of I-kappa B kinase/NF-kappa B signaling),含IRAK1、TNF、MYD88、TBK1、CD40、TRAF6、TLR9 七个基因;MyD88 依赖的TLRs 信号转导途径(MyD88-dependent tolllike receptor signaling pathway),含IRAK1、MYD88、TRAF6、TLR9 四个基因;JNK 级联(JNK cascade),含IRAK1、TNF、MYD88、TRAF6 四个基因;炎症反应(inflammatory response),含IL6、TNF、MYD88、TBK1、CD40、IL10、SYK、TLR9 八个基因;对革兰氏阳性细菌的防御反应(defense response to Grampositive bacterium),含IL6、TNF、MYD88、TBK1 四个基因;细胞对脂多糖的反应(cellular response to lipopolysaccharide),含IL6、TNF、CD40、TRAF6、IL10 五个基因;显著的细胞组成为内体膜(endosome membrane,含IRAK1、MYD88、TBK1、TRAF6、TLR9五个基因)。
2.7 PCR、酶切和测序结果
对121 个正常体检标本和68 个患病标本进行PCR 扩增后,酶切,确定基因分型。PCR 扩增片段长度为135 bp。189 份PCR 产物酶切并电泳后结果如Fig.5A。BstNI 酶切识别位点序列为C↓CA(T)GG,rs5743836 位点突变后为BstNI 酶切序列;另外,PCR目的片段中本身还存在一个稳定的此酶切序列,因此,当该rs5743836 位点发生突变时,目的片段中便有两个酶切识别位点,而未突变时则只存在一个酶切位点,因此,理论基因分型为三种,即野生基因型TT(147 bp、74 bp)出现两条带、突变杂合型TC(147 bp 和99 bp、48 bp、74 bp)出现四条带、突变纯合型CC(99 bp、48 bp、74 bp)出现三条带。189 份标本的电泳图中都有147 bp条带,可判断调查人群中无CC 型,存在TC 型和TT 型两种基因型。将PCR 产物送往测序公司测序,进一步鉴定。Fig.5B 和Fig.5C 所示为PCR 产物上游引物测序结果峰图,与电泳判断结果一致。

Fig.5 TLR9 gene PCR product analysis,digestion result analysis and PCR product sequencing results
2.8 统计学分析
结合189 份标本的酶切电泳结果,应用χ2 检验分析患病组和正常对照组等位基因频率及基因型有无统计学差异以及是否符合Hardy-Weinberg 平衡。对照组和患病组TLR9 T/C(rs5743836)基因多态性分布频率符合 Hardy-Weinberg 平衡。Tab.1 为TLR9 各个基因型的出现频率。TT 基因型分布频率在患病组(47.06%)和正常对照组(71.90%)之间有显著统计学差异(P<0.05)。

Tab.1 TLR9 gene genotypes in normal control group and diseased group
3 讨论
近年来,随着生物信息学的发展,使用生物信息学方法和工具分析、预测蛋白质序列已经成为重要的分析蛋白质结构和功能的手段[27]。本研究利用多种生物信息学的工具分析了TLR9 基因及其编码产物的理化性质、空间结构、功能域、蛋白质-蛋白质互作及基因功能注释。研究发现TLR9 属于碱性蛋白质,具有亲水性,是非分泌蛋白,有68 个磷酸化位点、10 个糖基化位点、4 个核定位信号;此外,TLR9 有多个潜在的线性B 细胞抗原表位,而有研究证明B 细胞相关基因在冠心病患者中的表达多少与患者的患病程度有关[28]。TLR9的二级结构预测显示它的二级结构以α螺旋居多,而Ernest 等的研究指出,LL-37 是一种α螺旋抗菌肽,它与dsDNA 形成的复合物通过TLR9 增强促炎因子的产生,且在小鼠动脉粥样硬化的模型中发现此复合物在血浆和动脉粥样硬化斑块中富集[29]。TLR9 的功能域分析显示,有6 个重要的功能域属于LRR8 家族,1 个属于LRR12 家族,LRR 即为富含亮氨酸的重复序列,1个属于TIR 域。有研究表明NLRP3 炎性小体(其中包含LRR)是一种先天的免疫信号复合物,它的激活有助于血管炎性反应,从而驱动动脉粥样硬化的发展和进程[30]。LL-37 可分泌到细胞外,并与IL-18 Ra 链结合,招募Toll/IL-1R(TIR)-8 用于传递抗炎信号。
TLR9 互作蛋白编码基因功能注释的结果显示:TLR9 参与的一个显著生物学过程为TLRs 信号通路,而有研究证明TLRs 信号通路通过介导炎症发生在心血管疾病中起到重要作用,可作为心血管疾病潜在治疗靶点的研究[32-33]。有研究显示,中性粒细胞完好无损的TLR9 信号通路可调节小鼠正常的血栓形成[34],推断TLR9 信号通路可能参与心血管疾病的形成。有研究证明槲皮素通过抑制炎症细胞因子表达、NF-κB 磷酸化和caspase 活性,在体内发挥心血管保护作用[35];IL6 与内皮功能障碍和亚临床动脉粥样硬化密切相关[36];TLR 4/MyD 88/NF-κB 信号通路参与了冠状动脉微栓塞所致心肌损伤[37]。由此可见,炎症在心血管疾病的发生发展中具有关键作用,TLR9 可能通过参与NF-κB、IL6 等促炎因子的正调控与心血管疾病相关联。
SNP 是人类基因组中最常见的变异类型,它是单个碱基的突变,突变类型包括转换、颠倒、插入和缺失[38]。TLR9 基因SNP 位点分析结果显示,rs5743836位于3 号染色体的52226766 位置,属于TLR9 基因上游的点突变,即-1237T/C,该突变位于TLR9 基因的启动子区。有研究表明,TLR9-1237T/C 多态性与疟疾易感性[39]、胃癌的发生[40]、乙型肝炎病毒的自发免疫控制[41]等有关。此外TLR9 基因该位点多态性也是女性静脉血栓栓塞复发的潜在指标[42]。本研究结果显示心血管疾病患者与正常组TLR9 基因rs5743836 的TT 和TC 分布频率比对,心血管疾病患者TC 基因型分布频率增高。
综上,TLR9 基因的-1237T/C 多态性与心血管疾病发生密切有关,且TLR9 的LRR 和TIR 功能域异常,可能激活炎症反应,导致心血管疾病的发生与发展。
