芒果苷元对TGF-β1诱导的HK-2细胞EMT的影响
2021-07-29徐爱萍高丽辉陈梦威牛艳芬
徐爱萍,林 华,高丽辉,李 玲,陈梦威,王 歌,杨 娟,牛艳芬
(昆明医科大学生物医学工程研究中心,云南 昆明 650500)
肾间质纤维化(renal interstitial fibrosis,RIF)是慢性肾脏疾病进展至终末期肾病的必经过程[1],RIF的主要病理特征为大量细胞外基质成分(extracellular matrix,ECM)如纤连蛋白(fibronectin,FN)、Ⅰ型胶原(collagen type Ⅰ,Col Ⅰ)等在肾间质沉积并形成瘢痕,从而破坏肾脏结构,导致肾功能受损[2-3]。
在肾脏损伤过程中,多种因子(如TGF-β1)可诱导肾小管上皮细胞转化为成纤维细胞/肌成纤维细胞,并导致ECM蛋白沉积的过程被称为上皮间质转化(epithelial-mesenchymal transition,EMT)。大量研究表明,EMT是RIF的发生和发展中重要的病理生理过程,是启动和维持RIF的关键机制[4-5]。芒果苷元(norathyriol,NL)属于双苯并吡喃酮类黄酮化合物,本课题组前期研究发现芒果苷元能降低血尿酸水平且改善动物肾功能,已经申请国家发明专利(申请号:201610181082.3),尤其是对肾小管具有很好的保护作用。本研究拟采用TGF-β1诱导人肾小管上皮细胞(HK-2)成EMT模型,以苯溴马隆作为阳性对照,观察芒果苷元对HK-2细胞EMT的影响,为芒果苷元肾保护作用的后续研究奠定基础。
1 材料与方法
1.1 材料
人肾小管上皮细胞(HK-2),购自中科院上海细胞库;芒果苷元,昆明制药集团股份有限公司;苯溴马隆,阿拉丁;人重组TGF-β1,Peprotech;MTT,Amresco公司;DMEM干粉培养基,Gibico;DMSO,Biofroxx;胎牛血清,Gibico;胰蛋白酶干粉,Amresco公司;Transwell小室,Corning;结晶紫,Meilunbio;兔抗Fibronectin抗体,万类生物;兔抗ColⅠ抗体,万类生物;山羊抗兔IgG/辣根酶标记,中山金桥。
1.2 仪器
二氧化碳培养箱为Thermo产品,型号heracell 150i;倒置显微镜为Olympus产品,型号CKX41;全波长紫外-可见光酶标仪为美国Biotek产品,型号Synergy2;高压锅为上海申安医疗器械厂产品,型号LDZX-50KBS;恒温摇床为博彩产品。型号THZ-032;超低温冰箱为美国Thermo Electron公司产品,型号Forma-86 C991。
1.3 方法
细胞培养:人肾小管上皮细胞(HK-2细胞)用含有10%胎牛血清的DMEM培养基,置于37 ℃、5%CO2、饱和湿度的CO2培养箱内孵育培养,隔2 d换液。
MTT法检测芒果苷元对HK-2细胞活力的影响:选生长状态良好的HK-2细胞,待其生长达70%~80%融合时,按5×103个/孔接种于96孔细胞培养板,37 ℃,5% CO2培养箱中孵育培养。待细胞贴壁后,加入无FBS的DMEM培养基饥饿细胞过夜,使细胞同步化于G0期。给以芒果苷元(10-9、10-8、10-7、10-6、10-5mol/L)和苯溴马隆(10-7mol/L)干预48 h,48 h后,每孔加20 μL MTT,继续培养4 h,弃上清,每孔加入150 μL DMSO,震荡混匀10 min,492 nm 波长下测定OD值,计算细胞活力。细胞相对活力(%)=(处理孔OD492/正常对照孔OD492)×100[6]。
划痕实验检测细胞迁移能力:选生长状态良好的HK-2细胞,待其生长达70%~80%融合时,接种至六孔板(种板前用marker笔在六孔板背后均匀的划横线,大约每隔0.5 cm一道,使每孔至少有五条线穿过,便于后续拍照时定位),将细胞分为正常组、模型组(TGF-β1诱导组)、芒果苷元10-8、10-7、10-6mol/L组和苯溴马隆10-7mol/L组。37 ℃,5% CO2培养箱内孵育培养细胞,待其贴壁后,将含10% FBS的培养基换成无FBS培养基,使细胞同步化于G0期。加入各浓度芒果苷元(10-8、10-7、10-6mol/L)和苯溴马隆(10-7mol/L),培养箱孵育培养4 h,4 h后用200 μL枪头垂直于marker笔所划横线划痕,每孔划5条,PBS洗涤3次,重新加入系列浓度芒果苷元和苯溴马隆,同时给以10 ng/mL的TGF-β1诱导,在TGFβ1诱导后第0 h和24 h时,每孔选取六个点拍照,计算24 h迁移率。迁移率(%)=(0 h划痕宽度-测定时划痕宽度)/ 0 h划痕宽度× 100%[6]。
Transwell法检测细胞侵袭能力:用无FBS培养基稀释Matrige,铺于24孔Transwell小室的上室,放入37 ℃培养箱,待Matrigel凝固后,小心吸走上室液体,细胞消化后用无FBS培养基重悬并计数,每孔5×104个细胞,接种于上室,下室加入含10% FBS的培养基,37 ℃,5% CO2培养24 h,吸弃上室培养基,用棉签轻轻擦去上室细胞,并用PBS洗涤2次,甲醇在室温固定20 min,再用PBS洗2次,结晶紫室温染色20 min,PBS洗3次,100×倒置显微镜下选4个视野拍照,计数穿过上室的细胞数。
Western bolt免疫印迹实验:细胞培养48 h后,用PBS洗涤细胞3次,加入含有蛋白酶抑制剂、PMSF的RIPA裂解液,冰上裂解细胞,用细胞刮刀将细胞刮下并收集至EP管,离心后取上清,将收集好的蛋白样品定量,加5×loading buffer,100 ℃变性,在压缩胶(60 V,30 min),分离胶(110 V,80 min)条件下,进行 SDS-聚丙烯酰胺凝胶蛋白电泳,260 mA,90 min,冰水浴条件下转膜,5%脱脂牛奶室温封闭2 h,用5%脱脂牛奶稀释一抗至适当浓度,4 ℃ 封闭过夜,次日洗膜,加入辣根过氧化物酶标记的二抗室温孵2 h,洗膜,BIO-RAD化学发光成像仪进行成像,采用Image j分析软件对条带进行分析,求出各条带的光密度值。
1.4 统计学处理
用Graphpad prsim5.0软件进行统计学分析,所有实验数据用均数±标准差()表示,用单因素方差分析(one-way ANOVA),组间比较采用Dunnett法,P<0.05为差异有统计学意义。
2 结果
2.1 芒果苷元对HK-2细胞活力的影响
图1所示,与正常组相比,芒果苷元各浓度组及苯溴马隆组对HK-2细胞活力无明显影响(P>0.05)。
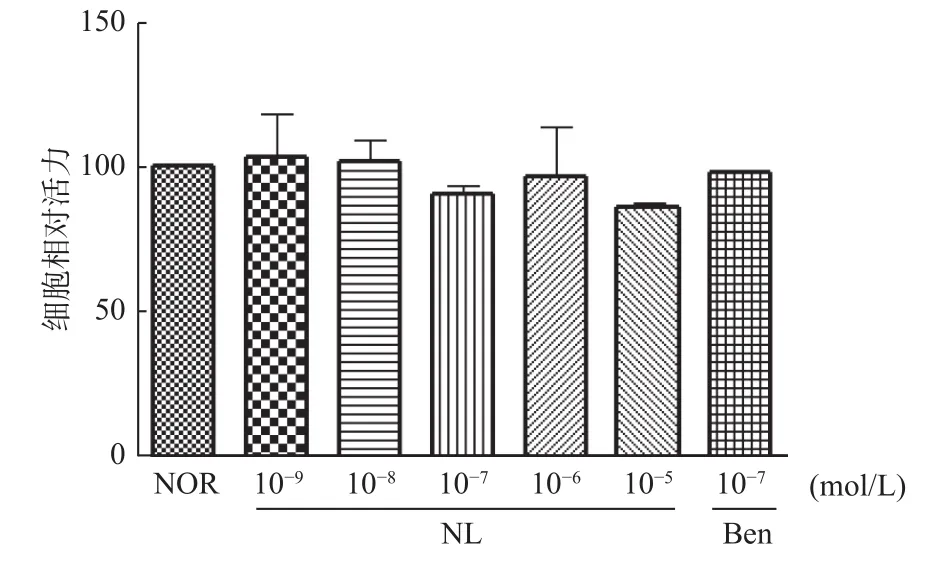
图1 芒果苷元对HK-2细胞活力的影响(,n=3)Fig.1 Effect of norathyriol on HK-2 cell viability
2.2 芒果苷元对TGF-β1诱导的HK-2细胞表型转化的影响
如图2所示,在倒置显微镜下(40×),正常的HK-2细胞为鹅卵石状、铺路石状、圆形或者椭圆形,细胞与细胞之间连接紧密,TGF-β1作用24 h后,模型组细胞变长,细胞之间连接松散,变为长梭形;在给以芒果苷元10-8、10-7、10-6mol/L和苯溴马隆(10-7mol/L)干预之后,与模型组相比,椭圆形细胞增多。

图2 芒果苷元对TGF-β1 诱导24 h后的HK-2细胞形态变化的影响(40×)Fig.2 Effect of norathyriol on the morphological changes of HK-2 cells induced by TGF-β 1 for 24 h(40×)
2.3 芒果苷元对TGF-β1诱导的HK-2细胞迁移能力的影响
与正常组比,TGF-β1诱导HK-2细胞24 h后,模型组迁移率显著增加,差异具有统计学意义(P<0.05,0.01);与模型组相比,芒果苷元10-8,10-7,10-6mol/L组及苯溴马隆组迁移率显著降低,差异具有统计学意义(P<0.05,0.01),见图3、图4。

图3 芒果苷元对TGF-β1诱导后HK-2细胞迁移率的影响(40×)Fig.3 Effect of norathyriol on the migration of HK-2 cells induced by TGF-β 1(40×)
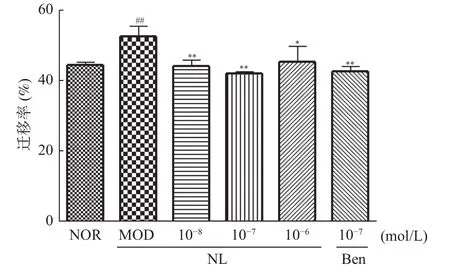
图4 芒果苷元对TGF-β1诱导后的HK-2细胞的迁移率的影响(,n=3)Fig.4 Effect of norathyriol on the migration of HK-2 cells induced by TGF-β1(,n=3)
2.4 芒果苷元对TGF-β1诱导的HK-2细胞侵袭能力的影响
TGF-β1(10 ng/mL)诱导HK-2细胞后,与正常组比,模型组侵袭能力显著增加,差异具有统计学意义(P<0.05);与模型组相比,芒果苷元10-6mol/L组细胞侵袭能力显著下降,差异具有统计学意义(P<0.05);与苯溴马隆组相比,等浓度芒果苷元(10-7mol/L)组侵袭率无明显变化(P>0.05),如图5,图6。
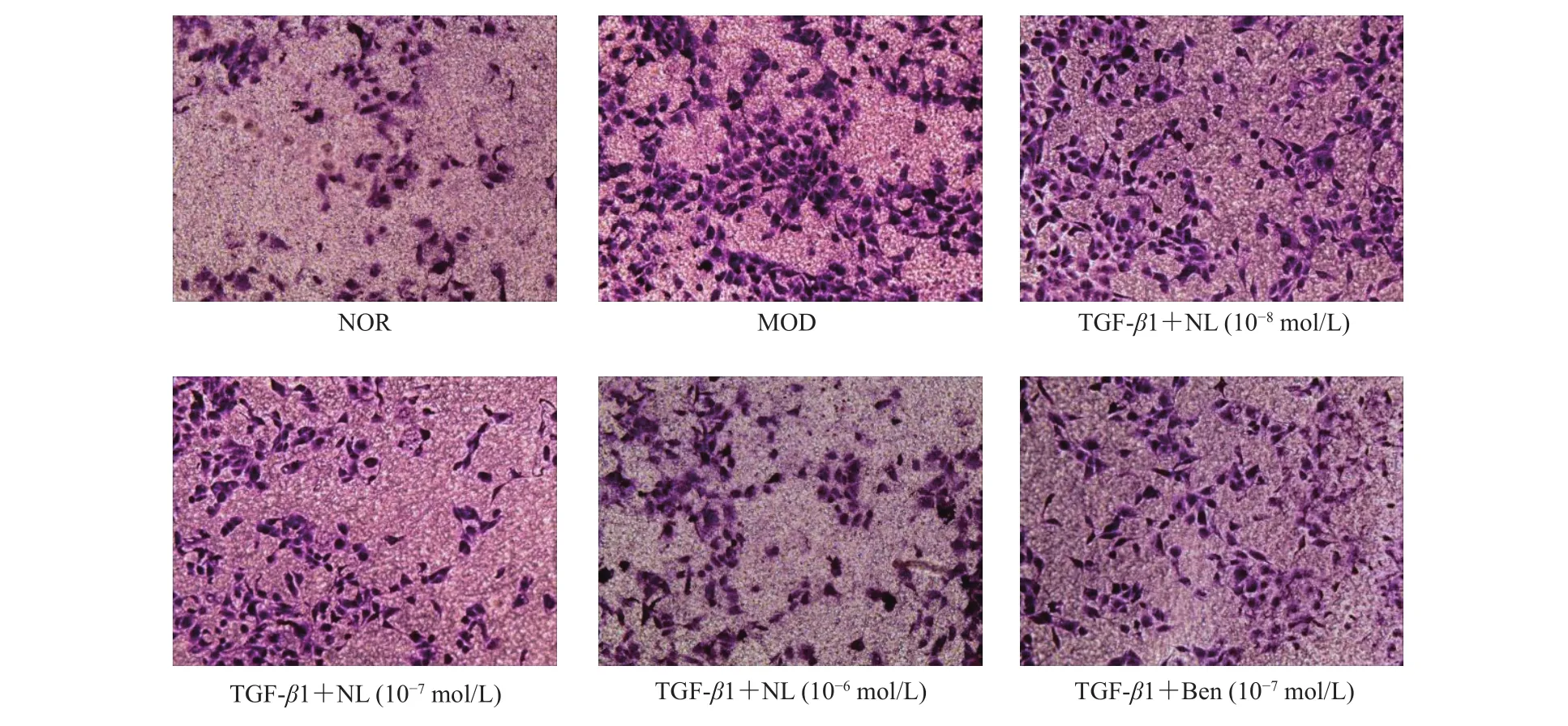
图5 芒果苷元对TGF-β1诱导的HK-2细胞侵袭能力的影响(100×)Fig.5 Effect of norathyriol on invasion of HK-2 cells induced by TGF-β 1(100 ×)
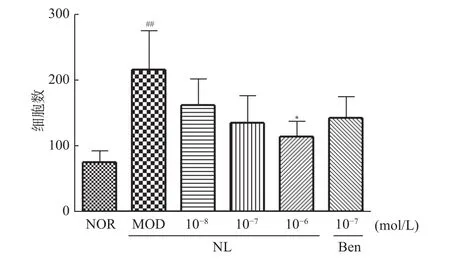
图6 芒果苷元对TGF-β1诱导的HK-2细胞侵袭能力的影响(,n=3)Fig.6 Effect of norathyriol on invasion of HK-2 cells induced by TGF-β 1(,n=3)
2.5 芒果苷元对TGF-β1诱导的HK-2细胞ColⅠ和FN蛋白表达水平的影响
2.5.1 芒果苷元对TGF-β1诱导的HK-2细胞ColⅠ蛋白表达水平的影响与正常组相比,模型组细胞ColⅠ表达显著上调,差异具有统计学意义(P<0.05);与模型组相比,芒果苷元10-6mol/L组和苯溴马隆组细胞ColⅠ表达显著下调,差异具有统计学意义(P<0.05,0.01),见图7。
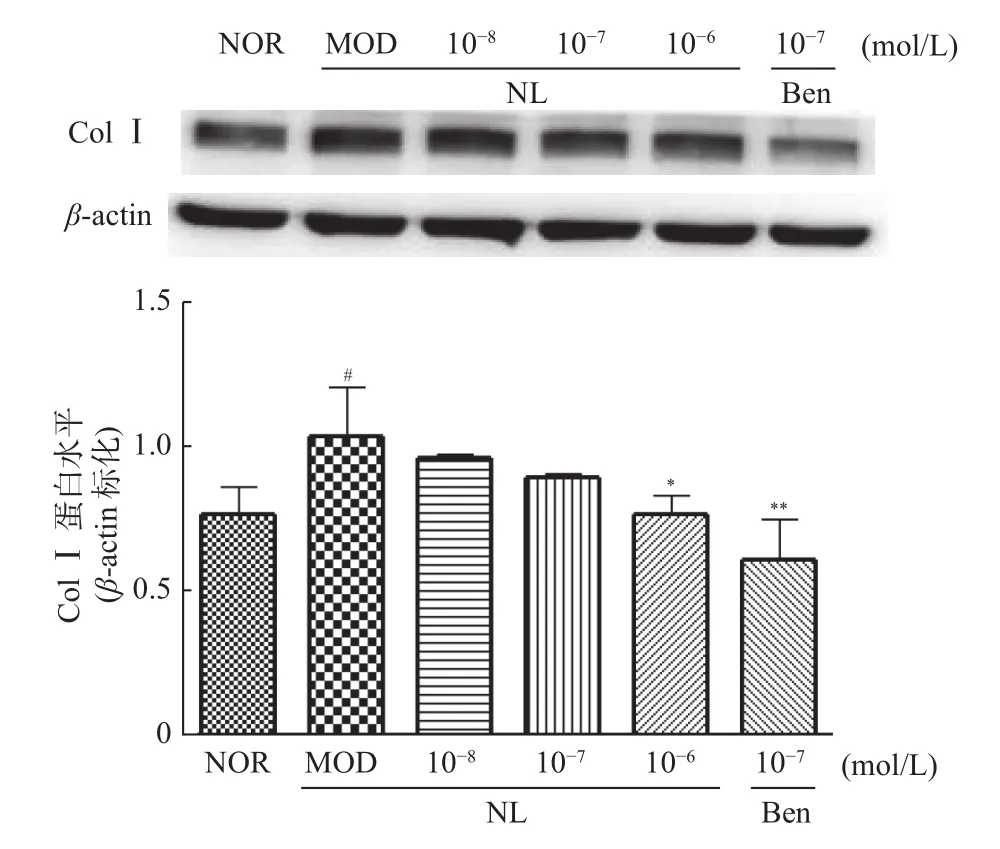
图7 芒果苷元对TGF-β1诱导的HK-2细胞ColⅠ蛋白表达水平的影响(,n=3)Fig.7 Effect of norathyriol on expression of colIprotein in HK-2 cells induced by TGF-β1(,n=3)
2.5.2 芒果苷元对TGF-β1诱导的HK-2细胞FN蛋白表达水平的影响与正常组相比,模型组细胞FN蛋白表达显著上调,差异具有统计学意义(P<0.01);与模型组相比,芒果苷元10-6mol/L组细胞FN蛋白表达显著下调,差异具有统计学意义(P<0.05),见图8。
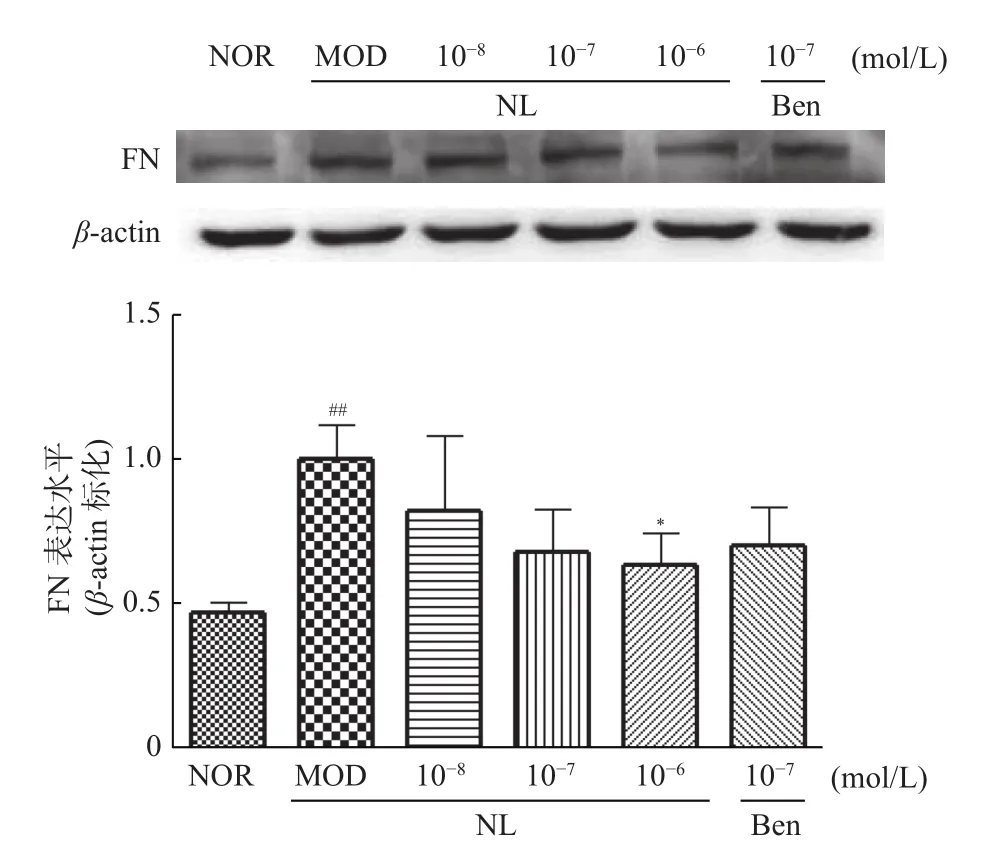
图8 芒果苷元对TGF-β1诱导的HK-2细胞FN表达水平的影响(,n=3)Fig.8 Effect of norathyriol on expression of FN protein in HK-2 cells induced by TGF-β1(,n=3)
3 讨论
TGF-β1是公认的最强的纤维化诱导因子,在体外可诱导多种上皮细胞发生EMT。在RIF过程中,TGF-β1可刺激肾小管上皮细胞发生EMT,促进RIF的发生发展[7-8]。本实验参照文献[9-11],给以10 ng/mL TGF-β1诱导HK-2细胞,复制肾小管上皮细胞EMT模型,在此模型上研究芒果苷元对EMT的作用及其机制。
正常HK-2细胞呈铺路石形,细胞与细胞之间紧密连接,在发生EMT时细胞形态会发生改变,可由原来的圆形或椭圆形变成长梭形,且细胞与细胞间的间距变大,细胞形态和细胞间间距的改变可反映肾小管上皮细胞EMT的程度[12],本实验给以TGF-β1诱导HK-2细胞24 h时后拍照,观察细胞形态的变化,发现在TGF-β1诱导后24 h时,模型组细胞发生明显的表型转化,细胞由鹅卵石形态转化为长梭形,提示HK-2细胞发生EMT;在给以芒果苷元干预后,部分HK-2细胞能维持铺路石形态,提示芒果苷元能抑制TGFβ1诱导的HK-2细胞形态的变化。
正常肾小管上皮细胞最显著的特征是具有端-基极性且细胞与细胞间保持紧密的连接,他们紧密的排列并粘附于肾小管基底膜上形成单层结构,因此几乎没有运动能力,而成纤维细胞没有粘附到任何膜上,没有细胞极性,也不会形成单层结构,能够自由的移动。在外界诱导因素刺激下,发生EMT的肾小管上皮细胞转化为间充质成纤维细胞,获得迁移和侵袭能力,穿过肾小管基底膜,转化为能分泌大量ECM的肌成纤维细胞,参与RIF进程[12],因此迁移和侵袭能力可间接反映细胞EMT的程度。本实验用划痕实验法检测TGFβ1诱导24 h后HK-2细胞的迁移能力,实验结果表明,在TGF-β1诱导24 h后,模型组HK-2细胞迁移率显著升高,说明肾小管上皮细胞发生转分化,符合EMT模型特征。给以芒果苷元后,HK-2细胞迁移率有不同程度的下降,提示芒果苷元能抑制TGF-β1诱导的HK-2细胞的迁移,抑制EMT的进程。Transwell法可用于检测细胞侵袭能力,将细胞接种于预先铺好Matrigel的上室,培养24 h,再将穿膜细胞进行计数来评估细胞的侵袭能力,本实验中,模型组HK-2细胞穿膜数显著增多,提示TGF-β1诱导后细胞获得侵袭能力,能够穿过Matrigel,给以芒果苷元后,HK-2细胞侵袭能力显著下降,提示芒果苷元能降低由TGF-β1诱导的细胞侵袭,抑制EMT的发展。
RIF的主要特征即为ECM在肾间质的积聚,肾脏ECM成分主要来源于活化的间质成纤维细胞和肌成纤维细胞,肌成纤维细胞可由多种细胞转化而来,其中肾小管上皮细胞是肌成纤维细胞的重要来源之一,有研究表明肌成纤维细胞分泌ECM的能力是成纤维细胞的4~5倍,表明肾小管上皮细胞EMT在RIF发生发展过程中具有重要作用。肾脏ECM成分主要包括胶原,糖蛋白以及蛋白聚糖三类物质,在正常生理条件下,肾小管上皮细胞即可产生少量ECM成分,用于形成肾小管基底膜以及维持肾脏生理结构,FN属于糖蛋白类ECM,FN在生理状态下少量表达参与肾小管基底膜的形成,而在外界刺激发生EMT时,FN的沉积最早出现并持续增加,FN的表达水平可用来评判纤维化程度,而胶原成分中的ColⅠ常常被认为可以引发肾脏纤维化,ColⅠ的高表达与肾脏纤维化的发生密切相关[12-14]。本实验中,TGFβ1诱导HK-2细胞48 h后,模型组HK-2细胞中FN和ColⅠ蛋白表达水平显著上调,给以芒果苷元后,蛋白表达均显著下调,提示芒果苷元可降低FN、ColⅠ等ECM成分延缓EMT。
