CYP11B2基因-344C/T多态与云南双河乡彝族人群原发性高血压的相关性
2021-07-29彭红瑜范志祥张延洁张馥麟
彭红瑜,范志祥,张延洁,舒 芯,张馥麟,龙 莉
(昆明医科大学细胞生物学和医学遗传学系,云南 昆明 650500)
原发性高血压(essential hypertension,EH)是一种受到遗传与环境双重作用的多因素复杂疾病,目前其发病机制尚不明确[1]。在中国,临床上90%以上的高血压患者为原发性高血压,具体临床表现为头晕乏力、失眠健忘等[2],原发性高血压是导致心、脑血管病和肾衰竭的独立危险因素,对人类健康与社会生活造成了极大威胁[3]。经过抽样调查发现,不同地区生活的同一民族,同一地区生活的不同民族间会表现出高血压标化患病率的差异[4]。早在1981年已有研究证实凉山彝族的血压水平可能是全国甚至全球最低的,其血压几乎不随年龄增加而上涨[5],本研究以云南省晋宁县双河乡彝族居民为研究对象,探究了高血压的重要候选基因—醛固酮合成酶(CYP11B2)基因-344C/T位点多态性是否与该地区彝族原发性高血压易感性相关,为我国少数民族高血压防治及研究CYP11B2基因在高血压中的作用机制奠定基础。
1 资料与方法
1.1 研究对象
在云南省昆明市晋宁县双河乡本地彝族居民中随机抽取267例健康者与132例原发性高血压患者,年龄分布在29~88岁之间。EH组诊断标准为:收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg,不同时间点诊断3次异常[6];对照组纳入标准为:收缩压<140 mmHg,舒张压<90 mmHg。EH组与对照组中排除继发性高血压,心肌梗死,先天性心脏病,持续性房颤等心血管病,排除糖尿病、肝肾功能异常者,EH组入选男性52名,女性80名,共计132名,对照组入选男性75名,女性101名,共计176名。本次实验已获得昆明医科大学伦理委员会批准,对本次调查所有参与者均已知情并同意。
1.2 研究方法
收集所有实验对象身高、体重、腰围、臀围、收缩压、舒张压等临床数据,计算体重指数(BMI)=体重/身高2(kg/m2),腰臀比(WHR)=腰围(cm)/臀围(cm),脉压指数(PPI)=(收缩压-舒张压)/收缩压,并进行统计分析。
采集受试者外周血,酚-氯仿法提取基因组DNA,分组编号后置于-20 ℃冰箱保存备用。采用PCR-RFLP技术以不同样本DNA为模板配制20 μL PCR体系,引物序列如下:F:5′-CAGGA GGAGACCCCATGTGAC-3′;R:5′-CCTCCACCC TGTTCAGCCC-3′(北京擎科生物科技公司合成)。PCR仪循环条件为:98 ℃,2 min;98 ℃,15 s;58 ℃,15 s;72 ℃,30 s,共38个循环;最后72 ℃,2 min,4 ℃保存备用。PCR产物使用1.5%的琼脂糖凝胶电泳检测,GelRed(北京擎科生物科技)染色后有目的条带则继续用Hae III(Thermo Fisher Scientific)内切酶酶切,37 ℃水浴4 h,确保DNA片段被完全切开,4%琼脂糖凝胶电泳分离条带,Bio-Rad凝胶成像系统拍照,Image-Lab软件分析。
1.3 统计学处理
分别计算EH组与对照组CYP11B2基因-344C/T位点的基因型频率和等位基因频率,采用SPSS 22.0软件进行数据分析。χ2检验检测哈迪·温伯格遗传平衡、组间基因型频率及等位基因频率;计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料比较
与对照组相比,EH组中人群年龄及性别分布均无统计学差异(P>0.05)。EH组人群体重指数,脉压指数均高于对照组,腰臀围比值则低于对照组(P<0.05),EH组为实验组,见表1。
表1 EH组和对照组一般临床资料比较()Tab.1 Comparison of the general clinical data between EH group and control group()
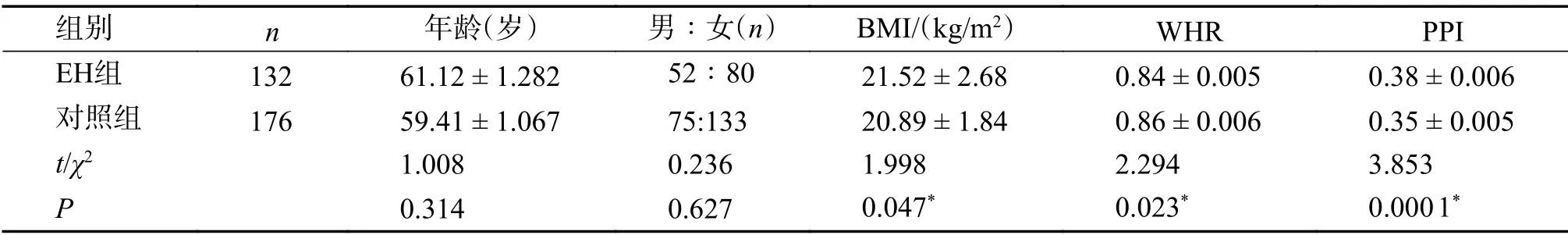
表1 EH组和对照组一般临床资料比较()Tab.1 Comparison of the general clinical data between EH group and control group()
*P<0.05。
2.2 CYP11B2基因-344C/T位点基因型鉴定
PCR产物电泳后得到长为537 bp的目的片段(图1),有目的条带的产物经限制性内切酶HaeIII酶切后,等位基因T产生273 bp片段,当T和C发生互换时会产生酶切位点,酶切产生202 bp和71 bp两条带,故 TT基因型会产生273 bp,138 bp,126 bp 3个片段,CT型会产生273 bp,202 bp,138 bp,126 bp和71 bp共5个片段,CC型会产生202 bp,138 bp,126 bp和71 bp共4个片段,由此可以鉴定出所有基因型。但71 bp片段过小很难被琼脂糖凝胶电泳检测到,故胶图中无法观察到71 bp条带,见图2。
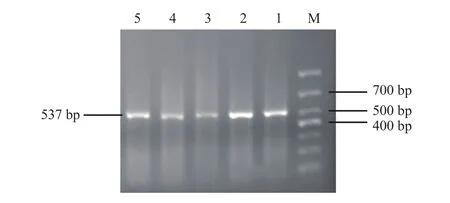
图1 CYP11B2基因-344C/T位点PCR产物Fig.1 PCR product of CYP11B2-344C/T

图2 CYP11B2基因-344C/T位点不同基因型Fig.2 Different genotype of CYP11B2-344C/T
2.3 CYP11B2基因-344C/T位点多态性在彝族EH组与对照组中的分布比较
EH组与对照组CYP11B2基因-344C/T位点多态性分布(χ2=0.655,P=0.721;χ2=0.458,P=0.795)均符合哈迪温伯格遗传平衡,具有群体代表性。在云南彝族EH组与对照组人群中分别统计CYP11B2基因-344C/T位点基因型频率、基因频率,2组的比较结果如表2所示。总体而言,EH组与对照组基因型TT,CT,CC的分布频率较接近,等位基因T频率与等位基因C频率差异不大(P>0.05)。在男性中,EH患者较对照组基因型频率与等位基因频率差异不大(P>0.05);在女性EH患者中,基因型TT频率高于对照组(P<0.05),但基因型CT、CC及等位基因频率与对照组相比无显著差异(P>0.05)。
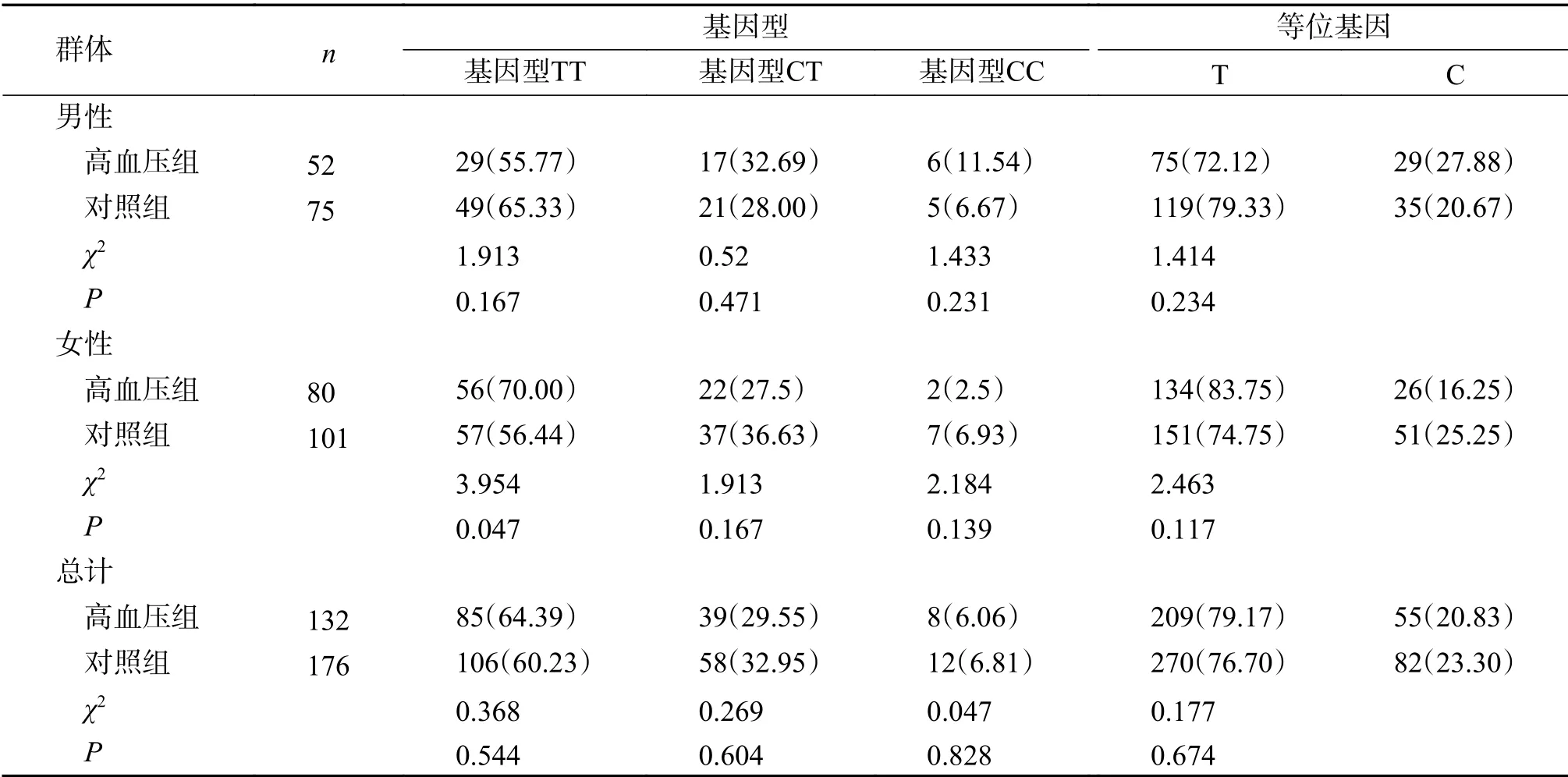
表2 CYP11B2基因-344C/T位点基因型频率在EH组与对照组人群中的分布[n(%)]Tab.2 CYP11B2-344C/T genotype frequency in control group and EH group [n(%)]
2.4 CYP11B2基因-344C/T多态性在彝族不同性别人群中的分布
CYP11B2基因-344C/T位点多态在彝族正常人群中不存在性别差异(P>0.05),而其在EH组人群中分布结果如下,在132例受试者中,TT,CT,CC基因型频率分别为64.39%,29.55%,6.06%,等位基因T、C频率为79.17%,20.83%。在不同性别的患者中,基因型频率和基因频率显著不同,其中女性患者TT基因型频率为70.00%,高于男性患者的55.77%,女性患者基因型CC的频率为2.50%,低于男性的11.54%(P<0.05),女性EH患者对比男性患者等位基因T分布频率较高,等位基因C分布频率较低(P<0.05),存在性别差异,见表3。
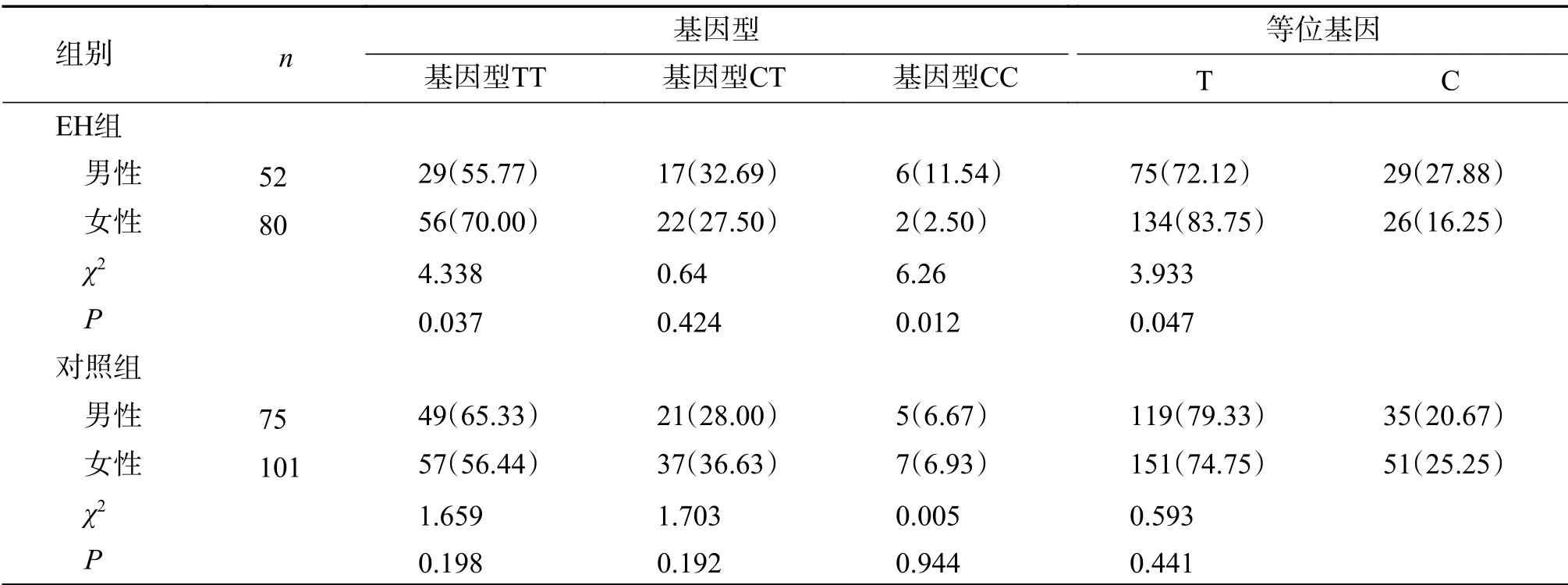
表3 CYP11B2基因-344C/T位点多态性在彝族EH患者中的分布[n(%)]Tab.3 CYP11B2-344C/T polymorphism in YI population of EH group [n(%)]
3 讨论
原发性高血压是遗传因素和环境因素共同决定的复杂疾病,其中遗传因素在原发性高血压的发病中约占76%[7]。识别原发性高血压的易感基因,不仅有利于阐明原发性高血压的发病机制,还讲对该病的治疗、预后判断、早期检出以及预防等产生重大影响。目前已知的原发性高血压的候选基因涉及肾素-血管紧张素-醛固酮系统、交感神经系统、水盐代谢等[4]。肾素-血管紧张素-醛固酮系统,包括血管紧张素原(angiotensinogen,AGT)、血管紧张素转换酶(angiotensin converting enzyme,ACE)和醛固酮合成酶(cytochrome P450 family 11 subfamily B member 2,CYP11B2)等维持机体钠稳态和血压平衡的关键因子,参与血压调节。CYP11B2基因属于细胞色素 P450 基因超家族,定位于8q22,总长约为7 kb,含八个内含子和九个外显子,编码蛋白醛固酮合成酶,该酶可催化脱氧皮质酮逐步生成皮质酮、18-羟皮质酮和醛固酮[8],是醛固酮合成系统的关键限速酶。-344C/T变异位于CYP11B2 基因顺式作用元件SF-1因子结合区,等位基因C与SF-1因子结合的能力明显强于T等位基因,该变异可影响醛固酮的合成分泌[9],而醛固酮增多会引发血压升高等疾病[10-13]。在我国黑龙江省汉族人群,延边自治州朝鲜族人群,内蒙古自治区蒙古族人群中均发现CYP11B2基因-344位点C/T突变会增加高血压的患病风险[14-17]。
但是本研究发现CYP11B2基因-344C/T位点多态与中国云南彝族人原发性高血压不相关,推测原因可能有两点:(1)由于不同地区、不同民族生活习俗,经济文化和遗传背景的差异,历年来高血压流行病学普查资料及各项研究均显示,各民族高血压患病率及易感基因存在明显差异[18],也有研究证实CYP11B2基因-344C/T多态与原发性高血压的相关性存在民族、种族特异性,例如CYP11B2基因-344C/T多态与中国山东汉族人群原发性高血压相关,但与怀化侗族人群原发性高血压不相关[19-20];在葡萄牙人群中发现,CYP11B2基因-344T等位基因频率与原发性高血压不相关,而在埃及人群中则表现出相关性[21-22]。(2)单基因单突变位点相关性分析无意义,不能代表该基因与高血压完全不相关,在中国福建汉族人群中,CYP11B2基因-344C/T多态与该地区汉族原发性高血压无关,但与ACE,ADDUCIN基因多态联合分析则有统计学差异[23]。CYP11B2基因-344C/T位点突变与印度人群高血压风险无关,联合CYP11B2基因-344C/T位点突变、2号内含子转换突变以及3号外显子K173R多态协同分析则与该地区人群高血压易感性相关[24],提示原发性高血压发病因素复杂,单一基因分析无差异可能是因为原发性高血压是由多种基因协同调控,单个基因的突变位点并不唯一,多位点突变也可能共同影响疾病的发生发展。
本研究还发现,女性高血压患者基因型TT分布频率高于对照组,且在EH组人群中CYP11B2基因-344C/T位点多态性表现出了性别差异,而对照组中则没有性别差异。这与之前的一些研究类似,2011年,杜志荣等[3]发现CYP11B2基因-344C/T位点多态与新疆哈萨克族人原发性高血压患病风险无关,但C-344T可能增加男性患病风险;牛文全等[25]在北方汉族人群中发现CYP11B2基因多态与女性高血压患者易感性相关,但不影响整体汉族人群高血压易感性;徐新娟等[26]发现CYP11B2基因-344C/T多态性可能与新疆巴里坤哈萨克族女性高血压有关,但群体相关分析结果无差异。在笔者的研究中,云南彝族女性高血压患者中,CYP11B2基因-344位点C被替换为T的概率更高,而男性患者CYP11B2基因则相对保守。CYP11B2基因在原发性高血压与性别之间的联系目前尚无定论,有研究认为Y染色体上存在一个或多个与男性血压相关的位点,CYP11B2基因多态可能与Y染色体上的相关位点互作引起血压升高[27],也有研究指出CYP11B2基因-344C/T多态性与高血压性别特异性的关联可能与SF-1位点与雌激素相关受体(ERRa)连接作用有关[28]。
除上述结果外,本研究还发现对照组的体重指数、脉压指数均显著低于EH组人群,而腰臀围比值则高于EH组(P<0.05),说明肥胖可能是引发彝族人群原发性高血压的原因之一,但腰腹部脂肪堆积可能不是云南彝族人群原发性高血压发病的主要诱因。肥胖可以引发血压升高等多种疾病已被证实[29],但腰腹部脂肪堆积对高血压发病的影响尚未可知,该结果仍需扩大样本量后继续验证。原发性高血压更深入的机制还有待挖掘,下一步笔者将继续收集样本,扩大研究群体,做上下游多基因,多突变位点联合分析,为研究原发性高血压的遗传因素与高血压防治提供实验资料。
