低强度聚焦超声刺激小鼠伏隔核的有效性
2021-07-29兰云艳冯煜然杨振东
兰云艳,冯煜然,郑 宇,杨振东,赵 诣,朱 梅
(昆明医科大学第一附属医院超声科,云南 昆明 650032)
近年来,神经调控技术逐渐发展为神经机制科学研究的重要工具,也在脑功能疾病的治疗方面有着新兴的发展:脑深部刺激(deep brain stimulation,DBS)、迷 走 神 经 刺 激(vagus nerve stimulation,VNS)、重复经颅磁刺激(repeated transcranial magnetic stimulation,rTMS)等神经调控技术已被美国食品和药品管理局(food and drug administration,FDA)批准治疗帕金森病、肌张力障碍、强迫症、癫痫和抑郁症等疾病[1]。以上常用的神经调控技术能有效促进或抑制脑功能疾病患者的大脑认知功能,然而均受到了空间聚焦能力以及操作创伤性的限制。超声神经刺激可以无创经颅靶向特定的大脑区域并调节特定的神经通路或神经元,神经调控常运用低强度聚焦超声(low-intensity focused ultrasound,LIFU)进行刺激。LIFU结合了操作无创性、空间分辨率高以及靶点控制便捷等特性,在脑科学领域拥有美好的发展前景。伏隔核(nucleus accumbens,NAc)是中脑边缘奖赏环路的关键节点,常作为干预包括成瘾在内的各种精神障碍的靶点[2]。目前国内外鲜有关于LIFU调控NAc的实验研究。本研究旨在通过对小鼠的NAc脑区进行超声刺激,观察小鼠行为学的改变、NAc超微结构的改变及单胺类神经递质含量的变化,初步探讨超声神经刺激的作用机制,为脑科学的新兴治疗提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 动物与分组C57BL/6小鼠,雄性,6~7周龄,体质量18~22 g,共100只,购自湖南斯莱克景达实验动物有限公司,实验动物许可证编号:SCXK(湘)2019-0004。适应性饲养1周后将其随机分为实验组和对照组各50只,待超声刺激及假刺激后,2个大组内又随机分为行为学评估30只(分别进行强迫游泳、旷场和水迷宫实验)、电镜检测10只和神经递质检测10只,立刻进行相关检测。实验动物的处理方法均经昆明医科大学实验动物管理委员会审核批准。以上实验分批次进行,各批次间开始超声刺激的时间、超声刺激参数等严格控制不变。
1.1.2 试剂与仪器多巴胺(Dopamine,DA)、去甲肾上腺素(Norepinephrine,NE)、5-羟色胺(5-Hydroxytryptamine,5-HT)ELISA试剂盒(上海哈灵生物科技有限公司);;强迫游泳、旷场实验、Morris水迷宫、脑立体定位仪、小动物麻醉机(江苏赛昂斯生物科技有限公司);超声神经刺激仪(中国科学院深圳先进技术研究院);全自动样品快速研磨机(上海净信实业发展有限公司);全波长酶标仪(昆明医科大学第一附属医院科研中心实验室提供)。
1.2 实验方法
1.2.1 超声刺激浓度为1.5%的异氟烷麻醉小鼠,将小鼠固定于脑立体定位仪上,根据小鼠脑图谱找到NAc所在位置(以Bregma为坐标原点,X轴±0.05 cm,Y轴+0.12 cm),见图1。超声神经刺激仪进行超声辐照,探头频率0.5 MHz,脉冲重复频率(Pulse repetition frequency,PRF)1 000 Hz,脉冲声压590 kPa,脉冲时间0.5 ms,脉冲周期1 ms,刺激时间300 ms,刺激间隔3 s,刺激总时间10 min,每日2次,持续7 d。对照组以同样的方式操作,不开启设备。

图1 LIFU刺激小鼠NAc图Fig.1 Image of NAC stimulated by LIFU
1.2.2 行为学评价(1)强迫游泳:小鼠被放入装有水的圆柱形透明水缸中,让小鼠强迫游泳6 min,视频摄像观察第2~6 min时间内小鼠漂浮不动的时间。
(2)旷场实验:实验装置为由木板制成的无盖方箱,检测时将小鼠逐只放置在方箱中央,摄像记录小鼠在5 min内的行为和活动情况。检测指标包括:小鼠在旷场内行进总距离、行进平均速度、中心区活动距离、中心区停留时间以及中心区穿越次数。
(3)Morris水迷宫:Morris水迷宫通过等距的边缘和方向将水池划分为四个象限。第一象限为目标象限,平台放至第一象限。测试前一天将每组小鼠放在平台上15 s以适应环境,并让它们自由游泳1 min。1~6 d进行空间导航实验,每组小鼠在平台上放置15 s,后按四个象限顺序依次放入水中,小鼠登上平台并停留5 s视为上台成功,最长测试时间为60 s。如果小鼠在60 s后仍未登上平台,则引导其至平台停留10 s以强化记忆。第7 d撤去平台,将小鼠由目标象限的对位象限(即第三象限)放入水中,进行60 s的空间探索实验。以定位航行实验目标象限的对面象限(即第三象限)为入水点的逃避潜伏时间(小鼠登上平台所用的时间)、跨越平台的次数和目标象限的停留时间为检测指标评价小鼠的学习记忆能力。
1.2.3 神经元超微结构观察超声干预结束后,8%水合氯醛(0.1 mL/10 g)麻醉小鼠,开胸暴露心脏,在右心耳开一小口,于心尖(左心室)快速灌注预冷的生理盐水,直至灌注液接近无色,换用4%多聚甲醛继续灌注,灌注结束后于冰上迅速取脑,用预冷的生理盐水冲洗残留血液,滤纸拭干后,参照小鼠脑图谱迅速分离NAc至1 mm3,置于含3%戊二醛的1.5 mL EP管中,4 ℃保存待送电镜室。
1.2.4 单胺类神经递质含量测定超声干预结束后,8%水合氯醛(0.1 mL/10 g)麻醉小鼠,断头处死,于冰上迅速分离脑组织,取NAc,用预冷的PBS冲洗残留血液,称重后剪碎。按1 g∶9 mL的重量体积比往剪碎的NAc组织中加入对应体积的PBS,后于高通量研磨仪中充分研磨。最后将匀浆液于5 000×g离心10 min,取上清,根据ELISA试剂盒说明书进行检测。
1.3 统计学处理
实验数据用SPSS25.0进行统计分析,正态分布的计量资料用表示,2组间差异用独立样本t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 2组小鼠强迫游泳实验结果比较
如表1所示,在强迫游泳实验中,超声刺激组小鼠在水中漂浮不动的时间为46.29 s,明显长于对照组的16.67 s(P<0.001),表明超声刺激组小鼠在无可逃避的压迫环境中兴奋性降低,表现出绝望不动的状态,在生理和心理上均表现出类似抑郁的症状。
表1 LIFU对小鼠强迫游泳实验漂浮不动时间的影响()Tab.1 Effect of LIFU on floating immobility time of mice in forced swimming experiment()

表1 LIFU对小鼠强迫游泳实验漂浮不动时间的影响()Tab.1 Effect of LIFU on floating immobility time of mice in forced swimming experiment()
与对照组比较,***P<0.001。
2.2 2组小鼠旷场实验结果比较
如表2所示,旷场实验中,超声刺激组小鼠较对照组在旷场中行进总距离、行进平均速度、中央区活动距离、中央区停留时间和中央区穿越次数均显著减少(P<0.05,P<0.01),表明超声刺激组小鼠在面对空旷陌生的环境时表现出探究欲望减少、自主活动减少等类似焦虑的行为状态。
表2 LIFU对小鼠旷场实验各项指标的影响()Tab.2 Effects of LIFU on various indicators of open field experiment in mice()

表2 LIFU对小鼠旷场实验各项指标的影响()Tab.2 Effects of LIFU on various indicators of open field experiment in mice()
与对照组比较,*P<0.05,**P<0.01。
2.3 2组小鼠水迷宫实验结果比较
如表3所示,水迷宫实验中,超声刺激组小鼠较对照组逃避潜伏时间明显延长,穿越平台次数明显减少,在目标象限停留时间明显缩短(P<0.05,P<0.01)。如图2所示,超声刺激组小鼠较对照组游泳距离明显较长,且在目标象限活动的路程明显较短,表明超声刺激组小鼠空间学习记忆能力明显减弱。
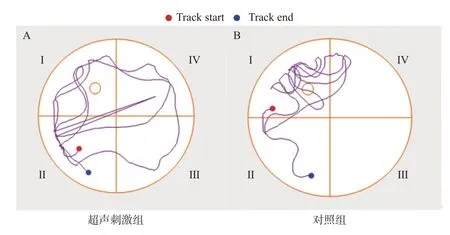
图2 2组小鼠的游泳路径图Fig.2 Swimming paths of the two groups of mice
表3 LIFU对小鼠水迷宫实验各项指标的影响()Tab.3 Effects of LIFU on various indicators of water maze experiment in mice()

表3 LIFU对小鼠水迷宫实验各项指标的影响()Tab.3 Effects of LIFU on various indicators of water maze experiment in mice()
与对照组比较,*P<0.05,***P<0.001。
2.4 2组小鼠神经元超微结构改变
对照组神经元核大、圆,核仁多,染色质多,核膜清晰(图3A),胞浆内细胞器丰富,内质网、高尔基体等结构清晰正常,线粒体结构基本正常,可见较清晰的内嵴与膜(图3B)。超声刺激组神经元肿胀、变性甚至坏死,细胞核变小、溶解、固缩,染色质减少,核质界限不清(图3C),胞浆内细胞器减少或消失,内质网扩张,线粒体内嵴排列紊乱或消失,呈空泡状(图3D)。

图3 小鼠伏隔核神经元的超微结构Fig.3 Ultrastructure of mouse nucleus accumbens neurons
2.5 2组小鼠单胺类神经递质含量测定结果
如表4所示,超声刺激组与对照组比较,小鼠NAc单胺类神经递质NE、DA、5-HT的含量均明显降低(P<0.000 1),表明超声刺激一定程度上降低了中枢神经系统的兴奋性。
表4 LIFU对小鼠单胺类神经递质含量的影响()Tab.4 Effects of LIFU on monoamine neurotransmitters in mice()

表4 LIFU对小鼠单胺类神经递质含量的影响()Tab.4 Effects of LIFU on monoamine neurotransmitters in mice()
与对照组比较,**P<0.000 1。
3 讨论
LIFU通过超声换能器提供可精确调控的超声波(机械波),作用于指定脑区,实现对该部位神经核团的精准刺激,诱发其神经活动和功能状态的改变,从而在宏观上实现神经环路和功能网络的有效调控[3]。LIFU提供了一种空间分辨率高、穿透深度大的非侵入性技术,在基础和临床神经科学研究中已被证明是一种有效的神经调节工具[4-9]。LIFU可以通过传递机械振动来激活或抑制神经元活动,而不会造成不可逆的损伤。有研究发现通过改变超声频率、超声强度、脉冲重复频率、占空比及作用时间等超声参数,不仅可以抑制刺激部位兴奋性,而且可以根据声强和能量沉积率增强其兴奋性。Yoo等[10]用不同参数的LIFU刺激兔的视觉区域,发现在100 Hz PRF、3.3 W/cm2Isppa的超声作用下兔的视觉诱发电位(visual evoked potential,VEP)幅值降低,而较高强度的超声作用导致VEP幅值升高。Kim等[11]在大鼠中也发现了类似的反应。LIFU介导的神经调节的这种双向性特征,表明其在神经治疗应用中具有多功能性。然而,这些研究中超声脉冲参数的范围相当有限,需要进一步的研究来阐明导致兴奋性或抑制性神经活动的脉冲参数。
近年来,为数不多的文献以动物模型行为学为评价指标报道了LIFU的神经调控作用。孟文[12]将LIFU施加到阿尔兹海默症疾病(Alzheimer' s disease,AD)模型小鼠的海马上,观察到各组小鼠在中央区活动时间无显著差异,而AD小鼠的自主学习能力有所提升,结果表明超声刺激没有增加AD小鼠的焦虑情绪,但是提高了AD小鼠的学习记忆能力(100 Hz PRF、5%占空比)。Lin等[13]用LIFU刺激AD模型大鼠海马,水迷宫实验示超声刺激组比模型组的逃避潜伏时间显著缩短,说明LIFU显著改善了AD大鼠的学习记忆能力(1 Hz PRF、5%占空比)。现有研究表明,超声可以调节神经递质的表达水平,Min等[14]和Yang等[15]的研究显示,LIFU作用于大鼠丘脑20 min,额叶细胞外GABA、DA、5-HT水平在超声作用后开始下降,并在超声作用2 h后保持在基线水平的82%左右。Wang等[16]使用超声刺激PD小鼠模型,发现超声可以增加脑内纹状体DA含量,提高PD模型的运动能力。Constans等[17]使用FUS结合超声造影剂安全开放了猕猴的血脑屏障,并增加了脑内GABA的含量。
本实验以正常小鼠为研究对象进行超声神经调控的研究,从行为学、形态学以及神经生物化学多个方面评价超声刺激后小鼠的改变。在行为学水平,实验结果说明经颅超声刺激小鼠后产生了类似抑郁和焦虑的症状,学习记忆功能下降。在形态学方面,透射电镜示超声刺激后NAc神经元肿胀,神经纤维溶解、变性、坏死,胞浆内细胞器减少或消失。在神经生物化学层面,ELISA结果示DA、NE、5-HT含量下降,表明超声刺激一定程度上降低了中枢神经系统的兴奋性。综上,本实验研究结果表明聚焦超声剌激对正常小鼠大脑有一定的抑制性神经调控作用。本次研究采用1 000 Hz PRF,50%占空比的脉冲超声刺激小鼠NAc,实验结果示超声刺激后小鼠单胺递质含量减少,影响了神经信息的正常传递,情绪调节的神经网络被抑制,进而导致学习记忆能力下降,并产生了类似抑郁和焦虑的症状,得到了与上述研究相反的结果。针对这一结果作出以下可能的分析:本次研究采用了更高的PRF和占空比,超声参数的不同可能引起不同的结果,孟文的研究[12]也说明了超声对神经元的调控具有双向性。且上述研究使用AD模型小鼠,其神经系统已发生了病理改变,而本次研究使用的是神经系统功能正常的小鼠,这也可能是导致不同结果的原因之一。
综上所述,本次研究给予小鼠NAc聚焦超声剌激对小鼠大脑产生了一定的抑制性神经调控作用,并在强迫游泳、旷场和水迷宫实验结果中有所体现。且超声诱导了NAc的形态学以及神经生物化学改变,这可能是超声发挥神经调控作用的机制之一。
本实验成功对小鼠进行超声神经调控,诱导正常小鼠行为学、神经元形态学以及神经生物化学改变,证明LIFU对小鼠可产生抑制性的神经调控作用,为其下一步应用于疾病模型研究提供超声参数依据以及机制研究基础。
