香港牡蛎中锌元素的分布及存在形态
2021-07-25曹文红章超桦秦小明高加龙郑惠娜
韩 蓉,曹文红,2,章超桦,2,秦小明,2,高加龙,2,郑惠娜,2
(1.广东海洋大学食品科技学院//国家贝类加工技术研发分中心(湛江)//广东省水产品加工与安全重点实验室//广东省海洋生物制品工程实验室//广东省海洋食品工程技术研究中心//水产品深加工广东普通高等学校重点实验室,广东 湛江,524088;2.大连工业大学海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连,116034)
锌是正常人体生命过程中不可缺少的元素,在人体内的各种生理活动中起着重要的影响和调节作用[1]。缺锌会引发各种不良作用,易引起食欲减退、免疫功能低下、创伤不易愈合、小脑发育迟缓、男性性功能障碍等[2]。锌元素在生物体内的存在状态主要包括有机态和无机态两种,无机锌生物利用率较低且有毒副作用,有机锌才易于吸收[3-4]。已有研究表明,多糖或蛋白与锌结合后生物活性加强及有益于机体的有效吸收[5-6],锌结合肌动蛋白可以保护神经元,锌结合多糖可以降低血压,锌结合金属硫蛋白可以抗氧化[7-8]。因此,天然来源的生物锌更具有效性和安全性。
牡蛎是已知的含锌量最高的海洋贝类[9],前人对于牡蛎中锌元素的研究主要局限于锌含量的测定及生物功能的研究,目前尚未有关于牡蛎锌元素形态的研究报道,故起生物功能作用的锌的形态目前还不清楚。基于此,本研究对香港牡蛎(Crassostrea hongkongensis)的锌含量、组织分布及存在形态进行详细检测分析,为阐明其生物活性、揭示其安全性和功能性、探究最佳开发利用途径提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活香港牡蛎原料,采集季节在7 月份,其长度(11.68±0.93)cm,质量(166.50±16.79)g,由广东粤之宝水产有限公司提供。运回实验室后开壳取肉,用超纯水清洗牡蛎肉后用吸水纸吸干其表面水分备用。
D101 大孔树脂,中国安徽三星树脂技术有限公司;二乙氨基乙基纤维素52(DEAE-52),美国Whatman 公司;扇贝成分分析标准物质(GBW10024),物理地球化学勘查研究所;锌元素标准物品,美国Agilent 科技公司。硝酸、氯化钠、氢氧化钠为优级纯,其余均为分析纯;试验中用水为超纯水。
1.2 仪器与设备
微波消解仪,奥地利Anton Paar Multiware PRO公司;7500cx 电感耦合等离子体质谱(ICP-MS),美国Agilent 公司;BRUKER TENSOR 27 傅立叶红处光谱仪,德国Bruker 公司;FDU551 冷冻干燥机,东京理化器械株式会社;Eyela 旋转蒸发仪,东京理化器械株式会社。
1.3 方法
1.3.1锌元素检测样品的制备 将牡蛎肉样品随机均分成2 组。第1 组将牡蛎分解为外套膜、内脏团、鳃、闭壳肌4 个组织部分,各组织部分充分匀浆后进行锌含量的比较分析。第2 组将牡蛎全脏器充分均浆后进行40 ℃水提2.6 h,稍冷后以9 874 g离心20 min,上清液经孔径0.45 µm 微孔滤膜抽滤得提取液,对提取液及残渣分别进行有机态和无机态锌元素的比较分析。
1.3.2锌含量分析样品的消解 称取牡蛎样品0.10~ 0.15 g(按干基计,精确至0.000 1 g,下同)或液体样品2 mL 于消解罐中,加入9 mL 硝酸和2 mL过氧化氢,在微波消解仪上消解。经历四个消解阶段(室温~ 120 ℃,5 min;120~ 150 ℃,5 min;150~ 185 ℃,20 min;185~ 70 ℃,20 min)后消化液呈无色透明或略带黄色取出消解罐,180 ℃赶酸至约1 mL,冷却后用超纯水定容至50 mL,混匀备用。同时制备试剂空白和扇贝成分分析标准物质(GBW10024)消解物进行质量控制。
1.3.3锌元素的 ICP-MS 分析 采用 7500cx ICP-MS 进行锌元素含量的测定。操作参数为:等离子气体流量15 L/min;辅助气体流量,1 L/min;载气流量,1 L/min;补充气流量,1 L/min;氦流量10 L/min;温度2 ℃;正向功率1 550 W;反射功率1 W;排气温度为35.5 ℃。
将锌标准品配置成质量浓度为0、2、5、10、20、50、100、200 µg/L 标准溶液,按浓度顺序分别导入电感耦合等离子体质谱仪,测其响应值,以质量浓度为横坐标,响应值为纵坐标,绘制标准曲线。对响应值与浓度值作线性相关系数检查,要求相关系数达到0.999 5< r ≤1,以保证试样分析结果的准确性。
1.4 提取液和残渣中有机锌与无机锌的分离和测定
1.4.1提取液中有机和无机锌的测定 参考文献[10]的方法用大孔吸附树脂(直径1.6 cm,长50 cm)对提取液进行离子交换柱层析,分别利用体积分数1% HNO3和30%乙醇溶液进行洗脱,收集洗脱液,减压蒸馏浓缩后消化定容,检测体积分数1%HNO3洗脱液中的无机锌、体积分数30%乙醇洗脱液中的有机锌含量。
1.4.2残渣中有机锌和无机锌的测定 牡蛎经水提、离心后的残渣按固液质量(g)体积(mL)比1∶1 加入6 mol/L HCL 溶液,混合后超声震荡30 min,以9 874 g 离心20 min,取上清液,对离心沉淀物重复操作2 次,合并上清液,消解后测定锌含量,即为残渣中无机锌含量。残渣总锌含量除去无机锌含量即为有机锌含量[11]。
1.5 提取液和残渣中蛋白、多糖组分的提取及锌含量的测定
1.5.1提取液中蛋白及多糖组分的提取 取100 g提取液,缓慢加入70 g 硫酸铵固体,搅拌均匀,充分溶解,于4 ℃下静置24 h,9 874 g 离心40 min后取沉淀,用适量pH 8.0 的10 mmol/L Tris-HCl 缓冲液溶解,用分子质量3 500 u 透析袋于4 ℃超纯水中透析4 d,完成脱盐后真空冷冻干燥制得蛋白组分。
取提取液80 g,与20 mL Sevag 溶剂(氯仿和正丁醇以体积比4∶1 混合而成)混合,在摇床上以120 r/min 转速震荡30 min,离心除去蛋白质等沉淀物,以上操作重复5 次,收集上清液,于旋转蒸发仪减压浓缩,浓缩定容后加入4 倍体积的无水乙醇,置于4 ℃冰箱中醇沉10 h,以9 874 g 离心30 min,所得的沉淀物为水溶性多糖,真空冷冻干燥制得多糖组分[12]。
1.5.2残渣中蛋白、多糖组分的提取 残渣中蛋白结合锌组分的提取参考文献[13]的方法,在磷酸盐溶液中对残渣进行高压均质提取。残渣中多糖结合锌组分的提取参考文献[14]的方法,采用氢氧化钾提取和乙醇沉淀。
1.5.3蛋白组分和多糖组分锌含量的测定 准确称取蛋白组分和多糖组分于微波消解仪中消解。消解后的溶液进行赶酸,且根据标准曲线的范围进行适当的稀释。同时制备试剂空白和扇贝成分分析标准物质(GBW10024)消解物进行质量控制。最后用ICP-MS 进行锌元素含量的测定。
1.6 锌多糖的分离纯化与分析
由于牡蛎主要以海水中的微藻为饵料,在其全脏器内脏团中有未完全消化的微藻,微藻中所含的糖会对本研究的结果造成干扰,故将牡蛎去内脏后单独提取其多糖组分,并进行分离纯化,以利于分析牡蛎体内存在的天然多糖锌。牡蛎多糖中存在不同电荷量的多糖,与离子交换剂DEAE-52 的结合能力存在差异,通过不同离子强度的氯化钠溶液逐级洗脱,使这些物质根据结合力大小依次从层析柱中分离出来,从而得到电荷量单一的牡蛎多糖[15]。
去内脏的牡蛎通过60 ℃水浴提取得到多糖提取液,提取液除蛋白后乙醇沉淀干燥后得到多糖组分。准确称取100 mg 去内脏牡蛎多糖组分,充分溶解于5 mL 超纯水中,依次用超纯水、0.1、0.2、0.3、0.4 和0.5 mol/mL NaCl 溶液以0.9 mL/min 的速度在预处理好的DEAE-52 离子交换柱(直径2.6 cm,长30 cm)中进行梯度洗脱,每个梯度收集25管,每管10 min。采用苯酚硫酸法检测每管中多糖含量,合并每个多糖洗脱峰,经旋转蒸发浓缩后透析(截留分子质量3 500 u),直至向透析液中滴入AgNO3溶液无沉淀为止,冷冻干燥得到纯化的多糖组分。在190~ 400 nm 波长范围内进行紫外可见光谱扫描,评估蛋白脱除效果。使用傅里叶变换红外光谱仪,在400~ 4 000 cm-1范围内进行扫描,探究多糖的官能团特征[16]。
1.7 数据分析处理
使用SPSS 19.0 分析实验数据,进行方差分析和均值比较以识别差异,P <0.05 被认为在统计学上差异显著,所有提取和分析均进行3 次重复。
2 结果与分析
2.1 锌元素在牡蛎各组织部位的分布
牡蛎的锌元素来源于海水及其摄食的饵料,一部分通过吸收、生物转化等途径转运至体内,成为机体组织成分,另一部分尚残留于未消化的饵料残渣中。香港牡蛎锌的总质量分数为(1 267.51±2.85)µg/g(干基,下同)。Bilandzic 等[9]对肉制品、鱼制品、贻贝中锌含量进行研究,发现牡蛎中的锌含量最高。锌元素在牡蛎各组织部位的分布见图1。
香港牡蛎的各个组织部分中锌含量呈现较大差异(图1_A)。鳃部锌的质量分数为(2 242.63±22.10)µg/g,外套膜中锌质量分数为(1 826.16±12.09)µg/g,内脏团中锌质量分数为(1 086.91±33.75)µg/g,闭壳肌中锌质量分数为(790.41±1.58)µg/g,牡蛎各组织部位间的锌含量具有显著差异(P<0.05)。这表明牡蛎不同的组织部位具有不同的锌富集能力,鳃在牡蛎的组织部位中具有最高的锌富集能力,这可能与鳃部是牡蛎的滤食器官有关。由于内脏团在牡蛎全脏器中的重量最大,内脏团中的锌在牡蛎全脏器总锌中的占比达45.46%,其次是外套膜含锌占比达28.71%,外套膜中的锌占比亦在20%以上(图1_B)。因此,牡蛎的锌元素主要存在于内脏团中。
2.2 牡蛎全脏器提取液及残渣中锌的含量及分布
为了探究牡蛎中锌元素的存在形态,对牡蛎全脏器提取液、残渣进行锌含量的分析。结果如图2_A所示,残渣中的锌质量分数为(1 050.76±38.10)µg/g(按干基计,下同),提取液中的锌质量分数为(177.50±3.59)µg/g;残渣和提取液的占比分别占全脏器中锌元素的82.90%和14.00%(图2_B)。水提取后牡蛎残渣中的锌含量极显著高于提取液中的锌含量(P <0.05),而Liu 等[10]发现金针菇提取液中的锌含量高于残渣中的锌含量,是因为金针菇中锌元素在70 ℃下从细胞内大量溶出,所以提取液中锌元素比残渣高。这一发现与本研究的结果不同,这可能与锌在牡蛎中的存在形态及结合物溶解性有关。
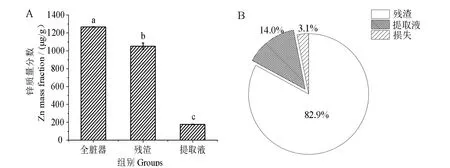
图2 牡蛎提取液和残渣中的锌含量及占比Fig.2 Contents and proportions of zinc in waster extract and the residue of oyster
牡蛎提取液中的锌元素为研究对象可更准确地检测提取液中有机态锌和无机态锌的含量。结果显示,在提取液中有机锌和无机锌的质量分数分别为(23.35±5.42)µg/g 和(135.22±2.34)µg/g(图3_A);有机锌和无机锌分别占14.02%和81.16%(图3_B)。无机锌的含量约为有机锌的6 倍(P <0.05),表明锌元素主要以无机态形式存在于提取液中。研究发现,牡蛎鳃中存在无机ZnO 纳米颗粒[17]。而在残渣中,有机锌和无机锌的质量分数分别为(450.31±41.89)µg/g 和(597.22±14.76)µg/g(图3_C);有机锌和无机锌分别占42.86%和56.84%(图3_D),表明残渣中存在着大量有机锌。总体而言,香港牡蛎全脏器中无机锌和有机锌的比例约为1.55∶1,有机锌的含量低于无机态锌的含量。
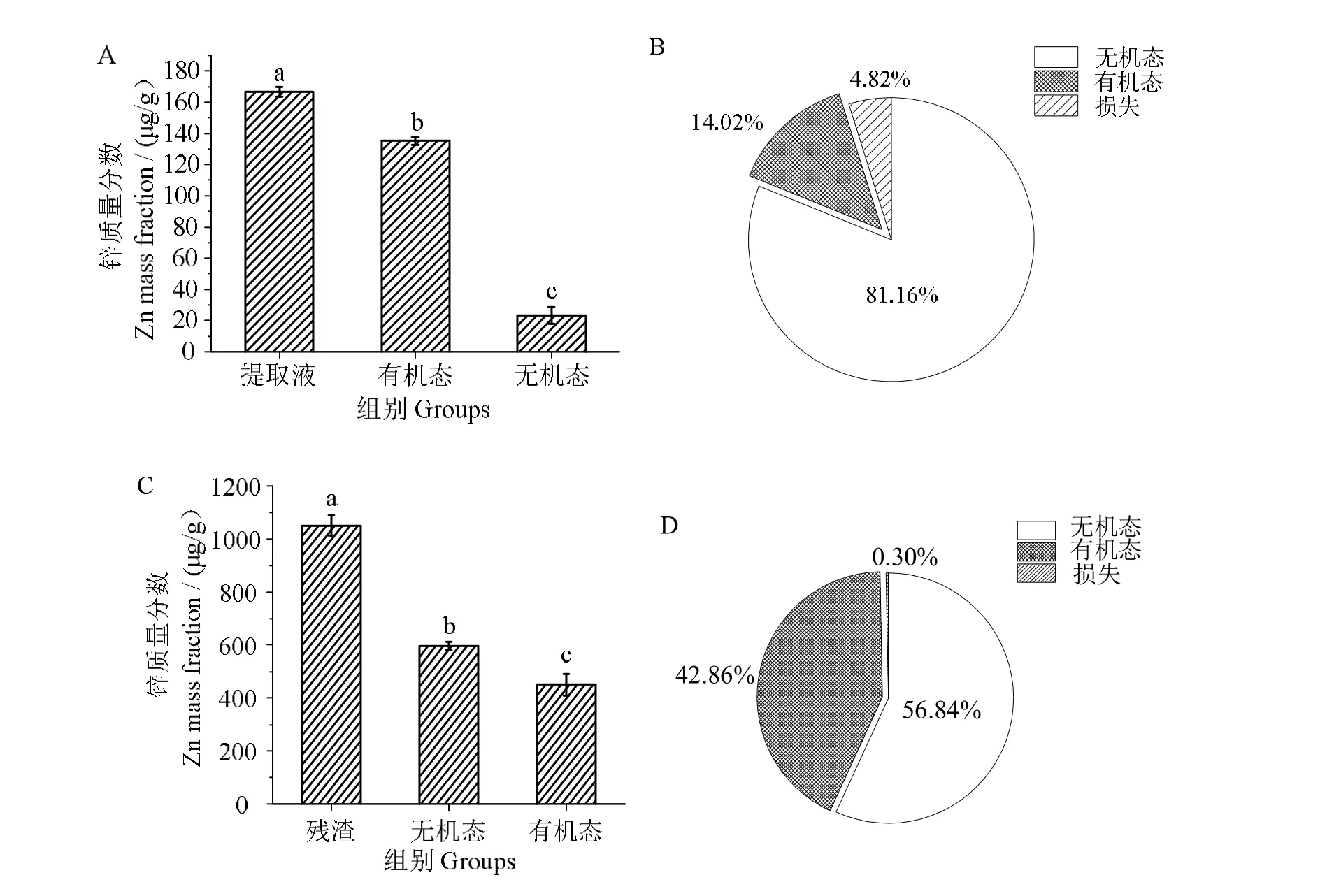
图3 牡蛎提取液及残渣中不同存在形态的锌含量和分布Fig.3 The content and distribution of different forms of zinc in the soluble solution and the residue of oyster
2.3 牡蛎蛋白组分、多糖组分的锌含量
蛋白质、多糖是牡蛎中除水分外最主要的组成成分,亦是牡蛎体内锌元素最可能结合的两种高分子有机物。为进一步探究锌元素的具体存在形态,分别对牡蛎提取液和残渣中的蛋白组分、多糖组分进行锌元素的检测,结果如表1 所示。
从表1 可知,提取液中蛋白和多糖组分的锌质量分数分别为(155.07±3.30)µg/g 和(1 137.52±19.78)µg/g。多糖组分比蛋白组分含有更多的锌,两者存在约7 倍的差异(P <0.05),这可能和溶液中多糖的官能团及所带电荷有关。已有研究发现,多糖的羟基和氨基能够与锌结合,多糖带有的负电荷亦可通过静电引力作用吸附锌[18-19]。牡蛎提取液中多糖组分的锌质量分数(1 137.52±19.78)µg/g显著高于灰树花多糖121.65 µg/g、树舌多糖(190±15)µg/g、羊肚菌菌丝体多糖860 µg/g、金针菇多糖(6.74±1.11)µg/g 等目前发现的含多糖的含锌量[20-23]。在加热过程中多糖容易发生聚集,但牡蛎多糖性质较稳定,可能存在更多与锌结合的位点,能结合更多的锌元素。残渣中的蛋白组分、多糖组分的锌质量分数分别为(766.15±18.25)µg/g和(253.50±4.00)µg/g,蛋白组分锌含量约是多糖组分锌含量的3 倍(P <0.05)。这可能是因为残渣中存在的蛋白能够结合锌。已有研究表明,肌动蛋白能够与锌结合,蛋白中的组氨酸、谷氨酸、天冬氨酸、半胱氨酸也能与锌结合[24]。牡蛎残渣中蛋白组分的锌质量分数(766.15±18.25)µg/g 比灰树花蛋白组分锌质量分数(107.25 µg/g)高。因此,香港牡蛎水溶性成分中有机态锌多存在于多糖组分中,而在水提取后的残渣中有机态锌多存在于蛋白质组分中。
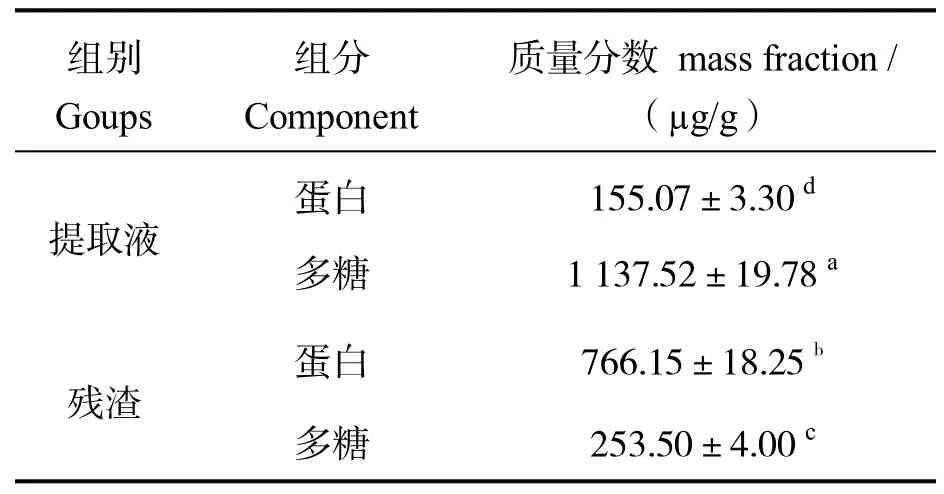
表1 牡蛎蛋白组分及多糖组分中锌的含量Table 1 Contents of zinc in protein and polysaccharide fractions of the oyster
2.4 去内脏牡蛎水溶多糖的分离纯化与分析
已有研究表明,多糖有抗氧化、抗衰老、降血脂、杀菌等生物活性,多糖与锌结合后生物活性加强及有益于机体的有效吸收[25-26]。香港牡蛎的提取液中多糖组分含有较高含量的锌元素,因此对牡蛎提取液里面锌多糖进行研究。经超纯水和0.1 mol/L NaCl 溶液的梯度洗脱之后,去内脏水提牡蛎锌多糖分离到两个多糖峰,水洗脱的组分(CT1)和0.1 mol/L NaCl 溶液的洗脱组分(CT2)(图4)。
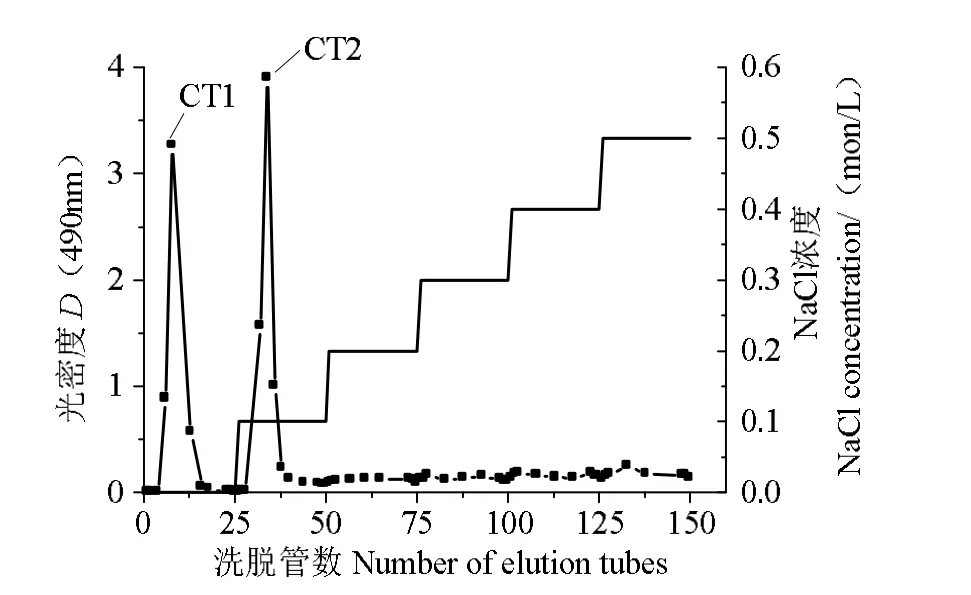
图4 基于DEAE-52 纯化去内脏牡蛎水提多糖Fig.4 Purification of the eviscerated oyster polysaccharide extracted by water on DEAE-52
去内脏牡蛎水提多糖的锌质量分数为821.59µg/g,低于全脏器水提多糖的锌含量,表明牡蛎内脏中未消化的藻类饵料亦含有丰富的锌多糖成分。经DEAE-52 分离纯化后得到CT1 和CT2 两种多糖组分,CT1 的锌质量分数达922.18 µg/g,而CT2仅为62.56 µg/g。这可能是因为CT1 组分中存在大量的与锌结合的位点,也可能是CT1 组分里面存在硫酸基、糖醛酸带电荷基团可以通过静电引力作用吸附锌。研究表明,牡蛎水解产物螯合锌的位点主要是羧基、羰基、氨基[27]。多糖结合锌后具有更广泛的生物活性,如抗氧化、降血脂、杀菌等。
2.5 去内脏牡蛎水溶多糖与锌结合特征的初步解析
牡蛎含大量蛋白质,为得到纯度高的多糖组分需要进行除蛋白工艺处理。蛋白是否大量除去的一个重要的判定方法是通过紫外的特征吸收峰的进行鉴定。紫外光谱扫描中蛋白和核酸的吸收峰一般在260~ 280 nm 之间,多糖的吸收峰一般在200 nm附近。由图5 可知,经过5 次除蛋白后的牡蛎粗多糖在260~ 280 nm 处吸收峰很弱,说明牡蛎粗多糖中只含有少量蛋白质,这些蛋白质可能是与多糖结合的糖蛋白。同时在200 nm 附近多糖特征吸收峰。经过DEAE-52 离子交换柱后的CT1 和CT2 在280 nm 处无吸收峰,说明经过分离纯化后几乎无蛋白质和核酸,在200 nm 附近有多糖特征吸收峰。
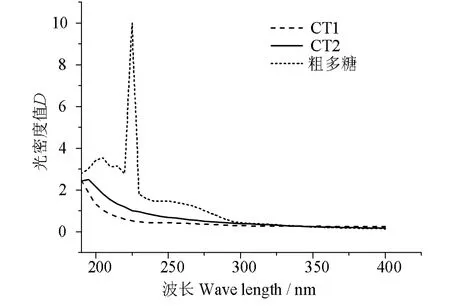
图5 去内脏牡蛎水提多糖及其分离组分的紫外扫描光谱Fig.5 UV scanning spectra of water-soluble polysaccharide and its separated components from the eviscerated oyster
图6 为CT1 的红外光谱图。在3 404 cm-1处的吸收峰是O-H 的伸缩振动,具有鲜明的多糖类物质的红外光谱特征;在2 932 cm-1处的吸收峰是C—H的伸缩振动;在1 638 cm-1处CT1 表现出异常显著的羧基中C==O 非对称伸缩振动,而1 369 cm-1处显示C==O 较强的对称伸缩振动,表明含有糖醛酸;在1 416 cm-1处的吸收峰是C—H的变角振动;1 231 cm-1为S—O 不对称伸缩振动,表明含有硫酸基;1155、1 080、1 022 cm-1为吡喃糖苷的吸收峰,其中1 155 cm-1处的吸收峰为仲醇基O—H 剪切振动峰。由于多糖与锌离子配位的作用位点主要是羧基、羰基、羟基[28],因此CT1 存在多种可与锌配位结合的官能团。由于CT1 是天然含锌多糖,无空白对照,红外光谱特征信息仅提示CT1 拥有可能与锌结合的相关官能团,但对其具体的结构反映不全面,因此锌与CT1 多糖的具体结合方式及结合量尚需深入研究。
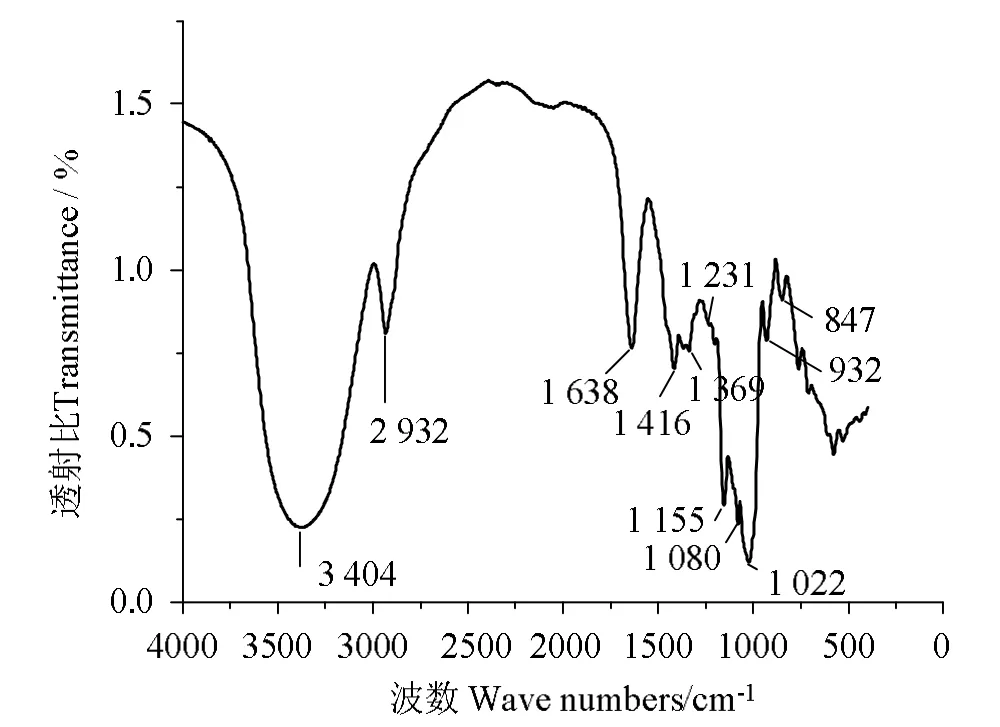
图6 CT1 的傅里叶变换红外光谱Fig.6 Fourier transform infrared spectra of CT1
3 结论
本研究对香港牡蛎的研究显示,在各组织器官中,鳃部的锌含量最高,内脏团含锌量最多。牡蛎中无机态锌元素与有机态锌元素的比例约为1.55∶1。牡蛎全脏器水提液中有机态锌元素主要存在于多糖组分中,残渣中有机态锌元素主要存在于蛋白组分中。多糖锌、蛋白质锌为牡蛎中有机态锌的两种重要存在形态。从去内脏牡蛎中提取液中分离到两种多糖组分,其中CT1 组分锌质量分数高达922.18 μg/g,红外光谱分析表明其存在多种可与锌配位的官能团。
