黄芩不同炮制品的质量及抗溃疡性结肠炎作用比较研究
2021-07-24索天娇刘佳欣鞠成国
王 巍,索天娇,张 强,王 雪,刘佳欣,鞠成国
(辽宁中医药大学 药学院,辽宁 大连 116600)
黄芩为唇形科植物黄芩Scutellaria baicalensisGeorgi的干燥根,收载于《中国药典》2020年版(一部)。其味苦、性寒,具有清热燥湿、泻火解毒、止血、安胎之功效[1]。《中国药典》中“黄芩”项下收录2个饮片品种,即黄芩片和酒黄芩,鉴别方法同黄芩药材,采用显微鉴别和薄层色谱鉴别,其中薄层色谱鉴别是以黄芩对照药材及黄芩苷、黄芩素、汉黄芩素为指标;采用高效液相色谱法测定黄芩苷含量,要求药材中不低于9.0%,两种饮片中黄芩苷含量均不低于8.0%。众所周知,炮制对中药化学成分具有多重影响[2],且不同炮制方法的影响可能具有较大差异,因而不同炮制品应根据具体情况建立相应质量评价标准。鉴于黄芩可清热燥湿、泻火解毒,又兼具止血之效,因此临床常用于溃疡性结肠炎(ulcerative colitis,UC)的治疗,如《伤寒论》中黄芩汤为治疗UC的基础方剂之一[3]。本试验以黄芩片、酒黄芩、黄芩炭3个炮制品种为研究对象,建立定性鉴别及含量测定方法,并结合水分、灰分、醇溶性浸出物含量对3个品种的质量进行比较;并以6%醋酸诱导小鼠UC模型,比较3个品种抗UC的疗效差异。为黄芩不同饮片品种的质量控制及临床安全合理用药提供理论依据。
1 仪器与材料
1.1 仪器
Waters e2695型高效液相色谱仪(美国Waters公司);Multiskan Mk 3型酶标仪(美国赛默飞世尔科技有限公司);ZF-20D型暗箱式紫外分析仪(巩义市科瑞仪器有限公司)。
1.2 试剂
黄芩苷、黄芩素、汉黄芩素对照品及黄芩对照药材(批号:110715-201821、111595-201607、111514-201706、120955-201710,中国食品药品检定研究院);汉黄芩苷(批号:O0903AS,大连美仑生物技术有限公司);小鼠超氧化物歧化酶(SOD)、丙二醛(MDA)、白细胞介素10(IL-10)、白细胞介素1β(IL-1β)及肿瘤坏死因子α(TNF-α)试剂盒(批号:F2389-A、F9261-A、F2176-A、F2040-A、F2132-A,上海科兴生物科技有限公司);乌拉坦(批号:E8710,北京索莱宝科技有限公司);甲醇为色谱纯,醋酸为分析纯(天津科密欧化学试剂有限公司);水为超纯水。
1.3 试药
黄芩购自辽宁省朝阳市建平县GAP基地,秋季采挖,由辽宁中医药大学药学院张慧教授鉴定为黄芩Scutellaria baicalensisGeorgi的干燥根。黄芩片:取黄芩药材煮制10 min,取出,稍凉,切2 mm的厚片,在60℃下干燥1 h,即得[4];酒黄芩:取黄芩片,均匀拌入10%黄酒,闷润至黄酒吸尽,于100 ~ 110℃炒制7 min,取出,晾凉即得;黄芩炭:取黄芩片,于180 ~ 190℃炒制7 min,取出,晾凉即得。美沙拉秦(批号:20200901,黑龙江天宏药业)。
1.4 动物
昆明小鼠,SPF级,雌雄各半[辽宁长生生物技术有限公司,许可证号:SCXK(辽)2020-0001],体质量为(20 ± 2)g。
2 方法与结果
2.1 统计学分析
用SPSS 17.0软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较采用方差分析。以P< 0.05表示具有显著性差异,P< 0.01表示具有极显著性差异。
2.2 黄芩3种饮片质量比较
照《中国药典》2020年(一部)“黄芩”项下鉴别、水分、总灰分及浸出物要求操作,对黄芩3种炮制品进行定性鉴别及水分、总灰分、醇溶液浸出物的测定。结果显示各样品与对照图谱对比相应位置斑点清晰,分离度较好,见图1。黄芩片、酒黄芩、黄芩炭的水分测定均值分别为8.58%、6.56%、1.46%;总灰分测定均值分别为5.32%、5.06%、5.84%;醇溶性浸出物含量测定均值分别为7.65%、51.63%、45.68%。

图 1 黄芩不同饮片品种薄层鉴别图Fig.1 TLC identification of different processed varieties of Scutellaria baicalensis
2.3 含量测定
2.3.1色谱条件 色谱柱Diamonsil Plus C18(250 mm × 4.6 mm,5 μm);流动相甲醇(A)-0.2%磷酸水(B),梯度洗脱(0 ~ 17 min,47%A;17 ~20 min,47% ~ 70%A;20 ~ 25 min,70% ~100%A);检测波长:280 nm;流速:1 mL/min;柱温:30℃;进样量:10 μL。
2.3.2对照品溶液制备 精密称取黄芩苷、汉黄芩苷、黄芩素、汉黄芩素,加甲醇配制成浓度为0.224、0.293、0.320、0.233 mg/mL的对照品储备液,备用。
2.3.3供试品溶液制备 分别精密称取过65目筛的黄芩片、酒黄芩及黄芩炭粉末各0.3 g,加70%乙醇40 mL,加热回流3 h,放冷,滤液滤至100 mL容量瓶中,并以少量提取溶剂分次洗涤容器和残渣,洗液滤入同一容量瓶中,以70%乙醇定容至刻度,摇匀。再精密量取1 mL,置10 mL容量瓶中,加甲醇定容,摇匀,过0.45 µm微孔滤膜,即得。
2.3.4方法学考察 取黄芩片供试品溶液及对照品溶液按“2.3.1”项下方法操作。结果显示4种成分均与相邻色谱峰分离度良好,理论塔板数按黄芩苷计不低于3 000;精密度试验表明仪器精密度良好;稳定性试验表明样品在10 h内稳定;重复性试验表明方法重复性良好;线性范围考察表明黄芩苷在0.041 8 ~0.418 1 μg(Y= 3.4×106X-2.8×104,r= 0.999 9);汉黄芩苷在0.007 8 ~ 0.078 1 μg(Y= 3.2×106X-1.0 ×104,r= 0.999 7);黄芩素在0.008 5 ~ 0.085 μg(Y=5.4 × 106X-2.3 × 104,r= 0.999 5);汉 黄芩素在0.007 8 ~ 0.078 1 μg(Y= 4.7×106X-1.3 × 104,r=0.999 8)与峰面积呈良好线性关系。黄芩苷、汉黄芩苷、黄芩素、汉黄芩素的平均回收率分别为98.6%、97.9%、97.6%、98.1%,RSD分别为1.4%、0.86%、1.1%、1.3%,均符合相关规定。
2.3.5样品含量测定 取黄芩药材,制备3批黄芩片,及相应的3批酒黄芩和3批黄芩炭,采用双样双针法测定4种成分的含量。结果见表1。
表1 样品含量测定结果(± s, n = 12)Tab.1 Results of the sample content(± s, n = 12)

表1 样品含量测定结果(± s, n = 12)Tab.1 Results of the sample content(± s, n = 12)
注:与黄芩片比较, **P<0.01;与酒黄芩比较,##P<0.01;与黄芩炭比较, ΔΔP<0.01
样品 黄芩苷含量/% 汉黄芩苷含量/% 黄芩素含量/% 汉黄芩素含量/% 总含量/%黄芩片 12.13 ± 0.80##ΔΔ 1.891 ± 0.12##ΔΔ 0.645 5 ± 0.051ΔΔ 0.166 9 ± 0.019##ΔΔ 14.83 ± 0.97##ΔΔ酒黄芩 12.99 ± 0.35**ΔΔ 2.033 ± 0.035**ΔΔ 0.681 3 ± 0.089ΔΔ 0.193 6 ± 0.004 2**ΔΔ 15.90 ± 0.43**ΔΔ黄芩炭 5.853 ± 0.032**## 0.648 3 ± 0.009 4**## 4.048 0 ± 0.47**## 0.952 0 ± 0.010**## 11.50 ± 0.48**##F 720.701 1 384.265 595.212 15 484.440 140.421 P 0.000 0.000 0.000 0.000 0.000
2.4 黄芩3种饮片抗溃疡性结肠炎效果比较
2.4.1给药液制备 取黄芩3种饮片粉碎,过200目筛,称取适量,分别加蒸馏水配成浓度为0.065 g/mL的混悬液,备用;取美沙拉秦肠溶片刮去包衣,研细,称取适量,加水混匀,制成浓度为0.02 g/mL的美沙拉秦混悬液,备用。
2.4.2造模及给药 小鼠适应性饲养1周后随机分为美沙拉秦组、黄芩片组、酒黄芩组、黄芩炭组及空白和模型,每组10只。参考文献[5]加以改进以6%醋酸建立小鼠UC模型,小鼠禁食不禁水24 h后,腹腔注射20%乌拉坦麻醉,倒置,在肛门3 ~ 4 cm处,一次性注入0.1 mL的6%醋酸,捏住肛门计时20 s,再以同法注入2 mL生理盐水冲洗,放回鼠笼,静躺至清醒,模型即成。造模24 h后各给药组以0.4 mL/20 g的剂量灌胃相应给药液,空白组和模型组灌胃等量蒸馏水,每日给药1次,连续7 d[6]。
2.4.3一般体征的改变 实验前各组小鼠体重无显著差异,粪便均无隐血。实验7 d后,模型组小鼠体重较空白组下降,各给药组较模型组升高;空白组小鼠隐血检测依旧显阴性,各给药组显阳性,模型组肉眼可见血便。DAI评分=体重增长率× 0.5 +粪便隐血评分× 0.5;体重增长率≥10%,粪便隐血呈阴性计0分,0≤体重增长率<10%,粪便隐血呈阳性计1分,体重增长率<0,肉眼可见血便计2分。末次给药后小鼠禁食不禁水24 h,摘取一侧眼球取血,离心15 min(3 000 r/min),吸取上清备用[7]。取血完毕立即脱颈处死小鼠,解剖结直肠,测量长度,称量质量,计算脏器指数。结果显示模型组小鼠较空白组结肠长度缩短,质量增高,各给药组不同程度改善DAI评分。各组小鼠实验7 d后结直肠长度及脏器指数结果,见表2。
表2 各组小鼠DAI评分、结直肠长度及脏器指数(± s, n = 10)Tab. 2 DAI scoring results, colon length and organ index of mice in each group(± s, n = 10)
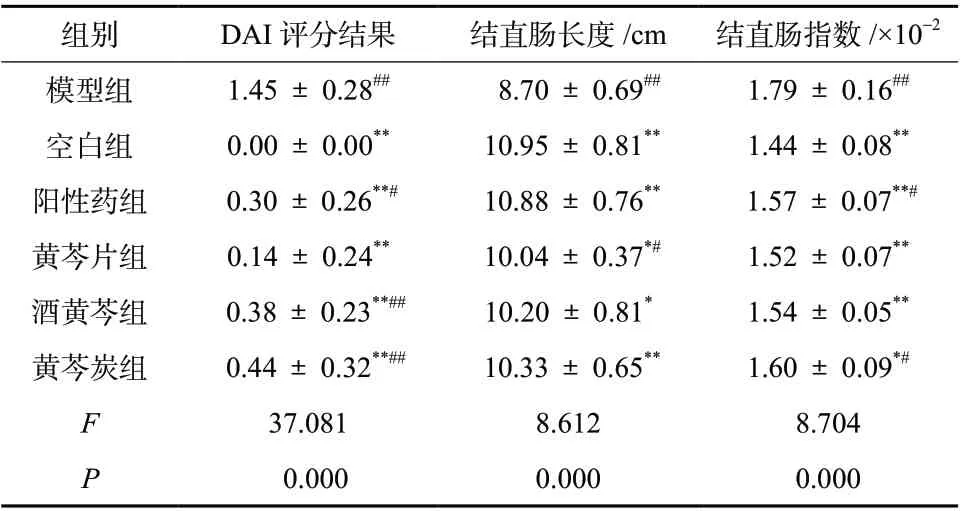
表2 各组小鼠DAI评分、结直肠长度及脏器指数(± s, n = 10)Tab. 2 DAI scoring results, colon length and organ index of mice in each group(± s, n = 10)
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,#P<0.05,##P<0.01
组别 DAI评分结果 结直肠长度/cm 结直肠指数/×10-2模型组 1.45 ± 0.28## 8.70 ± 0.69## 1.79 ± 0.16##空白组 0.00 ± 0.00** 10.95 ± 0.81** 1.44 ± 0.08**阳性药组 0.30 ± 0.26**# 10.88 ± 0.76** 1.57 ± 0.07**#黄芩片组 0.14 ± 0.24** 10.04 ± 0.37*# 1.52 ± 0.07**酒黄芩组 0.38 ± 0.23**## 10.20 ± 0.81* 1.54 ± 0.05**黄芩炭组 0.44 ± 0.32**## 10.33 ± 0.65** 1.60 ± 0.09*#F 37.081 8.612 8.704 P 0.000 0.000 0.000
2.4.4病理学改变 选取病变严重处进行切片,HE染色,观察组织病理改变。结果可见空白组结肠组织完整,无明显病变;模型组结肠隐窝损伤严重,粘膜下层水肿,局部可见红细胞,有炎性细胞浸润;各给药组腺体隐窝结构修复,排列整齐,少量炎性细胞浸润,其中美沙拉秦组最好,其次为酒黄芩组,黄芩片与黄芩炭组稍差,结果见图2。

图2 各组小鼠组织学变化Fig.2 Histological changes in mice of each group
2.4.5血清中细胞因子的改变 采用ELISA法,按SOD、MDA、IL-10、IL-1β、TNF-α试剂盒说明操作,对小鼠血清进行指标测定。结果显示模型组小鼠较空白组SOD、IL-10水平降低,MDA、IL-1β、TNF-α水平升高。各给药组均有改善,见表3。
表3 各组小鼠血清细胞因子水平(± s, n = 10)Tab. 3 Serum cytokine levels of mice in each group(± s, n = 10)
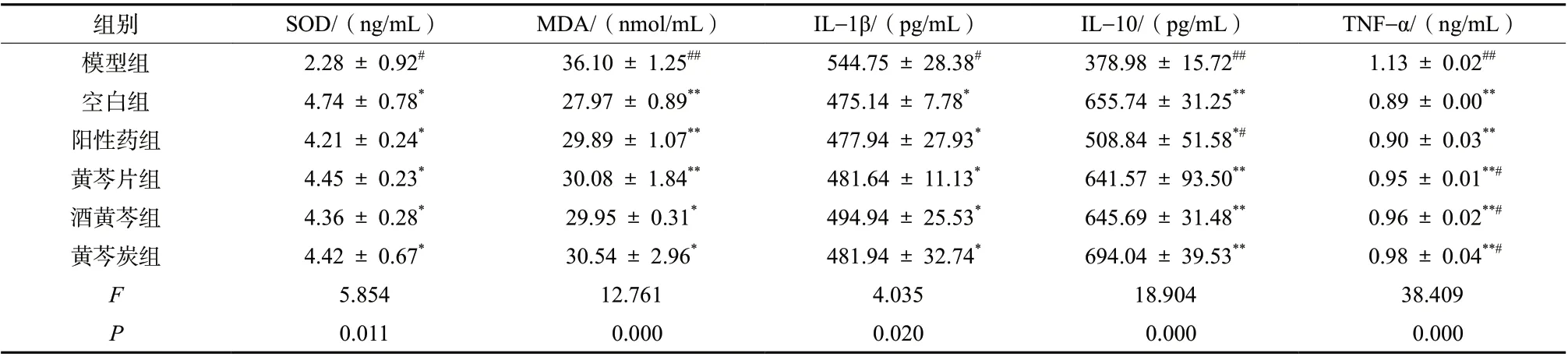
表3 各组小鼠血清细胞因子水平(± s, n = 10)Tab. 3 Serum cytokine levels of mice in each group(± s, n = 10)
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,#P<0.05,##P<0.01
组别 SOD/(ng/mL) MDA/(nmol/mL) IL-1β/(pg/mL) IL-10/(pg/mL) TNF-α/(ng/mL)模型组 2.28 ± 0.92# 36.10 ± 1.25## 544.75 ± 28.38# 378.98 ± 15.72## 1.13 ± 0.02##空白组 4.74 ± 0.78* 27.97 ± 0.89** 475.14 ± 7.78* 655.74 ± 31.25** 0.89 ± 0.00**阳性药组 4.21 ± 0.24* 29.89 ± 1.07** 477.94 ± 27.93* 508.84 ± 51.58*# 0.90 ± 0.03**黄芩片组 4.45 ± 0.23* 30.08 ± 1.84** 481.64 ± 11.13* 641.57 ± 93.50** 0.95 ± 0.01**#酒黄芩组 4.36 ± 0.28* 29.95 ± 0.31* 494.94 ± 25.53* 645.69 ± 31.48** 0.96 ± 0.02**#黄芩炭组 4.42 ± 0.67* 30.54 ± 2.96* 481.94 ± 32.74* 694.04 ± 39.53** 0.98 ± 0.04**#F 5.854 12.761 4.035 18.904 38.409 P 0.011 0.000 0.020 0.000 0.000
3 讨论
TLC鉴别可见黄芩炭色谱中黄芩苷、汉黄芩苷斑点颜色略浅于黄芩片和酒黄芩,而黄芩素和汉黄芩素斑点颜色显著加深,证明炒炭过程黄芩苷和汉黄芩苷显著向黄芩素和汉黄芩素转化。3种不同饮片含水量具有显著差别,总灰分及醇溶性浸出物含量无显著差别。《中国药典》2020年版(一部)中规定黄芩药材水分不得超过12.0%,总灰分不得超过6.0%,醇溶性浸出物含量不得少于40.0%。根据本试验结果,可暂定黄芩片的水分不得超过10.0%,总灰分不得超过6.0%,酒黄芩的水分不得超过8.0%,总灰分不得超过6.0%,黄芩炭的水分不得超过3.0%,总灰分不得超过8.0%,三中饮片的醇溶性浸出物含量均不得少于40.0%。
黄芩片、酒黄芩中测得的黄芩苷含量均高于12.0%,符合《中国药典》2020年版(一部)中不得少于8.0%的规定。在炮制过程中,黄芩苷、汉黄芩苷会向其相应的苷元黄芩素和汉黄芩素转化,炮制方法不同转化程度亦不相同。本试验以黄芩苷、汉黄芩苷、黄芩素、汉黄芩素总量为指标,既能提高质量标准的科学性,又能体现出不同炮制品种质量的差异。根据本试验测定结果可暂定黄芩片和酒黄芩中四种组分总量不得少于10.0%,黄芩炭中不得少于8.0%。
抗UC实验结果表明黄芩不同炮制品均具有显著疗效。综合来看黄芩片效果更佳,但黄芩片中四种成分含量及醇溶性浸出物含量均不及酒黄芩,说明黄芩治疗UC不是某几个成分的简单作用效果。黄芩常常应用于胃肠道疾病,有文献[8]报道黄芩多糖可有效治疗DSS诱导的小鼠UC,但是,多糖在黄芩药材中含量并不高。因此黄芩治疗UC的物质基础及作用机制还需进一步研究。
4 结论
中药根据炮制方法的不同将得到不同的饮片品种,在炮制品过程中,由于工艺参数的区别,对所含化学成分会产生不同程度的影响,故在建立各饮片品种质量标准时应从实际情况出发,建立各自适宜的质量评价体系。本试验依据测定结果初步建立了黄芩3种炮制品的质量标准,并比较了其治疗UC的效果,为黄芩质量控制及临床合理用药提供理论依据,但黄芩各炮制品治疗UC的具体机制还需深入研究。
