柚皮苷对亚硝酸钠致记忆障碍模型小鼠的改善作用
2021-07-24佟玉良赵德萍肖洪彬1
雷 霞,佟玉良,赵德萍,崔 悦,张 宁,3*,肖洪彬1,*
(1.黑龙江中医药大学 博士后流动站,黑龙江 哈尔滨150040;2. 黑龙江中医药大学 药学院,黑龙江哈尔滨150040;3. 黑龙江中医药大学 佳木斯学院,黑龙江 佳木斯 154007;4. 佳木斯大学 药学院,黑龙江 佳木斯154007)
随着全球老龄化社会的到来,阿尔兹海默症(AD)将成为影响人类生存质量的重要疾病。大量研究结果表明海马体淀粉样蛋白(Aβ)异常沉积、Tau过度磷酸化是AD典型的病理特征[1],但是AD的发病原因和具体机制目前尚不明晰。老年女性的痴呆发病率是老年男性的2倍,与更年期相关的雌激素降低可能是一个重要诱因。基于临床样本的研究也显示了迟发性AD风险存在性别差异[2]。适当的雌激素替代疗法不仅可以改善AD患者的认知功能,还能有效预防AD的发生。植物雌激素能够选择性地与脑雌激素受体β(ERβ)结合,对雌激素受体α(ERα)的选择性较低,因此,在展现出良好的神经元保护作用的同时,不会引起雌二醇类似的副作用[3]。
柚皮苷是一种来源广泛的植物雌激素,在橘科植物的皮或中药材中都有大量的分布[4-5]。柚皮苷对多种痴呆动物模型的认知功能都有显著的改善作用[6]。本实验将对柚皮苷改善学习记忆的机制进行深入研究,验证柚皮苷是否通过ER-P38/MAPK信号,调节Aβ代谢,对海马体神经元产生保护作用,为证明柚皮苷抗AD的有效性提供依据,为开发植物雌激素抗AD的研究提供基础。
1 材料
1.1 实验动物
昆明小鼠75只,8月龄,雄性,清洁级,体质量为(22 ± 2)g,购于辽宁长生生物技术股份有限公司,合格证号:SCXK(辽)2018-0001。正常饲料,自由进水进食。实验流程均符合黑龙江中医药大学实验动物管理委员会的要求,并通过实验动物伦理委员会的批准。
1.2 药物与试剂
柚皮苷(北京百灵威科技有限公司,L750N46);亚硝酸钠(天津科密欧,01-25-12);盐酸多奈哌齐(源 叶 生 物,S60449);ICI182780(TOCRIS)购于安诺伦生物;Anti-ERβ(bs-0116R)、Anti-pp38MAPK抗体(bs-2210R)、兔抗β-actin多克隆抗体(bs-0061R)、HRP标记羊抗兔IgG(bs-0295GHRP)、兔抗 Anti-APPBP1(bs-12503R)等购于北京博奥森;BACE 1(5606T)、兔抗ERα多克隆抗体 (Cell Signaling,644T)、预染Marker(P0069)等购于美国CST公司。
1.3 实验仪器
ZH-Morris型水迷宫程序自动控制仪(正华生物仪器设备有限公司);MiniPROTEANTetra Cell型电泳仪(BIO-RAD公司);HT7700型透射电镜(日立仪器有限公司);Trans-Blot SD Cell型半干转膜仪(BIO-RAD公司);SmartChemi500型化学发光成像仪(北京赛智创业)。
2 方法
2.1 分组及给药
75只小鼠随机分为5组,空白组(Control)、模 型 组(Model)、阳 性 药 组(Positive)、柚 皮苷 组(Naringin)、柚 皮 苷+ER阻 断 剂(NG +ICI182780)组。Control组及Model组灌胃给予蒸馏水;Positive组、Naringin组灌胃分别给予雌二醇(20 mg/kg·d)及柚皮苷(100 mg/kg·d),NG +ICI182780组先腹腔注射ICI182780 (0.072 mg/kg·d),15 min后给予柚皮苷。
2.2 造模
第22天除空白组腹腔注射生理盐水外,其余组连续7 d腹腔注射等量的亚硝酸钠,每日100 mg/kg,第29天开始,每日给药后30 min进行行为学试验。
2.3 行为学检测
采用新物体识别实验、Morris水迷宫定位航行实验及空间探索实验观察小鼠认知能力。识别指数=(Tn-Tf)/(Tn+Tf)。记录动物对新物体的接触时间为(Time new,Tn)和对旧物体的接触时间(Time familiar,Tf)。
2.4 取材
行为学测试后当天下午取材,小鼠采用1%戊巴比妥钠(0.01 mL/g)腹腔注射实施麻醉,小鼠进入麻醉外科期深度时快速断头,取出鼠脑组织中海马体及下丘脑,病理学方法检测海马体及下丘脑形态和ER受体的表达。取出的海马体及下丘脑常规方法进行石蜡包埋,切片,HE染色。透射电镜固定,脱水、浸透、包埋及切片后,电镜下观察小鼠海马体超微结构变化并拍摄。采用Motic Med 7.0数码医学图像分析系统计算。另一半海马体液氮速冻后蛋白提取,蛋白浓度测定按照BCA试剂盒说明书操作,计算各组样品的蛋白浓度,蛋白印迹法观察蛋白质变化。
3 结果
3.1 行为学测试结果
新物体识别实验测试结果如图1所示,新物体识别试验中,与Control相比,Model组小鼠识别指数减小,差异具有统计学意义(P< 0.01);与Model组相比,Positive和Naringin组小鼠识别指数增加,差异具有统计学意义(P< 0.01);与Naringin组相比,NG + ICI182780组小鼠识别指数减少,差异具有统计学意义(P< 0.01)。
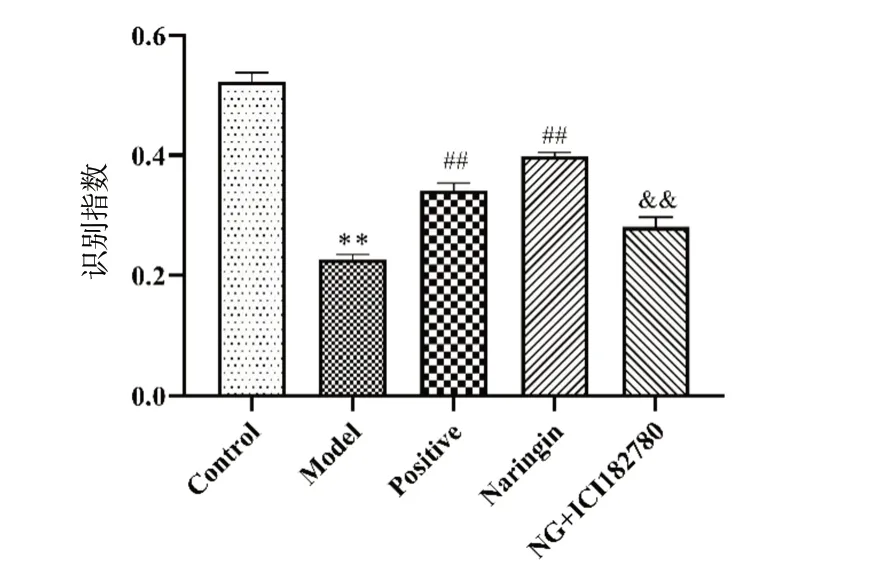
图1 柚皮苷对小鼠新物体识别指数的影响(n = 15)Fig.1 Effects of naringin on new object recognition experiment in mice(n = 15)
小鼠在前4 d训练中寻找平台潜伏期时长逐渐降低,但Control组、Naringin组小鼠潜伏期下降较快。结果如图2所示,与Control组相比,Model组小鼠定位航行实验潜伏期增加,差异具有统计学意义(P<0.01),表明小鼠记忆巩固能力较差。与Model组相比,Positive组和Naringin组小鼠潜伏期减少,差异具有统计学意义(P< 0.01);与Naringin组相比,NG + ICI182780组小鼠潜伏期减少,差异具有统计学意义(P< 0.01)。NG + ICI182780组小鼠搜台潜伏期明显高于柚皮苷组,说明在ER阻断剂的干预下,小鼠学习进步缓慢。
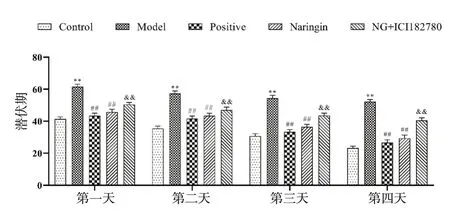
图2 柚皮苷对小鼠定位航行潜伏期的影响(n = 15)Fig.2 Effects of naringin on navigation latency of mice(n = 15)
空间探索试验结果如图3所示,与Control组相比,Model组小鼠平台穿越次数和目标象限停留时间减少,差异具有统计学意义(P< 0.01);与Model组相比,Positive组和Naringin组小鼠平台穿越次数和靶象限停留时间增加,差异具有统计学意义(P<0.01);与Naringin组相比,NG+ICI182780组小鼠平台穿越次数和靶象限停留时间降低,差异具有统计学意义(P< 0.01),靶象限停留时间降低,差异具有统计学意义(P< 0.05)。
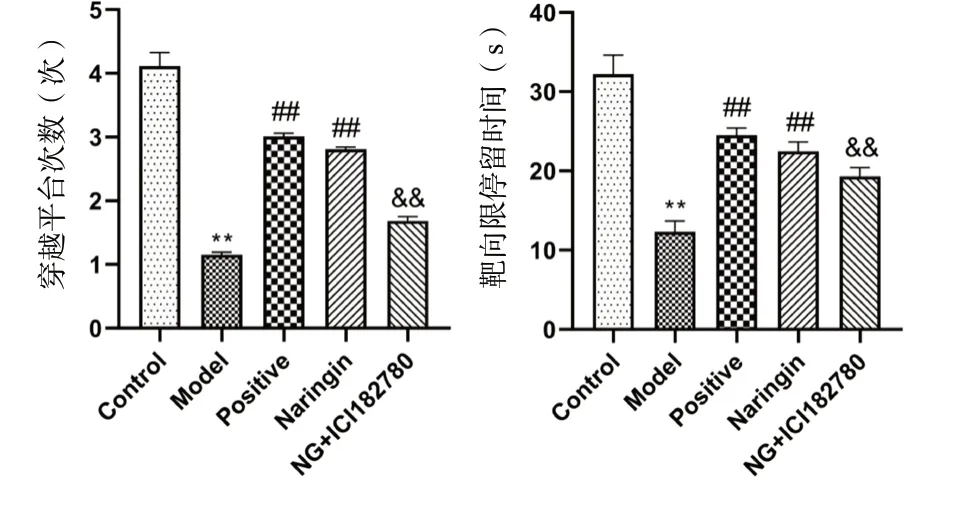
图3 柚皮苷对小鼠空间探索试验的影响(n = 15)Fig.3 Effects of naringin on spatial exploration of mice(n = 15)
3.2 柚皮苷对亚硝酸钠模型小鼠海马区及下丘脑区组织病理改变的影响
Control组小鼠的海马区神经细胞排列整齐,数量较多,染色均一。亚硝酸钠损伤了小鼠海马区,表现为紊乱排列和缩小的神经元细胞,由于核固缩现象明显,见不到明显的核仁;无论Positive组还是Naringin给药组都在一定程度上恢复了海马区神经元的数量,形态正常,排列规整,核仁清晰,见图4。下丘脑的HE染色显示亚硝酸钠损伤了小鼠下丘脑,神经细胞排列松散, 细胞间隙较宽,细胞核未着色,细胞核体积明显扩张,核仁不明显,部分细胞结构消失,Positive组也出现了与Model组相类似的病理变化;Naringin给药组神经元细胞排列较为紧密,细胞间隙适中,细胞核深染,核仁清晰。ICI182780的干预使Naringin对海马区和下丘脑区的神经元的保护作用大大减弱,见图5。
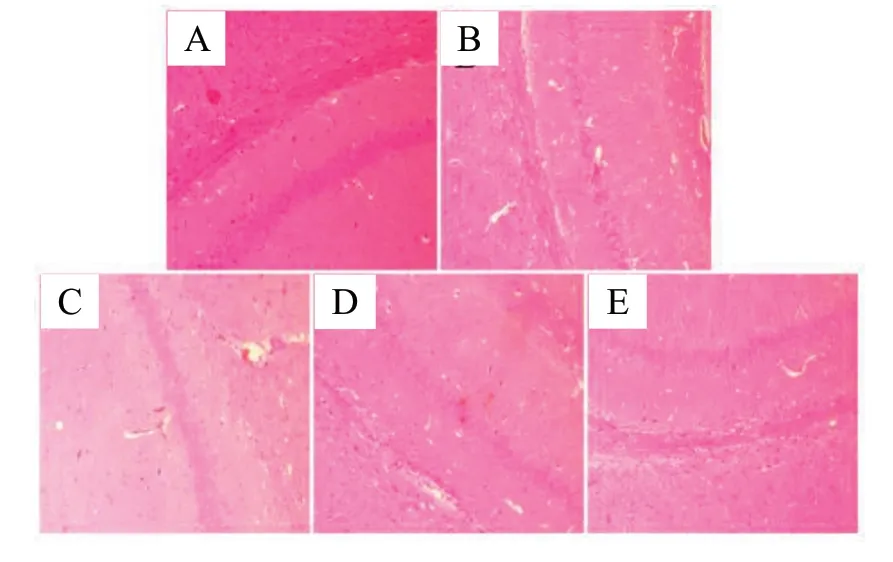
图4 小鼠海马体区神经细胞病理形态(HE染色,×200)Fig.4 Neuropathological morphology of hippocampus in mice(HE staining, ×200)
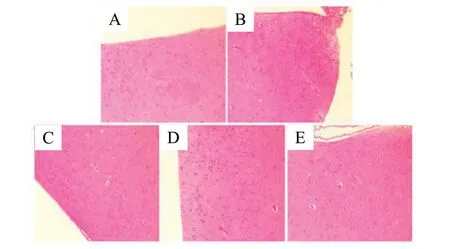
图5 小鼠下丘脑区神经细胞病理形态(HE染色,×200)Fig.5 Pathological morphology of neurons in the hypothalamus of mice(HE staining, ×200)
3.3 透射电镜观察小鼠海马体超微结构
Model组和雌激素阻断剂组神经元镜下细胞核出现固缩状态,核膜增厚,线粒体絮状变性,粗面内质网扩张脱颗粒,突触膜结构不清晰,囊泡数量减少。Control组小鼠神经元核膜结构清晰,染色质如细沙状呈现,细胞核占据大部分视野,粗面内质网丰富,线粒体发达,突触膜结构完整,小泡数量较多。Positive组和Naringin组较相似,神经元细胞核膜结构清晰,胞质内粗面内质网轻度扩张,线粒体发达,囊泡数量明显增多,见图6。
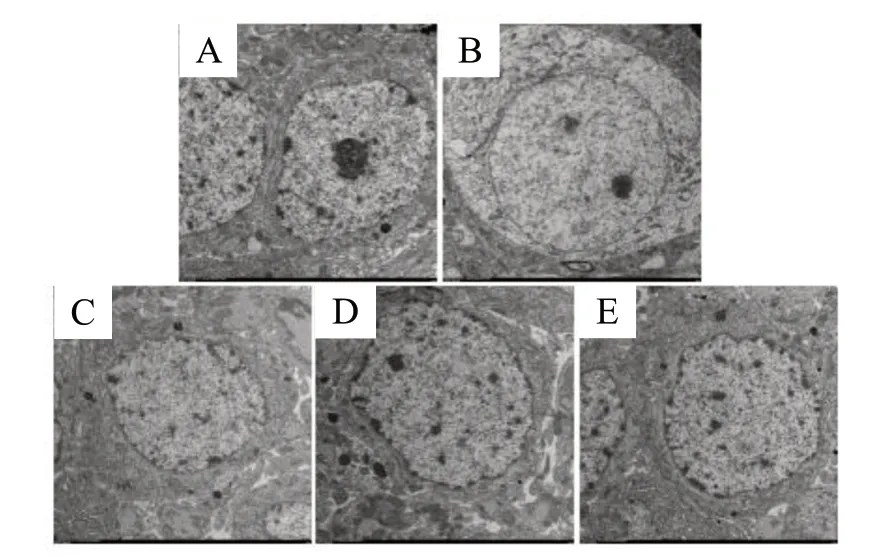
图6 小鼠海马体区神经元细胞超微结构Fig.6 Ultrastructure of nerve cells in hippocampus of mice
3.4 免疫组织化学观察海马体ER表达
与Control组相比,Model组小鼠海马体中ERβ表达减少,差异具有统计学意义(P< 0.01);与Model组相比,Naringin组小鼠ERβ表达增加,差异具有统计学意义(P< 0.01);与Naringin组相比,NG + ICI182780组小鼠ERβ表达减少,差异具有统计学意义(P< 0.01)。与Control组相比,Model组小鼠海马体内ERα表达情况减少,差异具有统计学意义(P< 0.01);与Model组相比,给药组小鼠ERα表达增加,差异具有统计学意义(P< 0.01);与Naringin组相比,雌激素阻断剂组小鼠ERα表达减少,差异具有统计学意义(P< 0.01),见图7。
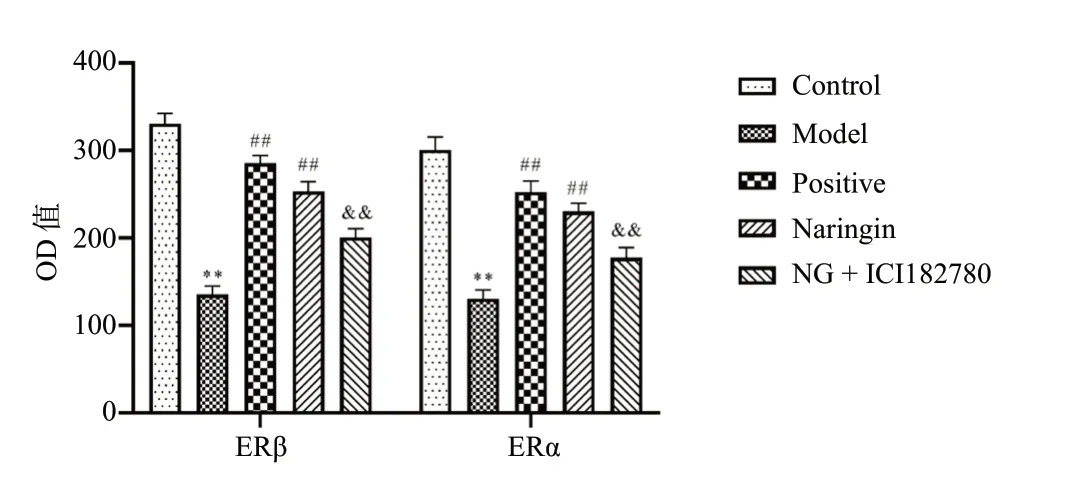
图7 柚皮苷对小鼠海马体ERβ、下丘脑ERα表达的影响(OD值)Fig.7 Effects of Naringin on the expression of ERβ in hippocampus,ERα in hypothalamus of mice(OD Value)
3.5 海马体中 ERβ和P-P38/P38蛋白的变化
与Control组相比,Model组小鼠海马体ERβ蛋白表达减少,P-P38/P38蛋白表达增加,差异具有统计学意义(P< 0.01);与Model组相比,给药组小鼠海马体ERβ蛋白表达增加,差异具有统计学意义(P< 0.01);P-P38/P38蛋白表达减少,差异具有统计学意义(P< 0.01);与Naringin组相比,NG +ICI182780组小鼠海马体ERβ蛋白表达减少(P<0.01);P-P38/P38蛋白表达增加,差异具有统计学意义(P< 0.01),见图8。
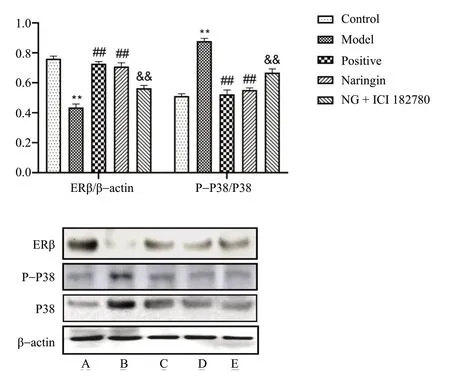
图8 柚皮苷对小鼠海马体ERβ和P-P38/P38表达的影响(n = 3)Fig.8 Effects of naringin on the expression of ERβ and P-P38/P38 in hippocampus of mice(n = 3)
3.6 海马体中APP和BACE1蛋白的含量变化
与Control组 相 比,Model组APP、BACE1表达增加,差异具有统计学意义(P< 0.01);与Model组相比,给药组APP、BACE1表达减少,差异具有统计学意义(P< 0.01);与Naringin组相比,NG+ICI182780组小鼠海马体中APP、BACE1表达增加,差异具有统计学意义(P< 0.01),见图9。
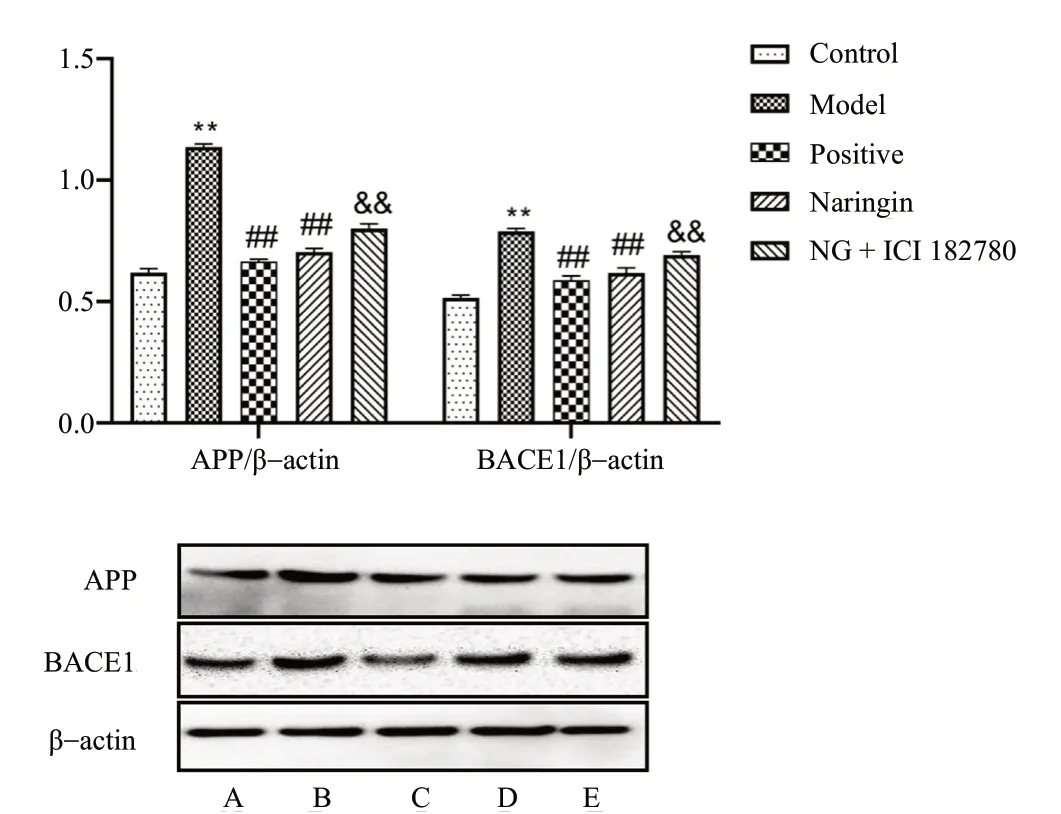
图9 柚皮苷对小鼠海马体中APP、BACE1表达的影响(n = 3)Fig.9 Effects of Naringin on the expression of APP and BACE1 in hippocampus of mice(n = 3)
4 讨论
亚硝酸钠诱导的模型小鼠表现出认知能力的显著下降,与AD患者临床表现出的渐进性记忆巩固功能障碍相类似。本研究证明了柚皮苷能够明显改善记忆损伤小鼠的学习记忆障碍,与阳性对照药雌二醇有类似的作用,但却未出现对下丘脑明显的损伤作用。
众所周知,AD主要病理特征为海马体Aβ的异常沉积。BACE1是APP生成 Aβ 所需的限速酶。柚皮苷可降低APP、BACE1的表达,降低Aβ沉积概率,减轻海马区神经元细胞损伤,从而减轻模型小鼠痴呆表现。在雌激素受体阻断剂反向验证下,柚皮苷的保护作用明显减弱,说明柚皮苷对Aβ形成的有效抑制是依赖于ER的。
ERα 主要分布在下丘脑,亚硝酸钠模型小鼠脑源性雌激素快速消耗,雌激素分泌减少的同时,ERα表达下调。柚皮苷对下丘脑的病理无明显改变,表明柚皮苷在本文所用的剂量具有较高的选择性,对ERα也无明显的调节作用。ERβ 主要分布大脑皮质、海马体以及小脑等部位,精确参与调控与神经元存活密切相关的神经递质、酶或者结构蛋白等基因转录。本研究结果表明柚皮苷可通过上调ERβ受体发挥神经保护作用,并且能通过MAPK/P38信号途径发挥快速非基因调节效应,从而改善神经元的结构和功能。
柚皮苷拥有植物雌激所具有的杂环多酚结构,与ERβ具有较高的亲和力。从本文的研究结果分析,其具有雌激素样效应,对下丘脑ERα影响较小,可选择性作用于海马体ERβ受体。而且,与雌二醇相比柚皮苷对下丘脑的抑制作用较小,长期给药未出现下丘脑的明显萎缩。这一特征使其相较于经典雌激素(人工合成)具有一定的优势。本研究证明了柚皮苷能够上调模型小鼠ERβ表达,在ICI182780的反向验证下,同时证明了柚皮苷对P-P38/P38抑制作用是依赖于ER实现的。
5 结论
柚皮苷能够上调亚硝酸钠模型小鼠ERβ在海马体齿状回的表达,对下丘脑ERα影响较弱,能够抑制P38-MAPK信号通路,减少Aβ的异常沉积,从而减轻Aβ对神经元的毒性作用,具备被开发为抗AD药物的潜力。
