扶正抗癌方通过miR221-3p/p27Kip1阻滞H460细胞周期的机制研究
2021-07-24李龙妹甘紫胭杨小兵河文峰廖桂雅李秋萍吴万垠
李龙妹,甘紫胭,杨小兵,河文峰,廖桂雅,李秋萍,吴万垠
(广州中医药大学第二附属医院,广东 广州 510370)
扶正抗癌方是广东省名中医吴万垠教授总结的经验方,该方遵循中医整体观和辨证论治理念,目前已作为颗粒制剂广泛用于临床治疗。前期临床研究中,扶正抗癌方联合吉非替尼可延长非小细胞肺癌患者中位疾病无进展生存时间以及中位生存时间[1];基础研究中,扶正抗癌方可通过AMPKα-IGFBP1-FOXO3α和SAPK/JNK-Sp1通路抑制细胞增殖[2-3],协同吉非替尼通过Akt-p65-MUC1通路抑制细胞增殖[4],逆转EMT抑制NSCLC细胞转移[5-7],激活Caspase-3、Bax诱导NSCLC细胞凋亡[8],通过cMet通路逆转NSCLC细胞对吉非替尼的耐药[9]。但扶正抗癌方是否可通过阻滞细胞周期抑制增殖未见文献报道。因此,本研究以H460人大细胞肺癌细胞为研究对象,检测扶正抗癌方对细胞增殖和周期的影响,并进一步探讨了扶正抗癌方对miR221-3p、细胞周期依赖性激酶抑制物p27Kip1、细胞周期蛋白D1(Cyclin D1)、细胞周期蛋白E(Cyclin E)、细胞周期依赖性激酶2(CDK2)和细胞周期依赖性激酶4(CDK4)的影响。
1 材料与方法
1.1 材料
1.1.1细胞 H460人大细胞肺癌细胞(中国科学院细胞库)。细胞培养:37 ℃、5% CO2,RPMI-1640培养基+10% 胎牛血清+100 U/mL的青霉素与100 mg/mL的链霉素。细胞传代:弃旧培养基,PBS冲洗,胰酶消化后,吹打至单细胞悬液,按1∶3传代至新培养皿或按照实验要求进行细胞处理。
1.1.2药物和试剂 扶正抗癌方颗粒(批号:J1708002),广东一方制药有限公司制备,具体方药及药物配制详见文献[8]。GAPDH(D16H11)XP® Rabbit mAb( 批 号:5174)、CDK2 (E8J9T)XP® Rabbit mAb (批 号:18048)、CDK4 (D9G3E)Rabbit mAb( 批 号:12790)、Cyclin D1 (E3P5S)XP® Rabbit mAb(批号:55506)、Cyclin E (D7T3U)Rabbit mAb(批号:20808)、p27Kip1(D69C12) XP®Rabbit mAb(批号:3686)均购于美国CST公司;RPMI-1640培养基(批号:8119305)、胎牛血清(批号:10270-106)、胰酶(批号:25200-072)均购于美国Gibco公司;2×mRNA Universal SYBR® qPCR Master Mix(批 号:MQ101-01)、miRNA 1st Strand cDNA Synthesis Kit (by stem-loop)(批号:MR101-02)均购于南京诺唯赞生物科技有限公司;riboFECT CP Transfection Kit(333T)(批号:c10511-1)购于广州锐博生物科技公司;miR221的引物及内参U6引物、miR221 inhibitor 及对应的阴性对照由上海吉玛公司设计并合成。
1.1.3主要仪器 ChemiDoc XRS+型化学发光成像系统、1658033型垂直电泳系统及1703940型半干转膜系统(美国Bio-Rad公司);Cytomics FC500型流式细胞仪(美国贝克曼公司);CountStar型全自动细胞计数仪(美国Inno-Aliance Biotech公司);Eon.C型多功能酶标仪(美国BioTEK公司);5430R型冷冻离心机(德国Eppendorf公司);ABI7500型荧光定量PCR仪(美国Applied Biosystems公司)。
1.2 方法
1.2.1CCK8检测细胞存活率 取对数生长的H460细胞,培育24 h,分别加入0.1 mL浓度为0、0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的扶正抗癌方药液,分别培养24、48 h,加入100 μL CCK8试剂,1 h后酶标仪(450 nm波长)检测光密度值。细胞存活率 =给药组光密度值/对照组光密度值×100%。
1.2.2流式细胞术检测细胞周期的变化 取对数生长的H460细胞,培育24 h,分别加入2 mL浓度为0、1.5、2.0、2.5 mg/mL的扶正抗癌方药液,24 h后,胰酶消化,以培养基重悬细胞,1 000 r/min离心5 min,轻弹管壁,使沉淀重悬于残液中,加入1 mL室温下的PBS缓冲液。将细胞缓慢加入至提前-20 ℃预冷的3 mL无水乙醇中,边加入边高速搅拌,过夜。第二天,将固定的细胞离心,弃乙醇,轻弹管壁使沉淀松散,加入室温下PBS缓冲液,放置15 min使细胞水化,离心,弃上清。加入1 mL DNA staining solution,涡旋震荡5 ~ 10 s。室温避光孵育30 min,流式机上样。
1.2.3Real-time PCR检 测miR221-3p及p27Kip1mRNA的表达 收集样品,Trizol法试剂提取细胞总RNA,将其逆转录成cDNA,反转录过程采用miRNA特异性引物构建反转录体系,条件按试剂盒说明书执行。扩增时miRNA以U6位内参照基因,mRNA以GAPDH位内参照基因,结果利用2-△△Ct计算。基因引物序列如表1所示。

表1 引物序列Tab. 1 The primer sequence
1.2.4Western blot检 测 p27Kip1、Cyclin D1、Cyclin E、CDK2、CDK4蛋白的表达 取对数生长的H460细胞,细胞培养和给药同“1.2.2”;ripa裂解细胞,提取总蛋白,BCA法测定蛋白浓度;蛋白样品上样、电泳、转膜、封闭,加入一抗摇床孵育2 h,4 ℃过夜,加入二抗摇床孵育1 h;ECL化学发光法在凝胶成像系统中成像,Image Lab分析数据。
1.2.5瞬时转染 利用化学脂质体转染法,采用lipo3000和 riboFECT CP两种转染试剂,其中,转染miR221-3p的mimic和inhibitor采用riboFECT CP转染试剂,其它的采用lipo3000转染试剂,按照说明书进行操作。
1.2.6荧光素酶报告基因检测miR221-3p是否与p27Kip13’UTR的预测结合位点结合 将样品按照Luc-Pair Duo-Luciferase HS Assay Kit试剂盒说明书进行操作,对细胞提取物中的荧光素酶活性进行分析。
1.2.7统计学方法 用SPSS 22.0软件进行数据分析。计量资料用均数 ± 标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。以P< 0.05为差异具有统计学意义。
2 结果
2.1 扶正抗癌方对H460细胞增殖的影响
与空白对照组比较,扶正抗癌方组(1.0、1.5、2.0、2.5、3.0 mg/mL)中H460细胞的存活率下降,差异具有统计学意义(P< 0.01),且随着给药浓度的增加,细胞存活率呈下降趋势;同时,随着给药时间的延长,细胞存活率也呈下降趋势,见表2。结果表明,扶正抗癌方能够抑制H460细胞的增殖,且呈浓度和时间依赖性。
表2 扶正抗癌方对H460细胞存活率的影响(± s, n = 3)Tab. 2 Effects of Fuzheng Kang-Ai Decoction on cell viability in H460 cells(± s, n = 3)
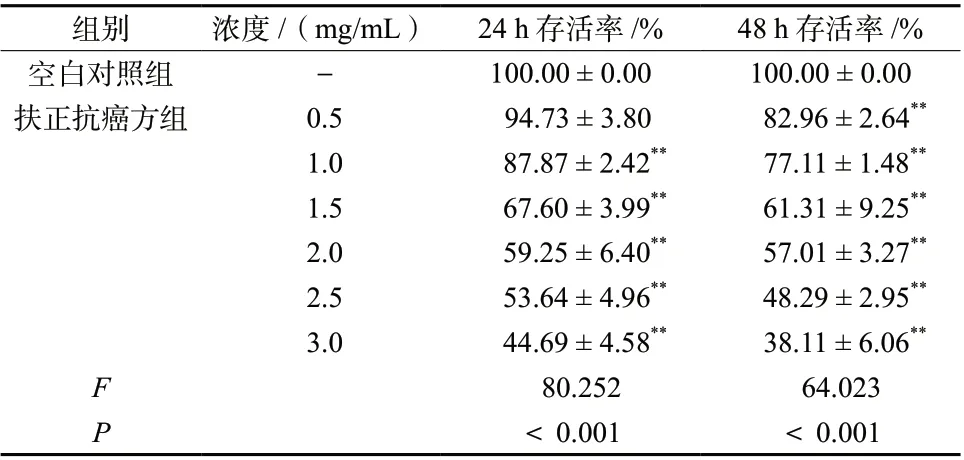
表2 扶正抗癌方对H460细胞存活率的影响(± s, n = 3)Tab. 2 Effects of Fuzheng Kang-Ai Decoction on cell viability in H460 cells(± s, n = 3)
注:与空白对照组比较,**P < 0.01
组别 浓度/(mg/mL) 24 h存活率/% 48 h存活率/%空白对照组 - 100.00 ± 0.00 100.00 ± 0.00扶正抗癌方组 0.5 94.73 ± 3.80 82.96 ± 2.64**1.0 87.87 ± 2.42** 77.11 ± 1.48**1.5 67.60 ± 3.99** 61.31 ± 9.25**2.0 59.25 ± 6.40** 57.01 ± 3.27**2.5 53.64 ± 4.96** 48.29 ± 2.95**3.0 44.69 ± 4.58** 38.11 ± 6.06**F 80.252 64.023 P<0.001 <0.001
2.2 扶正抗癌方对H460细胞周期的影响
与空白对照组比较,扶正抗癌方组(1.5、2.0、2.5 mg/mL)中G0/G1期的细胞增加,差异具有统计学意义(P< 0.05),S期的细胞减少,差异具有统计学意义(P< 0.05),G2/M期的细胞无显著变化;且随着给药浓度的增加,G0/G1期的细胞逐渐增加,S期的细胞逐渐减少,见如图1、表3。结果表明,扶正抗癌方能够将H460细胞阻滞在G0/G1期以抑制肿瘤细胞生长,且呈浓度依赖性。

图1 扶正抗癌方对H460细胞周期的影响(± s, n = 3)Fig.1 Effects of Fuzheng Kang-Ai Decoction on cell cycle in H460 cells(± s, n = 3)
表3 扶正抗癌方对H460细胞周期的影响(± s, n = 3)Tab. 3 Effects of Fuzheng Kang-Ai Decoction on cell cycle in H460 cells(± s, n = 3)
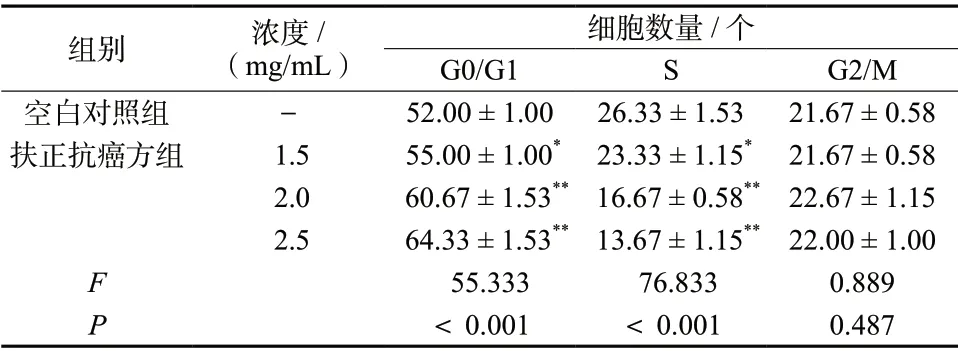
表3 扶正抗癌方对H460细胞周期的影响(± s, n = 3)Tab. 3 Effects of Fuzheng Kang-Ai Decoction on cell cycle in H460 cells(± s, n = 3)
注:与空白对照组比较,*P < 0.05,**P < 0.01
细胞数量/个G0/G1 S G2/M空白对照组 - 52.00 ± 1.00 26.33 ± 1.53 21.67 ± 0.58扶正抗癌方组 1.5 55.00 ± 1.00* 23.33 ± 1.15* 21.67 ± 0.58 2.0 60.67 ± 1.53** 16.67 ± 0.58** 22.67 ± 1.15 2.5 64.33 ± 1.53** 13.67 ± 1.15** 22.00 ± 1.00 F 55.333 76.833 0.889 P<0.001 <0.001 0.487组别 浓度/(mg/mL)
2.3 扶正抗癌方对Cyclin D1、Cyclin E、CDK2、CDK4蛋白表达的影响
与空白对照组比较, 扶正抗癌方组 (2.0、 2.5 mg/mL)中Cyclin D1、Cyclin E、CDK2和CDK4蛋白的表达降低,差异具有统计学意义(P< 0.05),且随着给药浓度的增加,上述蛋白的表达呈下降趋势,见图2、表4。结果表明,扶正抗癌方能够下调Cyclin D1、Cyclin E、CDK2和CDK4蛋白的表达,且呈浓度依赖性。
表4 扶正抗癌方对Cyclin D1、Cyclin E、CDK2、CDK4蛋白表达的影响(± s, n = 3)Tab. 4 Effects of Fuzheng Kang-Ai Decoction on the protein expression of Cyclin D1, Cyclin E, CDK2 and CDK4(± s, n = 3)
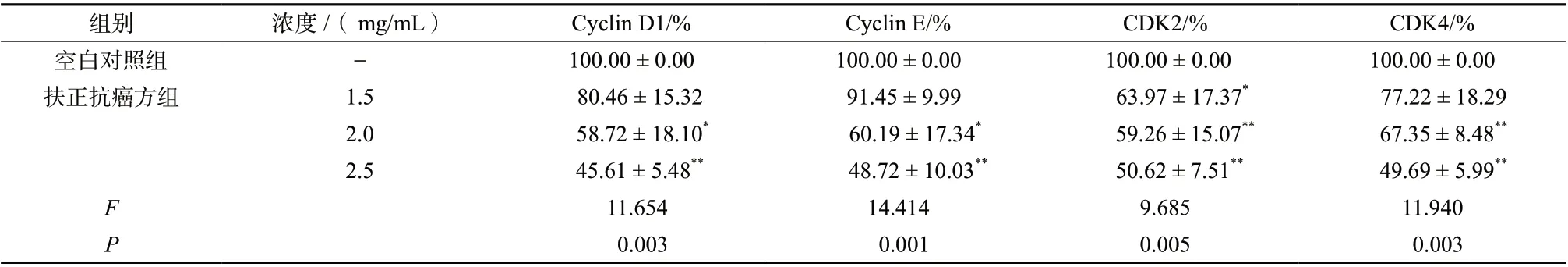
表4 扶正抗癌方对Cyclin D1、Cyclin E、CDK2、CDK4蛋白表达的影响(± s, n = 3)Tab. 4 Effects of Fuzheng Kang-Ai Decoction on the protein expression of Cyclin D1, Cyclin E, CDK2 and CDK4(± s, n = 3)
注:与空白对照组比较,*P < 0.05,**P < 0.01
组别 浓度/( mg/mL) Cyclin D1/% Cyclin E/% CDK2/% CDK4/%空白对照组 - 100.00 ± 0.00 100.00 ± 0.00 100.00 ± 0.00 100.00 ± 0.00扶正抗癌方组 1.5 80.46 ± 15.32 91.45 ± 9.99 63.97 ± 17.37* 77.22 ± 18.29 2.0 58.72 ± 18.10* 60.19 ± 17.34* 59.26 ± 15.07** 67.35 ± 8.48**2.5 45.61 ± 5.48** 48.72 ± 10.03** 50.62 ± 7.51** 49.69 ± 5.99**F 11.654 14.414 9.685 11.940 P 0.003 0.001 0.005 0.003

图2 扶正抗癌方对Cyclin D1、Cyclin E、CDK2、CDK4蛋白表达的影响(± s, n = 3)Fig.2 Effects of Fuzheng Kang-Ai Decoction on the protein expression of Cyclin D1, Cyclin E, CDK2 and CDK4(± s, n = 3)
2.4 扶正抗癌方对p27Kip1 mRNA及蛋白表达的影响
与空白对照组比较,扶正抗癌方组(2.0 mg/mL)中p27Kip1的mRNA表达增加,差异具有统计学意义(P< 0.05);扶正抗癌方组(1.5、2.0、2.5 mg/mL)中p27Kip1蛋白表达增加,差异具有统计学意义(P< 0.05),且随着给药浓度的增加,p27Kip1蛋白表达呈上升趋势,见图3、表5。结果表明,扶正抗癌方能够在基因及蛋白质水平上调p27Kip1的表达,且呈浓度依赖性。
表5 扶正抗癌方对p27Kip1 mRNA及蛋白表达的影响(± s, n = 3)Tab. 5 Effects of Fuzheng Kang-Ai Decoction on the mRNA and protein expression of p27Kip1(± s, n = 3)

表5 扶正抗癌方对p27Kip1 mRNA及蛋白表达的影响(± s, n = 3)Tab. 5 Effects of Fuzheng Kang-Ai Decoction on the mRNA and protein expression of p27Kip1(± s, n = 3)
注:与空白对照组比较,*P < 0.05,**P < 0.01;“-”表示没有做相关实验
组别 浓度/( mg/mL) p27Kip1 mRNA/% p27Kip1 /%空白对照组 - 100.00 ± 0.00 100.00 ± 0.00扶正抗癌方组 1.5 - 128.62 ± 19.01*2.0 242.69 ± 40.09** 178.98 ± 13.05**2.5 - 262.79 ± 18.81**F/t 6.165 69.040 P 0.004 <0.001
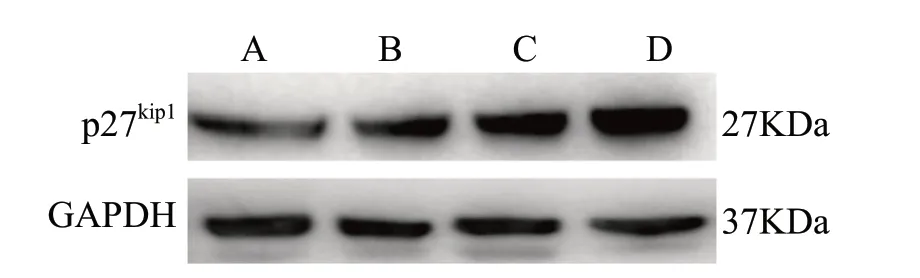
图3 扶正抗癌方对p27Kip1蛋白表达的影响(± s, n = 3)Fig.3 Effects of Fuzheng Kang-Ai Decoction on the expression of p27Kip1(± s, n = 3)
2.5 扶正抗癌方对miR221-3p表达的影响
与空白对照组比较,扶正抗癌方组(2.0 mg/mL)中miR221-3p的表达降低,差异具有统计学意义(P< 0.01),见表6。结果表明,扶正抗癌方能够抑制miR221-3p的表达。
表6 扶正抗癌方对miR221-3p表达的影响(± s, n = 3)Tab. 6 Effects of Fuzheng Kang-Ai Decoction on the expression of miR221-3p(± s, n = 3)

表6 扶正抗癌方对miR221-3p表达的影响(± s, n = 3)Tab. 6 Effects of Fuzheng Kang-Ai Decoction on the expression of miR221-3p(± s, n = 3)
组别 浓度/( mg/mL) miR221-3p/%空白对照组 - 100.00 ± 0.00扶正抗癌方组 2.0 59.76 ± 2.03 t 34.401 P<0.001
2.6 miR221-3p对p27Kip1 mRNA表达的影响
将miR221-3p mimics及相应的阴性对照组转染至H460细胞,48 h后发现,与阴性对照组比较,miR221-3p mimics组中miR221-3p的表达提高约400倍,p27Kip1mRNA的表达降低,差异具有统计学意义(P< 0.01)。将miR221-3p inhibitor及相应的阴性对照(nc-inhibitor组)转染至H460细胞株,48 h后发现,与nc-inhibitor组比较,miR221-3p mimics组中miR221-3p的表达降低,差异具有统计学意义(P< 0.01),p27Kip1mRNA的表达增加,差异具有统计学意义(P< 0.01),见表7。结果表明,miR221-3p能够靶向抑制p27Kip1mRNA的表达。
表7 miR221-3p对p27Kip1 mRNA表达的影响(± s, n = 3)Tab. 7 Effects of miR221-3p on the expression of p27Kip1 mRNA(± s, n = 3)
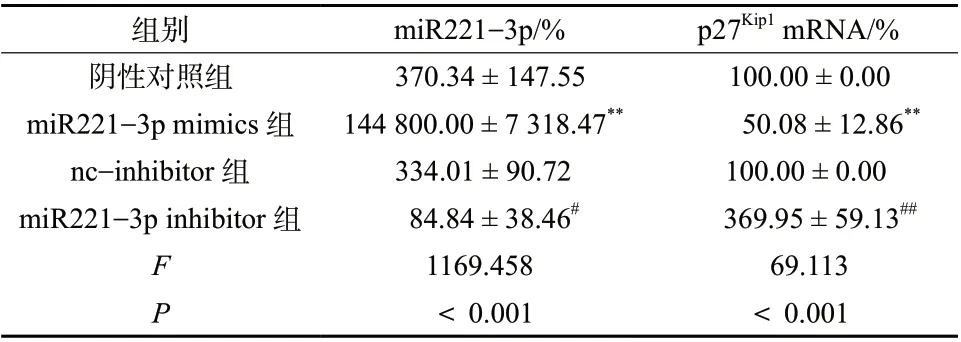
表7 miR221-3p对p27Kip1 mRNA表达的影响(± s, n = 3)Tab. 7 Effects of miR221-3p on the expression of p27Kip1 mRNA(± s, n = 3)
注:与阴性对照组比较,**P < 0.01;与nc-inhibitor组比较,#P < 0.05,##P < 0.01
组别 miR221-3p/% p27Kip1 mRNA/%阴性对照组 370.34 ± 147.55 100.00 ± 0.00 miR221-3p mimics组 144 800.00 ± 7 318.47** 50.08 ± 12.86**nc-inhibitor组 334.01 ± 90.72 100.00 ± 0.00 miR221-3p inhibitor组 84.84 ± 38.46# 369.95 ± 59.13##F 1169.458 69.113 P<0.001 <0.001
2.7 miR221-3p与p27Kip1的结合位点验证
为进一步验证miR221-3p与p27Kip1的关系,根据软件预测的结合位点序列构建了p27Kip1野生型和突变型含双荧光素酶报告基因的质粒,分别检测过表达miR221-3p对转染了p27Kip1野生型和突变型报告基因荧光素酶活性的影响。与阴性对照组比较,经miR221-3p mimic处理后,转染野生型报告基因质粒的细胞荧光素酶活性降低,差异具有统计学意义(P< 0.01),转染突变型报告基因质粒的细胞荧光素酶活性无显著变化,见图4、表8。结果表明,野生型p27Kip1存在与miR221-3p结合的点位,miR221-3p与p27Kip1结合后可靶向抑制p27Kip1的表达。

图4 miR221-3p与p27Kip1野生型、突变型结合点位的示意图Fig.4 Schematic diagram of the binding site between miR221-3p and p27Kip1 wild-type or mutant
表8 miR221-3p对p27Kip1野生型报告基因和突变型报告基因荧光素酶活性的影响(± s, n = 3)Tab. 8 Effects of miR221-3p on the luciferase activity of p27Kip1 in the wild-type and mutant(± s, n = 3)

表8 miR221-3p对p27Kip1野生型报告基因和突变型报告基因荧光素酶活性的影响(± s, n = 3)Tab. 8 Effects of miR221-3p on the luciferase activity of p27Kip1 in the wild-type and mutant(± s, n = 3)
p27Kip1 3UTR Mut luciferase activity/%阴性对照组 100.00 ± 0.00 100.00 ± 0.00 miR221-3p mimics组 58.99 ± 8.97 94.16 ± 5.87 t 7.914 1.722 P 0.001 0.160组别 p27Kip1 3UTR Wt luciferase activity/%
3 讨论
细胞周期的调控点分别是由G1期进入S期的G1/S检测点和由G2期进入M期的G2/M检测点。在肿瘤细胞中,调控点功能异常,细胞周期无法停滞,从而导致细胞无限增殖。本研究发现,扶正抗癌方能够以浓度和时间依赖性抑制H460细胞的增殖,且可提高G1期细胞数量,降低S期细胞数量,推断其可调控G1/S检测点阻滞细胞分裂由G1期进入S期,进而抑制细胞增殖。
参与细胞周期调控的分子有细胞周期蛋白(Cyclin)、细胞周期依赖性激酶(CDKs)和细胞周期依赖性激酶抑制物(CDKIs)。Cyclin D1和Cyclin E可分别与CDK4和CDK2结合,形成复合物,促使细胞分裂由G1期进入S期[10]。Cyclin D1、Cyclin E、CDK4和CDK2在多种肿瘤细胞中高表达,是预后不良的重要指标[11]。本研究发现,扶正抗癌方能够以浓度依赖性下调Cyclin D1、Cyclin E、CDK2和CDK4的表达。p27Kip1属于CDKIs,是一种细胞周期负性调节因子,可与CyclinD1-CDK4和Cyclin E-CDK2复合物结合,阻断复合物和ATP结合,阻滞细胞分裂由G1期进入S期[12]。格列卫就是将p27Kip1作为一个重要的靶点,通过阻滞细胞周期,抑制肿瘤细胞增殖[13]。本研究发现,扶正抗癌方能够以浓度依赖性上调p27Kip1mRNA及蛋白表达。
miRNAs可通过调控细胞周期相关蛋白影响细胞周期。miR320a可通过FoxM1-p27Kip1调控胃癌增殖[14],miR221可通过抑制p27Kip1促进K562细胞增殖[15]。本研究利用软件预测H460细胞中p27Kip1的上游miRNAs为miR221-3p,且扶正抗癌方能够抑制miR221-3p的表达。进一步过表达或沉默miR221-3p表达时,发现p27Kip1mRNA的表达降低或增加,表明miR221-3p能够靶向抑制p27Kip1mRNA的表达。同时,构建p27Kip1野生型和突变型含双荧光素酶报告基因的质粒,发现过表达miR221-3p后,转染野生型报告基因质粒的细胞荧光素酶活性降低,而突变型荧光素酶活性无显著变化,表明野生型p27Kip1存在与miR221-3p结合的点位。
4 结论
扶正抗癌方可通过下调miR221-3p的表达,靶向上调p27Kip1基因和蛋白质的表达,并进一步调控下游Cyclin D1、Cyclin E、CDK2和CDK4蛋白的表达,使H460细胞周期阻滞在G0/G1期而抑制细胞增殖。本研究对进一步探明扶正抗癌方治疗肿瘤的作用机制具有重要意义。
